废旧锂离子电池三元正极材料的回收与再利用工艺研究进展
2020-11-18谭燚,缪畅,聂炎,肖围
谭 燚,缪 畅,聂 炎,肖 围
(长江大学化学与环境工程学院,荆州 434023)
0 引 言
锂离子电池因其具有输出功率大、充放电效率高、使用寿命长等显著的特点,自1990年实现商业化以来,在日常生活、工业应用中得到了快速发展[1-2]。据中国轻工业信息中心数据统计,2019年全国电池制造业生产的主要产品中,锂离子电池产量达到157.2亿个,同比增长4.0%[3]。随着锂离子电池大量应用的同时,问题也逐渐暴露出来。
首先是污染问题,当电池达到使用年限后,电解液分解、SEI膜增厚、活性物质溶解等因素会导致锂离子电池的容量急剧衰减,从而无法满足产品高性能的需求,会被淘汰成为废旧电池[4]。废旧锂离子电池中同样包括正极、负极、电解液及隔膜等材料,其中正极材料大多以LiCoO2、LiMn2O4、LiNiO2、LiNixCoyMn1-x-yO2、LiFePO4为主,三元正极材料凭借其能量密度高、循环性能优异等优点已成为目前最具发展前景的材料。三元正极材料中的有价金属离子种类丰富,含量高,如果不对其进行处理或者处理不当,不仅会导致有价金属(Li、Co、Ni、Mn等)的流失,还会对水源、土壤及人体健康造成严重污染和巨大危害[5]。
其次,从资源利用的角度看,三元正极材料中含有的有价金属具有很高的回收价值。我国每年Li、Ni、Co、Mn资源严重短缺,过度依赖进口,而锂离子电池中Co约占5%~20%,Ni约占5%~10%,Mn约占7%~10%,Li约占2%~5%[6]。如若采用合适工艺对三元正极材料进行回收利用,无论是对环境改善还是经济发展,都具有较强的促进作用。
目前,行业对废旧锂离子电池的处理方法主要有以下两种:一是梯次利用。当某些锂离子电池即将退役时,虽然其无法满足当前产品的使用条件,但是可以采用降级应用的方式,在其他领域继续发挥余热[7]。二是拆解回收。将废旧锂离子电池破解拆除后,采用湿法或火法工艺提取正极材料中的有价金属离子,并进一步深加工处理[8]。本文以经过拆解的废旧锂离子电池为研究对象,采用湿法回收的工艺,着重介绍三元正极材料的预处理、有价金属的浸出与分离、三元正极材料的再合成等工艺进展,从而为废旧锂离子电池三元正极材料的回收与再利用指明发展方向。
1 三元正极材料的预处理
由于废旧锂离子电池仍含有一定的电容量,因此在分离正极材料之前,首先要将废旧锂离子电池完全放电,保障后续实验过程的安全,然后通过物理拆解的方法可将正极材料与其他组分分离。除物理拆解方法之外,丘克强[9]、谢光炎[10]等采用了真空热解技术分离废弃物中的组件。揭晓武等[11]在此基础上采用真空热解法,用热重法测定出电池外壳和隔膜的最佳挥发温度后,放入低温真空密闭环境中进行蒸发,从而减少了有害气体的排放。破解拆除得到正极材料后,活性物质由于粘结剂的存在,仍与铝箔粘连在一起,需采用合适工艺将其分离,具体处理工艺主要有以下几种。
1.1 有机溶剂法
有机溶剂溶解分离法是指采用合适的有机溶剂,利用相似相溶原理,溶解三元正极材料中的粘结剂。目前使用最为广泛的有机溶剂是N-甲基吡咯烷酮(NMP),它一般作为调浆剂用来溶解聚偏氟乙烯(PVDF)[12-13]。因此,在分离活性物质时,采用NMP溶解往往可以取得较好的结果。Li等[14]采用NMP溶解PVDF,在温度100 ℃、时间1 h的条件下,可将活性物质与铝箔完全分离,此方法的缺陷在于分离时间较长。Chen等[15]在此基础上使用超声辅助采用NMP去除PVDF,发现在80 ℃的温度下,超声30 min即可将活性物质与铝箔完全分离,大大缩短了分离时间。有机溶剂溶解法的优势在于可以高效地将活性物质与铝箔分离,且可以通过蒸馏的方式将有机溶剂回收进行反复利用,但是NMP价格昂贵、毒性较大,且对于环境有很强的污染性,不适用于绿色工业应用。
1.2 高温热解法
三元正极材料的活性物质与粘结剂的分解温度不一样,粘结剂的分解温度较低,可以利用这一差异,采用高温热解的方法使粘结剂先行分解,从而达到分离的效果。Song等[16]将三元正极材料放入马弗炉中,于450 ℃下煅烧2 h,随炉冷却后,过400目筛(0.038 mm)即可得到目标产物。这种方法操作简单,适用于大规模生产,但是获得的目标产物不纯净,会有部分铝掺杂,同时煅烧会产生HF等有害气体,需安装气体净化装置来减少有害气体的扩散[17]。Lee等[18]采用与有机溶剂溶解法相结合的方式,先用有机溶剂NMP浸泡,使集流体铝箔与活性物质分离,之后放入马弗炉中煅烧除去粘结剂。此方法的优点是可以避免铝的干扰,目标产物更加纯净,但仍然存在有害气体的释放。Sun等[19]在小于1 kPa、600 ℃的条件下,将三元正极材料煅烧30 min,获得了较好的分离效果。该方法最大的好处在于避免了有害气体的产生,不过实施的条件苛刻,不适用于大规模的工业生产。可见,高温热解法的优势在于处理工艺简单,但对能源的消耗过大,也会对环境产生一定的危害。
1.3 稀酸法
三元正极材料中的铝箔与活性物质均易溶于酸,但铝箔的溶解速率更为迅速,从而可采用稀酸破坏铝箔与活性物质间的接触面,使活性物质率先脱出。卢毅屏等[20]采用稀酸溶解-搅拌擦洗联合法对正极材料进行分离,发现在硫酸浓度0.5 mol/L、搅拌速度200 r/min、固液比1∶10、反应时间40 min的条件下分离效果最好,能将活性物质完全脱出,但活性物质中包含10.46%Al。除此之外,Gao等[21-22]研究了醋酸、甲酸等弱酸对活性物质脱出的影响,研究发现,在适宜条件下,两种酸均可将活性物质完全脱出,但是两种工艺分别存在3%和2.24%的Al析出。稀酸法的优点在于分离效果好、污染小,适用于大规模应用,但溶解效率较低,且会溶解铝箔,对后期回收有价金属离子有一定的干扰。
1.4 碱液法
碱液法是根据三元正极材料中的活性物质不与碱液发生反应,而铝箔则会与之反应生成NaAlO2,从而使活性物质从铝箔集流体上脱离。Ferreira等[23]研究了不同浓度NaOH对铝箔集流体溶解的影响,结果表明:在NaOH浓度3 mol/L、温度50 ℃、固液比100 g/L、溶解时间1 h的条件下,铝箔的溶解率可达到100%。张永禄等[24]提出了一种循环碱浸-降温结晶工艺,在NaOH浓度200 g/L、温度90 ℃的最佳条件下,将三元正极材料经NaOH溶液浸泡2 h后,可将活性物质完全浸出;之后向含Al滤出液中加入1.5 倍量的Al(OH)3晶种,在温度40 ℃条件下,降温结晶4 h,可以得到主要目标产物三水铝石,同时实现了NaOH的再生。碱液法的优势在于可以将铝箔快速溶解,在效率上比稀酸法要高。不足之处在于,碱液会与铝箔反应产生大量氢气,在处理过程中应当注意安全。
2 三元正极材料有价金属的浸出
将预处理过后的三元正极材料,通过合适的工艺浸出,使活性物质中的有价金属以离子的形式进入溶液,以便于后续的有价金属的提取以及三元正极材料再合成的工作。目前的浸出方法主要包括无机酸浸出、有机酸浸出、氨浸以及生物浸出等工艺。
2.1 无机酸浸出
三元正极材料中有价金属活性物质大都是以碱性氧化物形式存在,易溶于酸中,其中的有价金属会以离子的形式进入酸浸液。常见的酸浸剂有HCl、H2SO4、HNO3,在酸浸过程中,一般会加入适量还原剂一起浸出,其作用在于将活性物质中的高价元素还原成低价,从而更好的实现浸出。Wang等[25]采用HCl作为浸出剂发现,在HCl浓度4 mol/L、固液比20 g/L、温度80 ℃的条件下浸出1 h,Ni、Co、Mn的浸出率大于99%。HCl浸出的好处在于其本身可作为还原剂,简化了工艺步骤。Li等[26]采用H2SO4+H2O2体系浸出,发现在H2SO4浓度6 mol/L、液固比8∶1、温度60 ℃条件下浸出2 h, Ni、Co、Mn的浸出率均大于95%。Lee等[27]研究了HNO3+H2O2混合体系的浸出影响,研究发现:在没有H2O2的作用下,离子浸出率不超过80%,加入H2O2后,离子浸出率达到了99%。由此可见,酸浸过程中还原剂的存在是必要的。金玉健[28]、Saeki[29]在此基础上进行了改进,添加了超声辅助以及机械辅助浸出法,显著地提升了浸出效率。由于无机酸的价格低廉、浸出效果好,目前已成为行业应用的首选,但浸出完毕后,会产生大量废酸液,需采用特殊设备处理,进而增加了成本及对环境的危害。
2.2 有机酸浸出
大多数无机酸的腐蚀性很强,且浸出过程中可能会产生有害气体的释放,越来越多的学者将研究方向转向了有机酸浸出,其原理与无机酸基本相同。Li等[30]采用0.5 mol/L柠檬酸+1.5%体积浓度的H2O2混合浸出法,在温度90 ℃、固液比20 g/L,浸出60 min的条件下,Li、Ni、Co、Mn的浸出率均大于95%。Li等[31]和Sun等[32]分别采用乳酸、草酸进行了研究,在最佳实验条件下,Li、Ni、Co、Mn的浸出率均大于97.5%。上述方法的缺陷在于单一浸出效率低,需要与还原剂相结合才能达到更好的浸出效果。在此基础上,刘银玲等[33]做出了创新,发明了一种无需添加还原剂的浸出工艺,在维生素C浓度1 mol/L、溶解温度20 ℃、料液比45 g/L、搅拌溶解时间10 min条件下,各离子的溶解率超过99%。该方法的优势在于,无需再添加还原剂,简化了实验过程。不过维生素C的价格昂贵,不适用于大规模应用。综上,有机酸浸出相比于无机酸浸出更加环保,实验条件更温和,但价格更贵,实验成本较高。
2.3 氨 浸
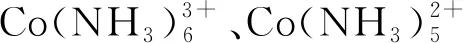
(1)
(2)
Zheng等[34]采用NH3+(NH4)2SO4+Na2SO3体系,研究发现:在4 mol/L NH3+1.5 mol/L (NH4)2SO4+0.5 mol/L Na2SO3时,温度80 ℃、固液比10 g/L、反应5 h后,Ni、Li、Co的浸出百分比分别为89.8%、95.3%、80.7%,而浸出的Mn只有4.3%。Ku等[35]研究NH3·H2O+(NH4)2SO3+(NH4)2CO3体系对于浸出的影响,通过实验发现:在1 mol/L NH3·H2O、0.5 mol/L (NH4)2SO3、1 mol/L (NH4)2CO3、温度80 ℃、浸出时间1 h的最佳条件下,Co的浸出率可达80%以上,有少量Li被浸出,而Mn几乎不被浸出。氨浸法的劣势在于目标金属离子的浸出过程中会有杂质掺入,导致分离含有微量杂质元素,但是该方法浸出效率高,对环境友好,还可以通过蒸馏等方式回收再利用,从而将收益最大化。
2.4 生物浸出
生物浸出法是利用微生物的生命运动,通过新陈代谢过程产生有机及无机酸,从而实现对有价金属离子的浸出。Horeh等[36]在116.9 g/L的蔗糖上接种体积分数为3.45%黑曲霉菌,将pH值调至5.44,黑曲霉菌产生有机酸后,在固液比为2%时,Li、Mn、Al的浸出率分别达到了100%、77%、75%,但Co与Ni的浸出率不到70%。Zeng等[37]研究酸性氧化铁硫杆菌浸出效果,以Cu作为催化剂,Co的浸出率达到了99.9%,但其他离子浸出效果不理想,浸出率不到50%。生物浸出法虽然无污染、对环境友好,但是浸出过程时间漫长、实验条件十分苛刻、微生物培养难度大等一系列原因让生物浸出法发展缓慢,还有待于深入研究后才能进入工业发展阶段。
3 浸出液中有价金属的分离
将活性物质中的金属离子浸出后,由于各种金属离子混合在一起,不便于直接后续利用。需要采取合适工艺将其进行分离,进而创造更大的效益。主要包括萃取剂分离、沉淀分离、电化学沉积、离子交换和盐析等方法。
3.1 萃取剂分离
萃取剂分离法是采用萃取剂与有机溶剂相结合的方式,萃取剂与浸出液中的各个离子形成配合物,利用配合物在两相间的溶解度不同,从而实现分离。Jha等[38]选用Cyanex272作为萃取剂,对Co的萃取效果较好,可与稀释剂相结合。研究发现:当选用15% Cyanex272作为萃取剂,3%的乙葵醇作为改性剂和煤油作为稀释剂,在pH值为5、O/A为1∶1条件下,萃取5 min,Co的萃取率达到了99%。Nayl等[39]先采用20% Acorga M5640萃取剂+煤油体系,在30 ℃条件下搅拌5 min除去Fe3+、Cu2+和Al3+等杂质离子,稍后用0.04 mol/L Na-Cyanex272试剂在不同pH值条件下浸出Mn2+、Co2+、Ni2+。通过实验发现:在pH值为3.5、5.0、8.0时,Mn2+、Co2+、Ni2+回收率达到了91.2%、89.3%、95.6%。萃取法的优势十分显著,可以定向浸出目标离子,且效率高,但萃取剂的价格昂贵,使用过程中对环境和人体有一定危害。
3.2 沉淀分离
沉淀分离是在浸出液中加入沉淀剂形成化合物,依据化合物的溶度积不同,进而调节pH值使之沉淀,得到分离。Wang等[25]先向浸出液中加入KMnO4,在温度40 ℃,pH为2的条件下,调节Mn2+与KMnO4摩尔比为2∶1,从而将Mn2+沉淀出来,回收率高达99.5%;过滤分离后继续向浸出液中加入氨水,调节pH值为9,使Ni2+以[Ni(NH3)6]2+形式存在,再加入适量的丁二酮肟以沉淀Ni2+,其回收率达到了99%。剩余的Li+、Co2+分别用Na2CO3与NaOH在适宜条件下沉淀,回收率分别达到了81%和99.3%。沉淀法分离虽然回收率高,但产品纯度不高,且分离过程中pH值的控制要求严格,因此实现工业化生产还有待研究改进。
3.3 电化学沉积法
电化学沉积法是通过控制电流密度及电位,使金属离子以单质或化合物的形式在阴极析出。Freitas等[40]采用电化学技术沉积Co2+,通过实验发现:设定电位-1.00 V,电荷密度10.0 C·cm-2后,调节pH值达到5.4,开始有Co(OH)2沉积,且pH值越大,Co2+的沉积量越大,最大沉积效率达到96.9%。Lupi等[41]先用萃取剂将Co2+分离后,选择电化学沉积法回收Ni2+,经过实验发现:在电流密度250 A/m2,温度50 ℃,pH值3.0~3.2的最佳条件下,Ni2+的回收效率可达87%。电化学沉积法的设备及操作简单,对环境友好,且具有较好的离子回收率及纯度。但对于还原电势相近的离子,例如Co2+与Ni2+,则分离效果不理想,易产生共沉积现象[42]。较好的解决方法是,与萃取剂分离法相结合,将还原电势相近的离子先用萃取剂分离其中一种后,再电沉积另一种离子。
3.4 离子交换法
离子交换法是通过选择合适的离子交换树脂,利用其对不同离子的吸附系数不同而将其分离,后采用洗脱剂等将离子洗脱出来。冯佳等[43]采用TP207作为离子交换树脂并使用H2SO4辅助,先用H2SO4浸出三元正极材料中的有价金属,稍后向浸出液中加入NaOH至pH值为4,从而将Al3+、Fe3+以氢氧化物的形式沉淀出来以排除干扰离子;再向上清液中加入37.5%HCl调节pH值至2.5,以使Cu2+能被TP207树脂饱和吸附;随后采用7%HCl作为洗脱液,用于洗脱吸附于树脂上的Cu2+,从而实现树脂的再生;最后在离子交换处理后的流出液中加入30%NaOH调节溶液pH值为10,回收Co2+,最终Co2+的回收率可达90.2%。王晓峰等[44]将络合法与离子交换法相结合,先用HCl浸出并加入氨水沉淀Al3+的氢氧化物以排除干扰离子,后向上清液中加入含NH4Cl的氨水溶液至溶液pH值为10,进而使氨与金属离子充分络合,形成络合物[Co(NH3)6]2+与[Ni(NH3)6]2+后向溶液中通入纯氧使[Co(NH3)6]2+氧化为+3价络合物[Co(NH3)5(H2O)]3+或[Co(NH3)6]3+而使Ni2+、Co2+分离。溶液反复通过弱酸性阳离子交换树脂,利用不同浓度的(NH4)2SO4溶液作为洗脱剂洗脱,并调节两种洗脱液为碱性,采用草酸盐分别回收Co、Ni金属,两者的回收率达到了89.9%和84.1%。离子交换法对于离子的回收纯度高,但回收率较低,且回收过程中步骤繁琐,对实验条件要求较高。
3.5 盐析法
盐析法是向浸出液中加入大量的无机盐使金属离子以盐或沉淀形式析出,从而达到提纯的目的。金玉健等[45]采用(NH4)2SO4饱和水溶液+无水乙醇体系对酸浸后的浸出液进行盐析。通过实验发现:当浸出液、(NH4)2SO4饱和水溶液与无水乙醇的体积比为2∶1∶3时,可将Co2+以(NH4)2Co(SO4)2的形式析出,其回收率可达92%以上。盐析法处理金属离子的回收率很高,但纯度往往不理想,在析出的过程中,有可能会伴随着其他金属的析出,从而引入杂质。目前对于盐析法析出金属离子的研究较少,但因为该方法对环境友好,势必在未来会成为一个发展趋势。
4 三元正极材料的再合成
将三元正极材料活性物质中的有价金属离子浸出后,一方面可以采取合适工艺回收金属,另一方面,则可以通过补加缺失元素比例来原位制备三元正极材料,实现电极材料的再生利用。再合成法不仅弥补了金属离子分离周期长、效率低等缺点,而且使得电极材料的利用率达到了最大。在如今资源紧张的时代,该工艺无疑会成为未来的发展趋势,其主要包括高温固相法、水热合成法、共沉淀法、溶胶凝胶法等。
4.1 高温固相法
高温固相法是向浸出液中加入金属离子盐和含锂化合物来调控材料中的金属和锂元素的比例,通过高温煅烧的方式来原位合成电极材料。史红彩等[46]先用800 ℃煅烧除去废旧三元正极材料中的粘结剂与导电剂,并以LiOH·H2O作为锂源,当两者质量比为0.5时,在马弗炉中以500 ℃煅烧5 h,再以900 ℃煅烧15 h后,电极材料所表现出的电化学性能最佳。0.1 C下,首次放电比容量达到172.1 mAh/g,30次循环后容量保持率为94.4%。李长东等[47]采用碱浸法处理废旧三元正极材料,向其浸出液中添加MnSO4、NiSO4和CoSO4等物质,使溶液中Ni2+、Co2+和Mn2+的摩尔比为1∶1∶1,经高温焙烧,固相合成得到LiNixCoyMn1-x-yO2电极材料。高温固相法的操作简便,再合成出的电极材料基本满足商业要求,但对于浸出要求较高,否则会引入杂质,此外,该方法所需能耗较高。
4.2 水热合成法
水热合成法与高温固相法原理类似,同时为了节约能耗,再合成的过程变为了在溶液中进行。梅铭等[48]对生产过程中产生的异常三元正极材料进行补锂实验,研究了不同补锂量对合成三元正极材料电化学性能的影响。研究发现:按异常三元正极材料重量分数的0.3%补加LiOH·H2O,得到的LiNi0.5Co0.2Mn0.3O2电化学性能最佳,在3.0~4.2 V以0.5 C充放电测试循环700 次,容量保持率在90%以上。Kim等[49]将经前处理的废旧三元正极材料浸入5.0 mol/L的LiOH水溶液,置于聚四氟乙烯反应釜,进行水热法再合成,200 ℃后保温20 h,所得到的正极材料在0.2 C下,其首次放电比容量可达到144.0 mAh/g,40 次循环后,容量保持率仍有92.2%。此方法的创新点在于,省略了三元正极材料中活性物质的分离过程,直接以三元正极材料作为反应物,大大简化了实验步骤。水热合成法不需要很高的能耗,同时对环境友好。但是通过该方法合成的三元正极材料循环性能差,无法正常满足产品需求。
4.3 共沉淀法
共沉淀法是向浸出液中加入硫酸盐调节有价金属的摩尔比,然后向浸出液中加入沉淀剂以及螯合剂并调控实验条件将前驱体沉淀下来,最后进行后处理制得电极材料。Sa等[50]先用NiSO4、CoSO4、MnSO4调节浸出液中Ni、Co、Mn元素比为1∶1∶1,然后采用5 mol/L NaOH作为沉淀剂,5 mol/L NH3·H2O作螯合剂。通过实验发现:在搅拌速度500 r/min、温度60 ℃、搅拌时间24 h条件下,可制得Ni1/3Co1/3Co1/3(OH)2前驱体,最后以Li2CO3作为锂源补加缺失的Li元素,经过煅烧后得到LiNi1/3Co1/3Mn1/3O2电极材料。电化学性能测试表明,0.1 C下其首次放电比容量为158 mAh/g,循环100 圈后仍有高于80%容量保持率,其反应机理如下:
(3)
(4)
在沉淀过程中,反应生成的Mn(OH)2不稳定,容易被氧化,从而影响材料的电化学性能。He等[51]用H2SO4+H2O2体系浸出三元正极材料后,向浸出液中加入NiSO4、CoSO4、MnSO4调节浸出液中Ni、Co、Mn元素比为1∶1∶1,然后采用1.8 mol/L Na2CO3和5 mol/L NH3·H2O分别作为沉淀剂和螯合剂。结果表明:在pH值为7.5,搅拌速度700 r/min、60 ℃的条件下、反应12 h可制得前驱体,经混锂煅烧即得电极材料。电化学性能测试表明:0.1 C其首次放电比容量为163.5 mAh/g,循环50 圈后容量保持率为94.1%。其反应机理如下:
(5)
(6)
共沉淀法具有可操作性强、制备的前驱体纯度高等优点,目前已成为制备前驱体的首选方法,但在制备过程中易混入杂质,对产品电化学性能的影响较大。
4.4 溶胶凝胶法
溶胶凝胶法是以有机酸为螯合剂,与活性物质进行水解缩合等化学反应,经加热得到溶胶体系,采取煅烧等工艺制备电极材料。Yao等[52]首先采用柠檬酸+双氧水体系浸出有价金属离子,稍后补加LiNO3、Ni(NO3)2·6H2O、Co(NO3)2·6H2O和Mn(NO3)2,调节金属离子比例为3.05∶1∶1∶1。通过研究发现,用NH3·H2O调节pH至8.0,80 ℃条件下加热可得到透明溶胶,待干燥后,用马弗炉将干燥凝胶在350 ℃下煅烧2 h,750 ℃下保温12 h,从而获得新的电极材料。经过电化学性能测试发现,在1 C倍率下,首次放电比容量可达147 mAh/g,循环50 圈后容量保持率为93%,此性能与新材料相当。这主要是因为柠檬酸作为螯合剂能够产生较多的羧基,从而促进了溶胶形成过程,使得电极材料的粒径较小、分布均匀。Li等[53]对比了以乙酸和马来酸作为螯合剂制备电极材料的电化学性能。测试结果表明,以马来酸作为螯合剂要更好一些,原因在于马来酸通过酯化能形成更加稳定的螯合金属离子,而乙酸的螯合能力相对较弱。溶胶凝胶法制备电极材料的电化学性能基本可与同等商业材料相媲美,但是对实验条件要求较高,需精准把控溶胶凝胶形成的条件,否则容易产生杂质,导致前驱体不纯净。
5 结语与展望
在资源短缺和环境问题日益严峻的当今时代,废旧锂离子电池的回收模式应当更加规范化、高效化、绿色化。尽管各个回收和处理环节的工艺步骤已经有较多研究,但如何使之更加环保、更加有效,一直是该领域需要不断摸索的方向。基于目前废旧锂离子电池回收现状,可以做出如下展望:废旧锂离子电池三元正极材料的预处理及有价金属的提取过程中需要用到大量的化学试剂,这些试剂对环境的危害不可忽视,切实希望能开发出更高效的物理或者化学方法,从而减轻危害或根本上解决问题。而浸出液中有价金属的分离与再合成是高值化利用废旧锂离子电池三元正极材料的重要举措,目前主流的工艺方法普遍存在着能源消耗大、流程长、污染性强等问题。因此,如何将回收工艺做到更低成本、更高效、更绿色,将是该工艺的进一步发展方向。
