右美托咪定对大鼠机械通气肺损伤的作用及机制
2020-11-16张本旺侯欣位于春锐孙立新
张本旺 侯欣位 于春锐 孙立新
[摘要] 目的 評价胆碱能抗炎通路(CAP)在右美托咪定(DEX)抑制大鼠机械通气肺损伤(VILI)及VILI时NLRP3炎症小体激活中的作用。方法 将48只SD大鼠随机分为自主呼吸对照组(C组)、大潮气量组(H组)、DEX组、α-7烟碱型乙酰胆碱受体拮抗剂α-银环蛇毒素(α-BGT)组,每组12只。4组大鼠均行气管切开插管术。C组大鼠保持自主呼吸,H组、DEX组、α-BGT组大鼠均以20 mL/kg潮气量行机械通气,DEX组和α-BGT组大鼠于机械通气前1 h经颈内静脉输注DEX 5 μg/(kg·h),α-BGT组于输注DEX前15 min经腹腔注射α-BGT 1 μg/kg。4 h后麻醉处死大鼠,收集血清、肺组织标本、支气管肺泡灌洗液(BALF)。光镜下观察肺组织病理学改变,测定肺损伤评分及肺组织湿/干质量比(W/D);应用逆转录-聚合酶链反应(RT-PCR)及蛋白质免疫印迹试验(Western Blot)分别检测肺组织中NLRP3、凋亡相关斑点样蛋白(ASC)、天冬氨酸半胱氨酸蛋白酶-1(caspase-1)的mRNA及蛋白表达;应用酶联免疫吸附试验(ELISA)测定BALF中总蛋白含量以及血清、BALF中白细胞介素(IL)-1β、IL-18的含量。结果 与C组比较,H组、DEX组、α-BGT组大鼠肺损伤评分、肺组织W/D和BALF中总蛋白含量均升高(F=3.130~8.266,t=2.270~11.900,P<0.05),肺组织内NLRP3、ASC及caspase-1的mRNA及蛋白表达均上调(F=2.384~45.256,t=2.195~10.992,P<0.05),血清和BALF中IL-1β、IL-18的含量均升高(F=2.053~35.522,t=3.109~8.242,P<0.05);与H组比较,DEX组上述各指标均降低(t=2.313~5.487,P<0.05);与DEX组比较,α-BGT组上述各指标均升高(t=2.195~5.050,P<0.05)。结论 DEX通过抑制NLRP3炎症小体的激活减轻大鼠VILI,其作用机制与CAP有关。
[关键词] 右美托咪啶;呼吸机相关性肺损伤;胆碱能抗炎通路;炎性体;大鼠
[中图分类号] R563.9;R971.3 [文献标志码] A [文章编号] 2096-5532(2020)06-0704-06
doi:10.11712/jms.2096-5532.2020.56.151 [开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20200714.1410.006.html;
[ABSTRACT] Objective To investigate the role of the cholinergic anti-inflammatory pathway (CAP) in the inhibition of ventilator-induced lung injury (VILI) by dexmedetomidine (DEX) and the activation of NACHT-LRR-PYD-containing proteins 3 (NLRP3) inflammasome in rats. Methods A total of 48 Sprague-Dawley rats were randomly divided into spontaneous brea-thing control group (group C), large tidal volume group (group H), DEX group (group DEX), and α7nAChR antagonist α-BGT group (group α-BGT), with 12 rats in each group. Tracheostomy and intubation were performed for all groups. The rats in group C maintained spontaneous breathing, and those in groups H, DEX, and α-BGT were given mechanical ventilation with a tidal vo-lume of 20 mL/kg; the rats in groups DEX and α-BGT received the infusion of DEX 5 μg/(kg·h) via the internal jugular vein at 1 h before mechanical ventilation, and those in group α-BGT were given intraperitoneal injection of α-BGT 1 μg/kg at 15 min before DEX infusion. The rats were anesthetized and sacrificed 4 h later to collect the samples of blood serum, lung tissue, bronchoalveolar lavage fluid (BALF). Lung histopathological changes were observed under a light microscope, and lung injury score and wet/dry (W/D) ratio of lung tissue were measured. RT-PCR and Western blot were used to measure the mRNA and protein expression of NLRP3, apoptosis-associated speck-like protein (ASC), and caspase-1 in lung tissue, and ELISA was used to measure the level of total protein in BALF and the levels of interleukin-1β (IL-1β) and interleukin-18 (IL-18) in serum and BALF. Results Compared with group C, groups H, DEX, and α-BGT had significant increases in lung injury score, W/D ratio of lung tissue, and content of total protein in BALF (F=3.130-8.266,t=2.270-11.900,P<0.05), significant increases in the mRNA and protein expression of NLRP3, ASC, and caspase-1 in lung tissue (F=2.384-45.256,t=2.195-10.992,P<0.05), and significant increases in the levels of IL-1β and IL-18 in serum and BALF (F=2.053-35.522,t=3.109-8.242,P<0.05). Compared with group H, group DEX had significant reductions in the above indices (t=2.313-5.487,P<0.05), and compared with group DEX, group α-BGT had significant increases in the above indices (t=2.195-5.050,P<0.05). Conclusion DEX alleviates VILI in rats by inhibiting the activation of NLRP3 inflammasome, and its mechanism of action may be associated with the CAP pathway.
[KEY WORDS] dexmedetomidin; ventilator-induced lung injury; cholinergic anti-inflammatory pathway; inflammasome; rats
机械通气肺损伤(VILI)是指机械通气时反生理正压通气引起的一种肺部并发症,其具体病因包括机械通气时机械外力对肺泡的直接损伤,以及肺部和循环系统中炎症通路的激活及炎性因子的释放[1]。VILI可促进肺泡巨噬细胞中活性氧(ROS)的释放,而ROS是NLRP3炎症小体激活的始动因素之一[2]。NLRP3炎症小体隶属于核苷酸结合寡聚化结构域样受体家族,由于其激活后可促进促炎症因子白细胞介素(IL)-1β、IL-18的成熟与释放,所以NLRP3炎症小体在炎症反应的发生发展中有重要作用[3]。胆碱能抗炎通路(CAP)属于神经调控通路,通过激活巨噬细胞表面α-7烟碱型乙酰胆碱受体(α7nAChR),抑制核转录因子(NF)-κB的核易位,从而抑制炎性因子的释放,发挥抗炎作用[4]。右美托咪定(DEX)是α2肾上腺素能受体激动剂,除作为麻醉镇静药物外,还具有器官保护及抗炎作用[5]。研究表明,DEX可抑制NLRP3炎症小体的激活,阻碍下游炎性因子IL-1β、IL-18的成熟与释放,从而抑制炎症反应,发挥肺保护作用[6]。但DEX的作用机制是否与CAP有关目前尚不明确,本研究拟评价CAP在DEX抑制大鼠VILI时NLRP3炎症小体激活中的作用,探讨其抗炎机制。
1 材料与方法
1.1 实验动物
清洁级雄性SD大鼠48只,8周龄,体质量为240~260 g,由济南朋悦实验繁育有限公司提供,动物合格证号SCXK(鲁)20140007。于23~26 ℃室温、安静环境下常规饲养1周以适应环境。采用随机数字表法将大鼠分为自主呼吸对照组(C组)、大潮气量组(H组)、DEX组和α7nAChR拮抗剂α-银环蛇毒素(α-BGT)组,每组12只。
1.2 试剂及仪器
NLRP3、凋亡相关斑点样蛋白(ASC)、天冬氨酸半胱氨酸蛋白酶-1(caspase-1)及内参β-actin引物(GENEWIZ,美国),NLRP3、ASC、caspase-1、内参β-actin一抗以及山羊抗兔二抗(台湾Arigo生物技术有限公司),Trizol总RNA提取试剂(北京天根生化科技有限公司),BCA蛋白浓度检测试剂盒(上海碧云天生物技术有限公司),酶联免疫吸附试验(ELISA)试剂盒(武汉华美生物工程有限公司),小动物呼吸机(型号:RWD 407,深圳市瑞沃德生命科技有限公司),荧光定量PCR仪(型号:ABI 7500,Applied Biosystems,美国)。
1.3 实验方法
1.3.1 模型制备 4组大鼠均于实验前8 h禁食,自由饮水,经腹腔注射30 g/L戊巴比妥鈉50 mg/kg麻醉后行气管切开插管术,经右侧颈内静脉建立静脉通路。参考相关文献的方法制备大鼠VILI模型[7]。C组大鼠保持自主呼吸;而H组、DEX组和α-BGT组大鼠均经右侧颈内静脉注射罗库溴铵0.1 mg/kg,待大鼠自主呼吸消失后给予机械通气。DEX组和α-BGT组大鼠于机械通气前1 h经颈内静脉输注DEX 5 μg/(kg·h),C组、H组大鼠输注等量的生理盐水;α-BGT组大鼠于输注DEX前15 min经腹腔注射α-BGT 1 μg/kg,C组、H组、DEX组大鼠输注等量生理盐水。机械通气参数设置:潮气量为20 mL/kg,吸呼比为1∶1,呼吸频率为80 min-1,吸入氧体积分数(FiO2)为0.21,呼气末正压(PEEP)为0 kPa。机械通气4 h后麻醉处死大鼠,收集标本。
1.3.2 标本采集 机械通气4 h后经右侧颈动脉采血5 mL,离心(4 ℃,3 000 r/min)10 min,取上清于-80 ℃保存备检;然后麻醉处死大鼠,迅速剖出肺脏,结扎右肺,分别取右肺上叶、中叶、下叶备检;用预冷的磷酸盐缓冲液(PBS)2 mL经气管导管灌洗大鼠左肺3次,收集支气管肺泡灌洗液(BALF)4~5 mL,离心(4 ℃,3 000 r/min)15 min,取上清置于-80 ℃保存备检。
1.3.3 肺组织病理学观察 取大鼠右肺中叶,用40 g/L多聚甲醛固定24 h,行石蜡包埋、切片、苏木素-伊红(HE)染色,光镜下观察。
1.3.4 肺组织湿/干质量比(W/D)测定 取大鼠右肺上叶,用滤纸吸干表面水分,称湿质量;然后将其放入80 ℃电热烘干箱烘干,称干质量。计算各组大鼠肺组织W/D。
1.3.5 肺损伤评分测定 参考文献的方法行肺损伤评分[8]。从肺组织水肿、出血、中性粒细胞浸润、小气道损伤等4个方面进行评分,每项根据病变轻重评为0~4分(0分代表无病变或非常轻微病变,1分代表轻度病变,2分代表中度病变,3分代表重度病变,4分代表极重度病变),4 项累计总分即为肺损伤评分。
1.3.6 BALF中总蛋白测定 用BCA蛋白浓度检测试剂盒检测大鼠BALF中总蛋白含量,操作依据说明书进行。
1.3.7 NLRP3、ASC、caspase-1 mRNA 表达测定取大鼠右肺下叶部分组织,经液氮研磨后用Trizol一步法提取肺组织总RNA,操作按照说明书进行。采用逆转录-聚合酶链反应(RT-PCR)法测定大鼠肺组织中NLRP3、ASC、caspase-1 mRNA 表达。用cDNA合成试剂盒合成cDNA,用ABI 7500型荧光定量PCR仪分别扩增NLRP3、ASC、caspase-1的mRNA。RT-PCR条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,共40个循环。以2-ΔΔCt(ΔCt=目的基因Ct值-内参基因Ct值)代表目的基因mRNA表达,数据分析采用仪器自带软件。
1.3.8 NLRP3、ASC、caspase-1蛋白表达测定 采用蛋白质免疫印迹试验(Western Blot)检测大鼠肺组织中NLRP3、ASC、caspase-1蛋白表达。将大鼠右肺下叶部分组织放入预冷研钵中研磨,然后加入组织细胞裂解液,于冰上静置30 min,离心(4 ℃,12 000 r/min)15 min,取上清。取总蛋白样品,加入5×上样缓冲液,95 ℃反应10 min后行SDS-PAGE电泳,PVDF膜湿转法转膜(电流130 mA,电压60 V)60 min;分别加入内参β-actin一抗(1∶5 000),NLRP3一抗(1∶1 000)、ASC一抗(1∶1 000)、caspase-1一抗(1∶1 000),4 ℃过夜,以1×TBST洗涤3次,每次10 min;加山羊抗兔二抗(1∶5 000)室温下孵育1 h,以1×TBST洗涤3次,每次10 min;采用IMAGE J软件(NIH公司,美国)扫描蛋白条带灰度值,用蛋白条带灰度值与内参β-actin条带灰度值的比值表示目的蛋白的表达。
1.3.9 IL-1β和IL-18含量检测 采用ELISA试剂盒测定大鼠血清和BALF中的IL-1β、IL-18 含量,操作依据说明书进行。
1.4 统计学分析
采用SPSS 19.0统计学软件进行统计分析,计量数据以±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
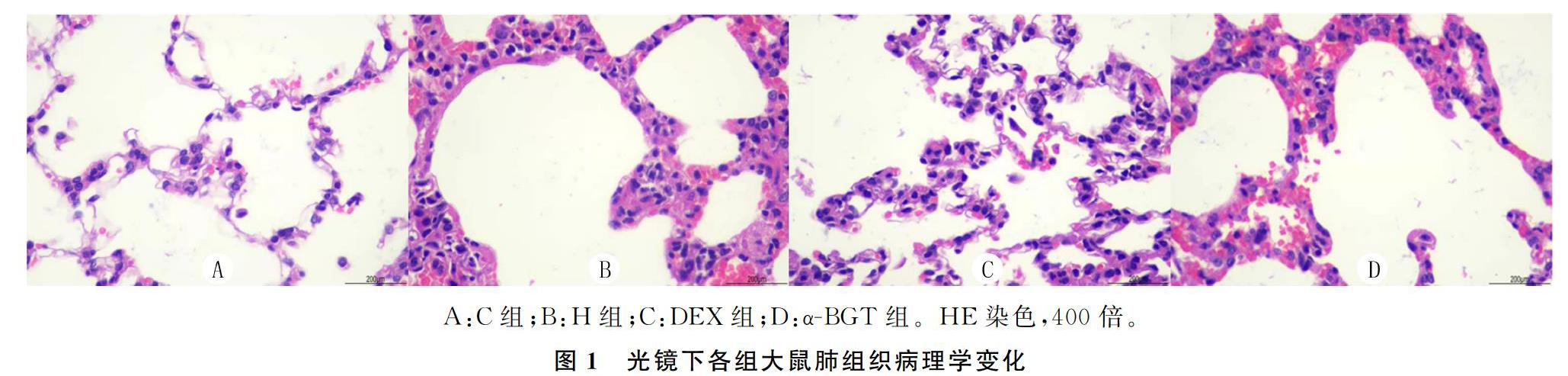
2.1 各组大鼠肺组织病理学变化
光镜下,C组大鼠肺泡结构正常、边界清楚,无炎性细胞浸润;H组大鼠肺泡结构破坏,肺泡壁破裂,肺间质明显水肿,有中性粒细胞等炎性细胞浸润;与H组比较,DEX组大鼠肺组织损伤减轻,肺泡壁相对完整,肺间质水肿程度减轻,可见少量炎性细胞浸润;与DEX组比较,α-BGT组大鼠肺组织损伤加重,肺泡壁不连续,肺间质水肿明显,炎性细胞浸润增多。见图1。
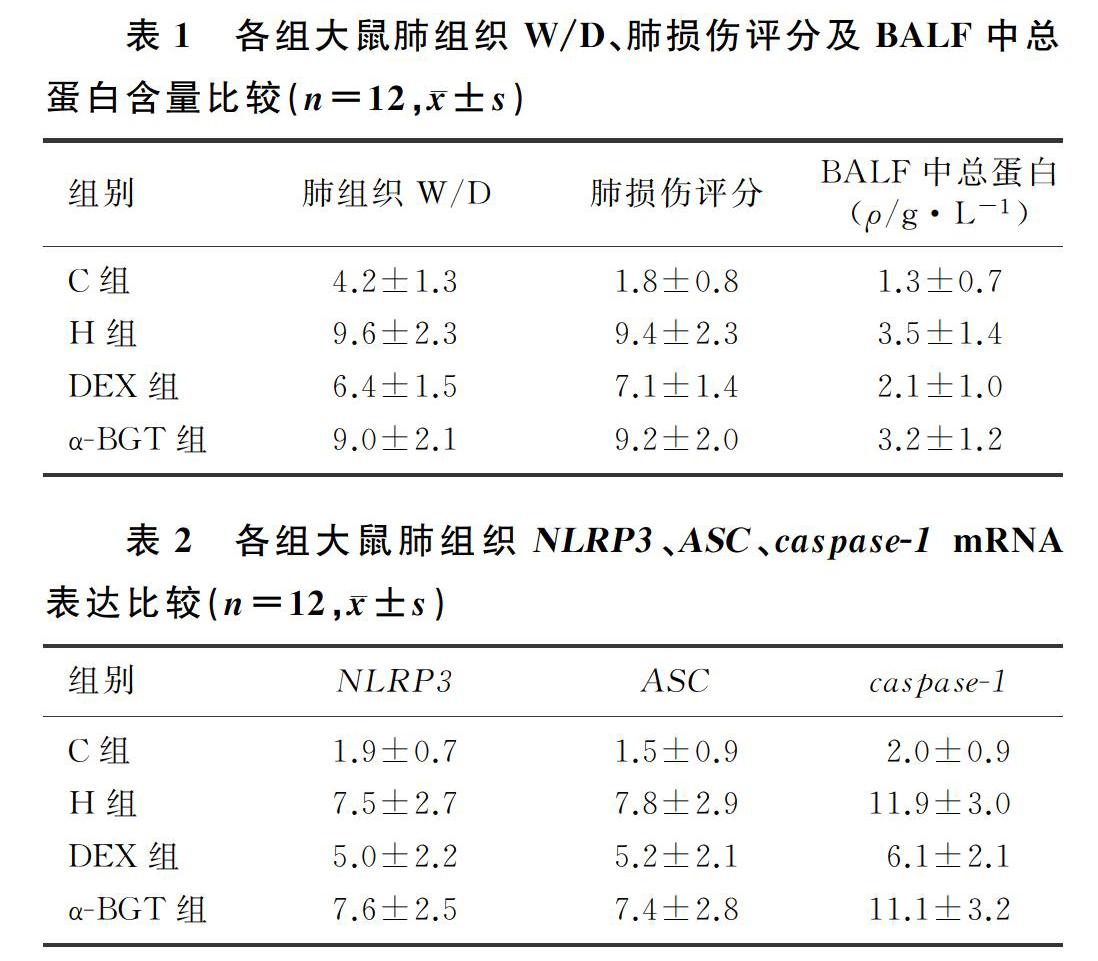
2.2 各组大鼠肺组织W/D比较
与C组比较,H组、DEX组、α-BGT组大鼠肺组织W/D均升高(F=3.130,t=3.840~7.080,P<0.05);与H组比较,DEX组大鼠肺组织W/D降低(t=4.037,P<0.05);与DEX组比较,α-BGT组大鼠的肺组织W/D升高(t=3.490,P<0.05)。见表1。
2.3 各组大鼠肺损伤评分比较
与C组比较,H组、DEX组、α-BGT组大鼠肺损伤评分均升高(F=8.266,t=10.811~11.900,P<0.05);与H组比较,DEX组大鼠肺损伤评分降低(t=2.959,P<0.05);与DEX组比较,α-BGT组大鼠肺损伤评分升高(t=2.980,P<0.05)。见表1。
2.4 各组大鼠BALF中总蛋白含量比较
与C组相比较,H组、DEX组、α-BGT组大鼠BALF中总蛋白含量均升高(F=4.000,t=2.270~4.869,P<0.05);与H组比较,DEX组大鼠BALF中总蛋白含量降低(t=2.819,P<0.05);与DEX组比较,α-BGT组大鼠BALF中总蛋白含量升高(t=2.439,P<0.05)。见表1。
2.5 各组大鼠肺组织中NLRP3、ASC、caspase-1 mRNA表达比较
与C组比较,H组、DEX组、α-BGT组大鼠肺组织中NLRP3、ASC、caspase-1 mRNA表达均上调(F=5.444~14.878,t=4.795~10.992,P<0.05);与H组大鼠相比较,DEX组大鼠肺组织中NLRP3、ASC、caspase-1 mRNA表达均下调(t=2.487~5.487,P<0.05);与DEX组比较,α-BGT组大鼠肺组织中NLRP3、ASC、caspase-1 mRNA表达上调,差异具有统计学意义(t=2.195~4.527,P<0.05)。见表2。
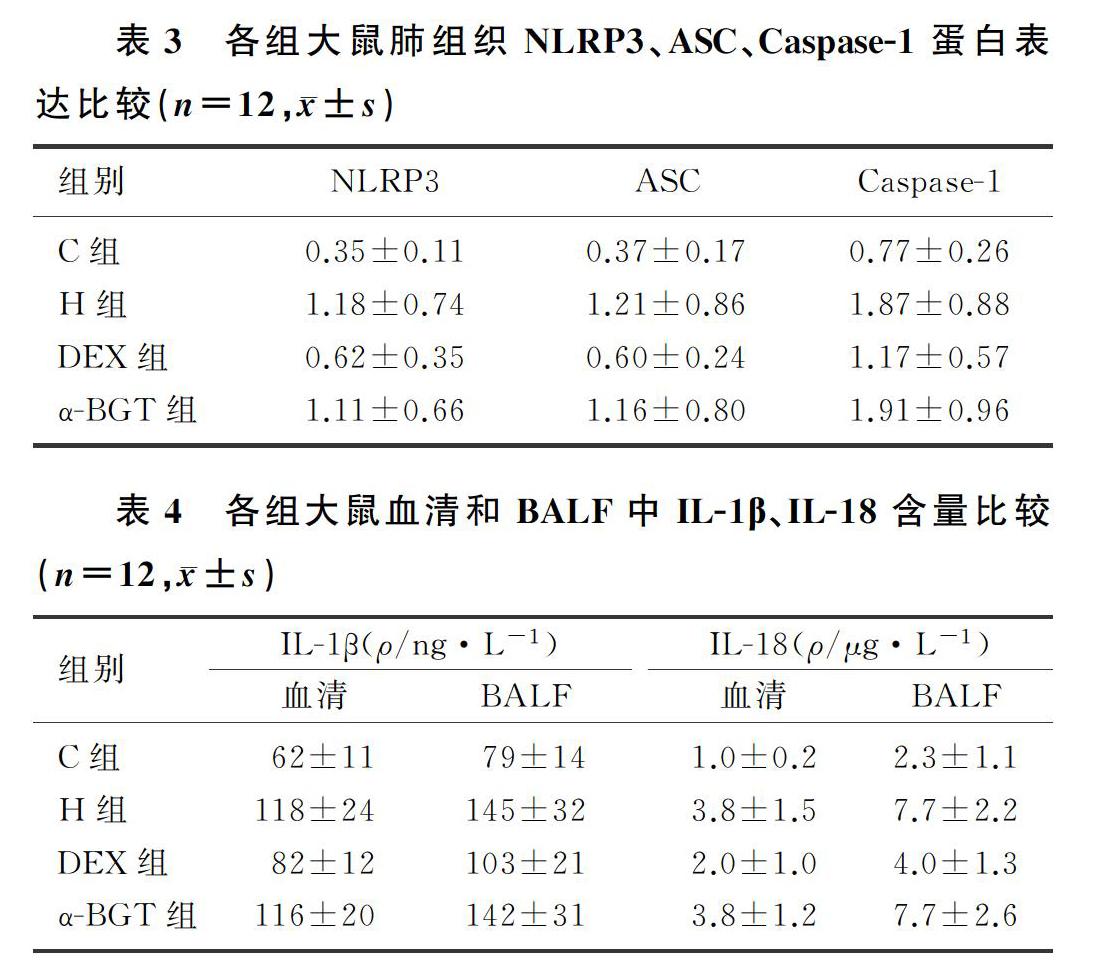
2.6 各组大鼠肺组织NLRP3、ASC、Caspase-1蛋白表达比较
与C组比较,H组、DEX组、α-BGT组大鼠肺组织中NLRP3、ASC、Caspase-1蛋白表达均上调(F=2.384~45.256,t=2.212~3.843,P<0.05);与H组相比较,DEX组大鼠肺组织中NLRP3、ASC、Caspase-1蛋白表达均下调(t=2.313~2.370,P<0.05);与DEX组相比较,α-BGT组大鼠肺组织中NLRP3、ASC、Caspase-1蛋白表达上调(t=2.272~2.323,P<0.05)。见表3。
2.7 各组大鼠血清和BALF中IL-1β、IL-18含量的比较
与C组相比较,H组、DEX组、α-BGT组大鼠血清和BALF中的IL-1β、IL-18含量均升高(F=2.053~35.522,t=3.109~8.242,P<0.05);与H组比较,DEX组大鼠血清和BALF中IL-1β、IL-18含量均降低(t=3.413~5.016,P<0.05);與DEX组比较,α-BGT组大鼠血清和BALF中IL-1β、IL-18含量均升高,差异有显著性(t=3.608~5.050,P<0.05)。见表4。
3 讨 论
机械通气在临床工作中应用广泛,在急诊抢救、呼吸支持及气道管理中均发挥不可替代的作用。其主要功能包括增加肺泡通气量,减少呼吸肌做功,改善氧合状态等[9],及时有效的机械通气对于病人的呼吸及生存至关重要。但机械通气的并发症,如VILI,也给病人健康造成影响,给临床工作带来挑战。VILI的主要发生机制包括机械性损伤和生物性损伤,机械通气时机械外力除直接损伤肺泡结构外,还可促进肺泡及全身循环系统中炎性因子的释放,引发“瀑布样”炎症反应[10],严重威胁病人健康与生命。但VILI的具体发生机制尚不明确,防治措施尚不成熟。
本實验参考相关文献的方法制备大鼠VILI模型[7],结果显示,H组大鼠光镜下可见肺泡壁断裂,毛细血管充血,肺间质水肿,中性粒细胞等炎性细胞浸润;其肺损伤评分、肺组织W/D和BALF中总蛋白含量等较C组均明显升高,证明大鼠VILI模型的制备方法正确可靠。
DEX是α2肾上腺素能受体激动剂,除用于重症监护室病人的镇静镇痛及作为麻醉辅助药物外,还对多种器官具有保护作用,其中包括肺脏[11]。既往研究已显示,DEX可下调晚期糖基化终末产物受体(RAGE)表达,减轻大鼠脓毒症引起的急性肺损伤[12];可抑制IL-17表达,减弱IL-17对NF-κB信号通路的刺激,抑制炎症反应[13];也可参与高迁移率蛋白1(HMGB1)介导的Toll样受体4(TLR4)/NF-κB通路和磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素靶蛋白(PI3K/Akt/mTOR)通路,负性调控炎症反应过程[14]。本实验参考相关文献[15]以及预实验的结果,于机械通气前1 h经颈内静脉输注DEX 5 μg/(kg·h)。实验结果显示,与H组比较,DEX组大鼠光镜下肺泡壁破坏、肺间质水肿及炎性细胞浸润情况减轻;肺损伤评分、肺组织W/D和BALF中总蛋白含量较C组均减低,表明DEX预处理可减轻大鼠VILI。
研究发现,DEX可通过抑制NLRP3炎症小体的激活,减轻脂多糖诱导的急性肺损伤[6]。NLRP3炎症小体是核苷酸结合寡聚化结构域样受体家族的一员,是一种位于细胞质内的模式识别受体,在多种细胞如巨噬细胞、淋巴细胞中表达[16]。NLRP3炎症小体是一种蛋白质复合体,主要由NLRP3、ASC和前体半胱氨酸天冬氨酸酶-1(pro-caspase-1)3部分组成[17]。机械通气时,机械外力除对肺泡造成直接损伤外,还可以导致肺泡巨噬细胞线粒体内ROS的聚集[18]。NLRP3可以对ROS等刺激产生反应,即自身发生结构寡聚化转变为效应结构域,效应结构域可以招募ASC。ASC是一种接头蛋白,其主要结构包括半胱天冬酶募集域(CARD)和热蛋白结构域(PYD),PYD可以与NLRP3的N末端相结合,CARD可以招募并结合pro-caspase-1,最终形成NLRP3炎症小体[19-20]。NLRP3炎症小体激活后,pro-caspase-1可转变为成熟的caspase-1,并促进下游IL-1β、IL-18的成熟与释放,启动级联式炎症反应[21]。本文的实验结果也显示,H组大鼠肺组织中NLRP3、ASC和caspase-1的mRNA及蛋白表达较C组均明显上调,血清和BALF中IL-1β、IL-18的含量也较C组显著升高,表明VILI时NLRP3炎症小体被激活,而激活后的NLRP3炎症小体促进了炎性因子IL-1β、IL-18的成熟与释放,引起炎症反应的爆发。与H组相比较,DEX组大鼠肺组织中NLRP3、ASC、caspase-1的mRNA及蛋白表达均下调,血清和BALF中IL-1β、IL-18的含量降低,表明DEX可抑制大鼠VILI时NLRP3炎症小体的激活,阻碍下游炎性因子的成熟与释放,负性调控炎症反应。但DEX抑制NLRP3炎症小体激活的机制尚不明确。
XIANG等[22]的研究表明,DEX可以通过激活CAP减轻系统性炎症反应。CAP是一种通过自主神经系统调控免疫应答的调节机制,炎症、感染或缺血等刺激均可触发CAP[23]。研究发现,迷走神经在CAP中占据主导地位,它由70%~80%的传入信号和20%~30%的传出信号组成,维持多种生理机制,如免疫反应、呼吸功能等[24]。在急性炎症过程中,迷走神经传出信号的激活会导致交感神经激活和去甲肾上腺素的释放,以及神经节后支配肺组织的胆碱能神经元的激活,使肺内乙酰胆碱(ACh)的浓度升高,ACh浸润可以刺激α7nAChR炎性细胞,如巨噬细胞、中性粒细胞等,从而抑制NF-κB的活化及促炎因子的分泌,发挥抗炎作用,而α7nAChR是CAP发挥抗炎作用的最主要的胆碱受体[25]。α-BGT是α7nAChR的特异性拮抗剂,本实验α-BGT组在给予DEX 15 min前经腹腔注射α-BGT 1 μg/kg[26]。实验结果显示,与DEX组比较,α-BGT组大鼠光镜下肺泡损伤及肺组织水肿情况加重;肺损伤评分、肺组织W/D和BALF中总蛋白含量均明显升高,表明α-BGT通过抑制CAP,抵消了DEX对大鼠VILI保护作用。同时,α-BGT组大鼠肺组织中NLRP3、ASC、caspase-1的mRNA及蛋白表达较DEX组均上调,血清和BALF中IL-1β、IL-18含量也较DEX组升高,表明α-BGT通过抑制CAP,消除了DEX对VILI时NLRP3炎症小体激活的抑制作用,提示DEX抑制VILI时NLRP3炎症小体的激活可能与CAP的激活有关。
综上所述,DEX可通过抑制NLRP3炎症小体的激活减轻大鼠VILI,其作用机制可能与CAP的激活有关。
[参考文献]
[1] WANG T, GROSS C, DESAI A A, et al. Endothelial cell signaling and ventilator-induced lung injury: molecular mechanisms, genomic analyses, and therapeutic targets[J]. American Journal of Physiology-Lung Cellular and Molecular Phy-siology, 2017,312(4):L452-L476.
[2] HE Y, HARA H, NUNEZ G. Mechanism and regulation of NLRP3 inflammasome activation[J]. Trends Biochem Sci, 2016,41(12):1012-1021.
[3] JO E K, KIM J K, SHIN D M, et al. Molecular mechanisms regulating NLRP3 inflammasome activation[J]. Cellular & Molecular Immunology, 2016,13(2):148-159.
[4] BAEZ-PAGAN C A, DELGADO-VELEZ M, LASALDE-DOMINICCI J A. Activation of the macrophage alpha7 nicotinic acetylcholine receptor and control of inflammation[J]. J Neuroimmune Pharmacol, 2015,10(3):468-476.
[5] YAN X T, CHENG X L, ZHOU L W, et al. Dexmedetomidine alleviates lipopolysaccharide-induced lung injury in Wistar rats[J]. Oncotarget, 2017,8(27):44410-44417.
[6] ZHANG Y, WANG X, LIU Z, et al. Dexmedetomidine atte-nuates lipopolysaccharide induced acute lung injury by targeting NLRP3 via miR-381[J]. J Biochem Mol Toxicol, 2018,32(11):e22211.
[7] WU J Y, XIONG Z H, XIONG G Z, et al. Protective effect of interleukin-10 and recombinant human keratinocyte growth factor-2 on ventilation-induced lung injury in rats[J]. Genetics and Molecular Research, 2015,14(4):15642-15651.
[8] KISS T, SILVA P L, HUHLE R, et al. Comparison of diffe-rent degrees of variability in tidal volume to prevent deterioration of respiratory system elastance in experimental acute lung inflammation[J]. Br J Anaesth, 2016,116(5):708-715.
[9] SUN Z P, WANG F Q, YANG Y Y, et al. Resolvin D1 atte-nuates ventilator-induced lung injury by reducing HMGB1 release in a HO-1-dependent pathway[J]. International Immunopharmacology, 2019,75:105825.
[10] NIEMAN G F, SATALIN J, KOLLISCH-SINGULE M, et al. Physiology in Medicine: understanding dynamic alveolar physiology to minimize ventilator-induced lung injury[J]. Journal of Applied Physiology, 2017,122(6):1516-1522.
[11] AFONSO J, REIS F. Dexmedetomidine:current role in anesthesia and intensive care[J]. Revista Brasileira De Anestesiologia, 2012,62(1):118-133.
[12] HU H, SHI D, HU C, et al. Dexmedetomidine mitigates CLP-stimulated acute lung injury via restraining the RAGE pathway[J]. Am J Transl Res, 2017,9(12):5245-5258.
[13] ZHANG Y, JIA S S, GAO T Q, et al. Dexmedetomidine mi-tigate acute lung injury by inhibiting IL-17-induced inflammatory reaction[J]. Immunobiology, 2018,223(1):32-37.
[14] LIANG S, WANG Y, LIU Y. Dexmedetomidine alleviates lung ischemia-reperfusion injury in rats by activating PI3K/Akt pathway[J]. Eur Rev Med Pharmacol Sci, 2019,23(1):370-377.
[15] 張成栋,曹净净,刘群,等. 右美托咪定对大鼠脊髓缺血再灌注时细胞凋亡的影响[J]. 中华麻醉学杂志, 2017,37(10):1222-1225.
[16] ZHONG Y F, KINIO A, SALEH M. Functions of NOD-like receptors in human diseases[J]. Front Immunol, 2013,4:333.
[17] GRIEBEL T, MAEKAWA T, PARKER J E. NOD-like receptor cooperativity in effector-triggered immunity[J]. Trends in Immunology, 2014,35(11):562-570.
[18] ZHU W, HUANG Y, YE Y, et al. Deferoxamine preconditioning ameliorates mechanical ventilation-induced lung injury in rat model via ROS in alveolar macrophages: a randomized controlled study[J]. BMC Anesthesiol, 2018,18(1):116.
[19] GAIDT M M, HORNUNG V. The NLRP3 inflammasome renders cell death pro-inflammatory[J]. J Mol Biol, 2018,430(2):133-141.
[20] KIM J K, JIN H S, SUH H W, et al. Negative regulators and their mechanisms in NLRP3 inflammasome activation and signaling[J]. Immunol Cell Biol, 2017,95(7):584-592.
[21] SONG N, LIU Z S, XUE W, et al. NLRP3 Phosphorylation is an essential priming event for inflammasome activation[J]. Mol Cell, 2017,68(1):185-197.
[22] XIANG H, HU B, LI Z F, et al. Dexmedetomidine controls systemic cytokine levels through the cholinergic anti-inflammatory pathway[J]. Inflammation, 2014,37(5):1763-1770.
[23] HILDERMAN M, QURESHI A R, ABTAHI F, et al. The cholinergic anti-inflammatory pathway in resistant hypertension treated with renal denervation[J]. Mol Med, 2019,25(1):39.
[24] MURRAY K, REARDON C. The cholinergic anti-inflammatory pathway revisited[J]. Neurogastroenterol Motil, 2018,30(3):e13288.
[25] YAMADA M, ICHINOSE M. The cholinergic anti-inflammatory pathway: an innovative treatment strategy for respiratory diseases and their comorbidities[J]. Current Opinion in Pharmacology, 2018,40:18-25.
[26] 劉薇,严虹,陈璟莉,等. 胆碱能抗炎通路在右美托咪定预先给药减轻肠缺血再灌注大鼠急性肺损伤中的作用[J]. 中华麻醉学杂志, 2018,38(8):1005-1008.
(本文编辑 马伟平)
