肺腺癌病人外周血miR-1293、miR-5571和miR-615表达及其与预后关系
2020-11-16张妮赵龙刘晓莉孔雨佳
张妮 赵龙 刘晓莉 孔雨佳

[摘要] 目的 探讨肺腺癌病人血液中miR-1293、miR-5571和miR-615的表达水平及其与预后的相关性。方法 收集100例经术后病理诊断为肺腺癌病人的新鲜血液标本(肺腺癌组),抽提血液中的总RNA,应用实时荧光定量PCR方法检测其miR-1293、miR-5571和miR-615的表达水平,并分析其与预后的相关性。以100例健康体检者血液标本作为对照组。结果 与对照组比较,肺腺癌组miR-1293和miR-615表达显著增高,miR-5571表达降低,差异有统计学意义(t=23.106~27.375,P<0.05)。Log-rank分析显示,3种miRNA的表达均与肺腺癌病人的总生存率和无病生存率相关(χ2=18.357~19.620,P<0.05),其中miR-1293和miR-615表达水平越高,病人总生存率和无病生存率越低;miR-5571表达水平越高,病人总生存率和无病生存率越高。结论 miR-1293、miR-5571和miR-615在外周血中的表达水平可能成为肺腺癌病人预后判断的标志物。
[关键词] 肺腺癌;实时聚合酶链反应;循环微RNA;预后
[中图分类号] R730.261 [文献标志码] A [文章编号] 2096-5532(2020)06-0636-04
doi:10.11712/jms.2096-5532.2020.56.173 [开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20201018.1635.001.html;
[ABSTRACT] Objective To investigate the expression of miR-1293, miR-5571, and miR-615 in the blood of patients with lung adenocarcinoma and its association with prognosis. Methods A total of 100 fresh blood samples were collected from the patients who were diagnosed with lung adenocarcinoma by postoperative pathology (lung adenocarcinoma group) to extract total RNA of blood, and quantitative real-time PCR was used to measure the expression of miR-1293, miR-5571, and miR-615 and analyze its association with prognosis. The blood samples collected from 100 healthy individuals were included in control group. ResultsCompared with the control group, the lung adenocarcinoma group had significant increases in the expression of miR-1293 and miR-615 and a significant reduction in the expression of miR-5571 (t=23.106-27.375,P<0.05). The Log-rank analysis revealed that the expression of these three miRNAs was significantly correlated with the overall survival rate and disease-free survival rate of patients with lung adenocarcinoma (χ2=18.357-19.620,P<0.05). The higher the expression of miR-1293 and miR-615, the shorter the overall survival time and the disease-free survival time; the higher the expression of miR-5571, the longer the overall survival time and the disease-free survival time. Conclusion The expression levels of miR-1293, miR-5571, and miR-615 in peripheral blood of patients with lung adenocarcinoma may become a marker for prognostic evaluation in patients with lung adenocarcinoma.
[KEY WORDS] adenocarcinoma of lung; real-time polymerase chain reaction; circulating microRNA; prognosis
肺腺癌是中国乃至全世界最常见的恶性肿瘤以及首位的癌症死亡原因[1]。据估计,在全球范围内,癌症相关死亡的27%以上由肺癌引发。特别是非小细胞肺癌是最常见的病理组织亚型[1]。尽管在外科治疗、靶向性治疗和早期癌症检测等方面取得了很大进展,但肺腺癌的总生存率仍然不乐观[2]。目前,细胞学筛查和影像检查被证明是灵敏的癌症筛查工具,但是对肺腺癌来说并未显示出足够有效的早期检测能力[3-4]。因此,确定预后生物标志物以准确预测肺腺癌的临床结局有重要意义。随着基因组学、蛋白质组学和分子病理学的发展,多种具有潜在临床价值的候选生物标志物已被确定。研究表明,微小型RNA (miRNAs)是生物学和临床特征的有用生物标记物[5]。miRNAs是内源性的、单链的、小的非编码的RNAs(18~25个核苷酸)[6]。近年來大 量研究证实,miRNAs的异常表达参与了癌细胞增殖、分化、凋亡以及与癌变有关的所有基本细胞过程[7]。miRNAs可能是癌症诊断、预后评估和治疗靶点的潜在标志物。已有研究显示,某些特异性miRNAs可预测肺腺癌病人的临床结局,如miR-432、miR-210、miR-145、和miR-31等[8]。我们前期预实验显示,miR-1293、 miR-5571和miR-615在肺腺癌病人和健康对照组中表达有差异;但关于其能否预测肺腺癌病人预后目前尚未见报道。本研究收集100例肺腺癌病人外周血标本,应用实时荧光定量PCR(qPCR)方法检测其miR-1293、miR-5571和miR-615表达,并分析其表达与预后的相关性。
1 资料与方法
1.1 一般资料
肺腺癌病人100例,为2013年6月—2017年6月在青岛市市立医院胸外科就诊的病人,均经术后病理检查确诊。男41例,女59例,年龄40~71岁,平均(55.11±7.72)岁。根据世界卫生组织(WHO)2013版肿瘤分类及病理诊断标准,病理分级为Ⅰ级5例,Ⅱ级10例,Ⅲ级17例,Ⅳ级68例。以同期该院健康体检中心年龄及性别匹配的正常健康体检者100例作为对照组。本研究获得病人知情同意并签署知情同意书。
1.2 仪器与试剂
IQ5 Real-time PCR仪(Bio-Rad,Hercule,CA,USA);Eppendorf离心机(Eppendorf,Hamburg,Germany);Nanodrop 3000紫外分光光度计(Thermo Fisher Scientific, MA, USA);恒温水浴锅(上海凌科公司)。Trizol RNA提取试剂盒(Life Technologies,Carlsbad,CA,USA);Revert AidTM First Strand cDNA反转录试剂盒(立陶宛Fermentas公司);qPCR试剂盒(日本Takara公司)。
1.3 检测方法
1.3.1 标本采集及处理 用EDTA抗凝管采集肺腺癌病人及对照组新鲜外周血3 mL,置于-80 ℃冰箱保存备用。用Trizol提取外周血清总RNA,Revert AidTM First Strand cDNA反转录试剂盒进行逆转录。参照反转录试剂盒说明书,应用茎环法将总RNA反转录成cDNA后,-20 ℃冰箱保存。
1.3.2 qPCR检测 采用SYBR Green荧光染料法,以cDNA为模板,在IQ5 Real-time PCR仪上进行扩增。所有待检测miRNA的反转录引物及上游下游引物均由上海生工生物工程有限公司设计与合成,见表1。PCR反应体系25.0 μL,内含:cDNA模板0.5 μL,2×TaKaRa SYBR Premix Ex 12.5 μL,上游和下游引物各0.5 μL,以双蒸水补足体系至25.0 μL。定量PCR反应程序:95 ℃预变性3 min;95 ℃变性10 s,62 ℃退火30 s,72 ℃合成40 s,循环40次。记录循环阈值(Ct),采用2-△△Ct法计算miR-1293、miR-5571和miR-615的相对表达。以U6作为内参基因,每个样本均设4个复孔。
1.4 统计学处理
采用SPSS 20.0软件进行统计分析,计量资料先进行正态性检验,符合正态分布的计量资料用±s表示,组间比较采用t检验。预后比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组miR-1293、 miR-5571和miR-615相对表达量比较
与对照组比较,肺腺癌组miR-1293和miR-615显著增高,miR-5571显著降低,差异有统计学意义(t=23.106~27.375,P<0.05)。见表2。
2.2 肺腺癌miR-1293、 miR-5571和miR-615相对表达量与临床病理学参数相关性
随着肺腺癌淋巴结转移分期、肿瘤分期和T分期升高,miR-1293的表达量显著提高(t=2.254~2.819,P<0.05);随着肺腺癌淋巴结转移分期升高,miR-5571表达量显著下降(t=2.287,P<0.05)。miR-615表达量与临床病理学参数无关(P>0.05)。
2.3 miR-1293、miR-5571和miR-615表达与肺腺癌预后的相关性
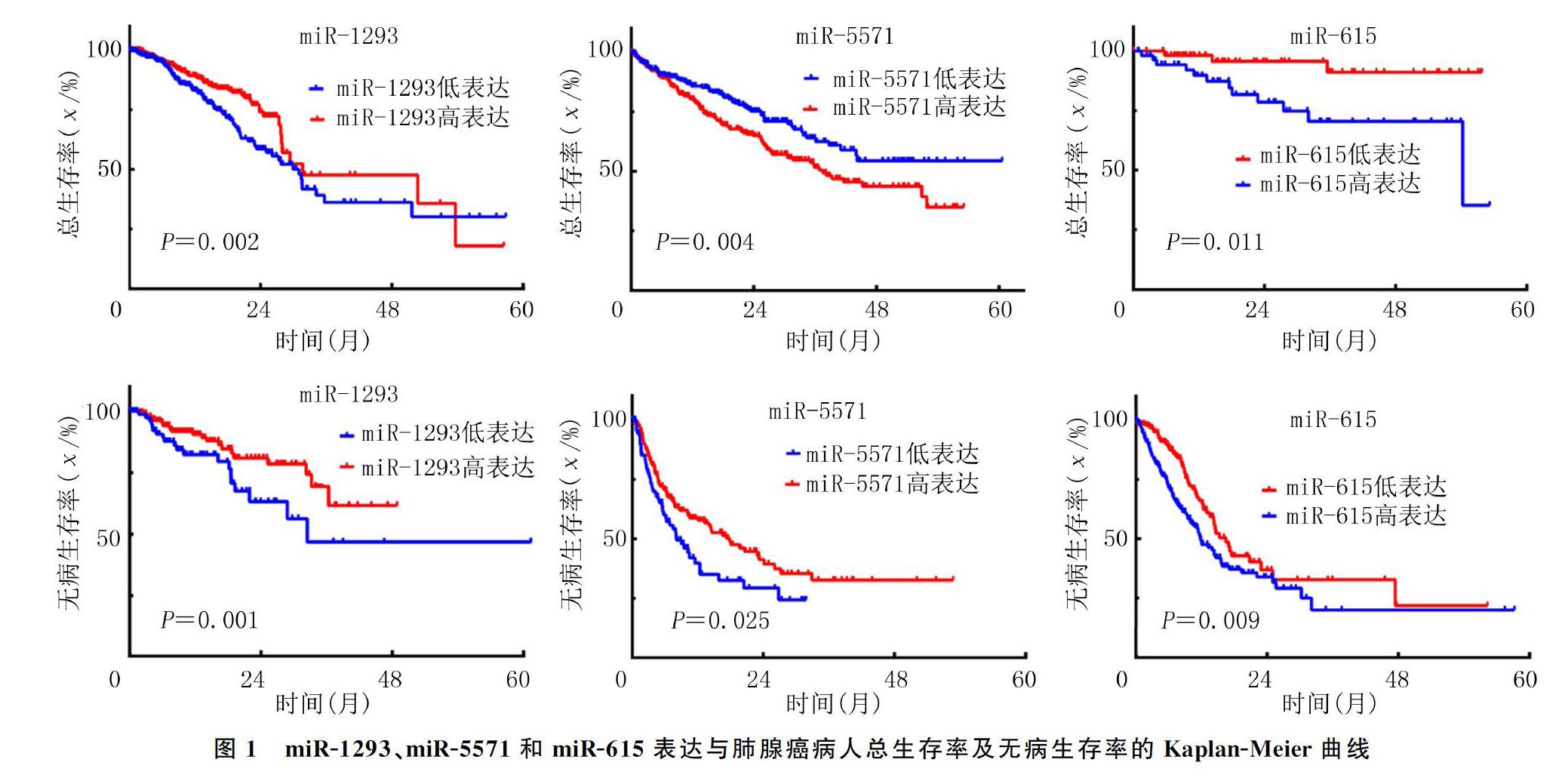
分别以各指标的平均表达量作为cut-off值,高于平均表达量定义为高表达,低于平均表达量定义为低表达。肺腺癌病人的外周血中miR-1293、miR-5571和miR-615的cut-off值分别为0.25、0.10和1.10。Long-rank分析显示,肺腺癌miR-1293、miR-5571和miR-615表达均与总生存率、无病生存率有相关性(χ2=18.357~20.147,P<0.05)。其中miR-1293和miR-615表达水平越高,肺腺癌病人的总生存率和无病生存率越低;而miR-5571表達水平越高,病人的总生存率和无病生存率越高(图1)。
3 讨 论
越来越多的证据表明,特异性miRNA的异常表达参与了肺癌的发生和发展[7]。miRNA的异常表达直接影响其靶基因的表达,进而影响肺癌细胞的增殖、分化以及迁移等恶性细胞学行为,从而使得miRNA成为肺癌的潜在治疗靶标[9]。尽管已有研究表明,一些肺癌相关的miRNA在肺癌与健康对照组织中表达差异有显著意义,如miR-25-3p、miR-29c-3p、miR-33a-5p、miR-144-3p、miR-153-3p、miR-342-5p和miR-485-3p等[8],但是miR-1293、miR-5571和miR-615在肺腺癌病人外周血中表达与预后的相关性目前尚未见报道。
miR-1293定位于染色体12q1312(ID100302220)。目前,有关hsa-miR-1293在癌症中的作用研究较少[10-11],未见miR-1293在肺癌中表达报道。miR-1293在癌症中的生物学作用目前还存在争议性,比如miR-1293在三阴性乳癌中起着抑癌基因的作用[11],而在结直肠癌细胞中起癌基因作用,能够促进直肠癌细胞的增殖、迁移和浸润[10],提示miR-1293作用可能有一定的组织依赖性。本文研究结果显示,肺腺癌病人外周血中miR-1293表达较对照组显著增高,差异有统计学意义;miR-1293表达与肺腺癌病人淋巴结转移、肿瘤分期和T分期等有关;miR-1293表达与肺腺癌病人总生存和无病生存有相关性,推测miR-1293在肺腺癌中可能起着类似癌基因的作用。
恶性肿瘤中miR-615最初发现来自间皮瘤[12],其后在胰腺癌、乳癌、鼻咽癌、非小细胞型肺癌和前列腺癌等病人中均有报道[13-14]。miR-615在癌症中的作用亦存在争议,其生物学功能可能有一定的组织依赖性。有研究显示,miR-615在非小细胞型肺癌中起着抑癌基因的作用,但是在胃癌中起着癌基因的作用[15-16]。本研究结果显示,miR-615在肺腺癌病人外周血中表达显著增高,并且其表达水平与病人不良预后(总生存率和无病生存率)有相关性,表明miR-615在肺腺癌中起癌基因的作用。
miR-5571位于染色体22q11,目前尚未见其在恶性肿瘤中表达的报道。本研究结果显示,肺腺癌病人外周血中miR-5571表达较对照组显著下降,推测miR-5571在肺腺癌中起着类似抑癌基因的作用。miR-5571表达的预后分析也支持该推测。
综上所述,miR-1293、miR-5571和miR-615表达均与肺腺癌病人总生存率和无病生存率有相关性,本文结果提示miR-1293、miR-5571和miR-615在外周血中的表达水平可能成为肺腺癌病人预后判断的标志物。
[参考文献]
[1] CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians, 2016,66(2):115-132.
[2] UCVET A, YAZGAN S, GURSOY S, et al. Prognosis of resected non-small cell lung cancer with ipsilateral pulmonary metastasis[J]. Thorac Cardiovasc Surg, 2020,68(2):176-182.
[3] ARIOZZI I, PALADINI I, GNETTI L, et al. Computed tomography-histologic correlations in lung cancer[J]. Pathologica, 2013,105:329-336.
[4] KOZIELSKI J, KACZMARCZYK G, POREBSKA I, et al. Lung cancer in patients under the age of 40 years[J]. Contemp Oncol Poznan Pol, 2012,16(5):413-415.
[5] INAMURA K, ISHIKAWA Y. MicroRNA in lung cancer: novel biomarkers and potential tools for treatment[J]. Journal of Clinical Medicine, 2016,5(3):36-45.
[6] ZHANG Y, WANG Z J, GEMEINHART R A. Progress in microRNA delivery[J]. J Control Release: Off J Control Release Soc, 2013,172(3):962-974.
[7] DU X H, ZHANG J T, WANG J P, et al. Role of miRNA in lung cancer-potential biomarkers and therapies[J]. Current Pharmaceutical Design, 2018,23(39):5997-6010.
[8] GIORDANO M, BOLDRINI L, SERVADIO A, et al. Diffe-rential microRNA expression profiles between young and old lung adenocarcinoma patients[J]. Am J Transl Res, 2018,10(3):892-900.
[9] LI G, FANG J, WANG Y, et al. MiRNA-based therapeutic strategy in lung cancer[J]. Curr Pharm Des, 2018,23(39):6011-6018.
[10] TAO Y M, MA C, FAN Q H, et al. MicroRNA-1296 facilitates proliferation, migration and invasion of colorectal cancer cells by targeting SFPQ[J]. Journal of Cancer, 2018,9(13):2317-2326.
[11] PHAN B, MAJID S, URSU S, et al. Tumor suppressor role of microRNA-1296 in triple-negative breast cancer[J]. Oncotarget, 2016,7(15):19519-19530.
[12] GULED M, LAHTI L, LINDHOLM P M, et al. CDKN2A, NF2, and JUN are dysregulated among other genes by miRNAs in malignant mesothelioma: a miRNA microarray analysis[J]. Genes Chromosom Cancer, 2009,48(7):615-623.
[13] PU H Y, XU R, ZHANG M Y, et al. Identification of microRNA-615-3p as a novel tumor suppressor in non-small cell lung cancer[J]. Oncol Lett, 2017,13(4):2403-2410.
[14] HUANG F Y, ZHAO H J, DU Z J, et al. miR-615 inhibits prostate cancer cell proliferation and invasion by directly targeting cyclin D2[J]. Oncol Res, 2019,27(3):293-299.
[15] LIU J T, JIA Y L, JIA L J, et al. MicroRNA 615-3p inhibits the tumor growth and metastasis of NSCLC via inhibiting IGF2[J]. Oncol Res, 2019,27(2):269-279.
[16] WANG J Z, LIU L, SUN YC, et al. miR-615-3p promotes proliferation and migration and inhibits apoptosis through its potential target CELF2 in gastric cancer[J]. Biomedicine & Pharmacotherapy, 2018,101:406-413.
(本文編辑 黄建乡)
