矾根‘莱姆里基’愈伤组织诱导及快速繁殖技术
2020-11-14侯非凡程宵婧荊晓楠王荣梅王金耀亢秀萍李森
侯非凡,程宵婧,荊晓楠,王荣梅,王金耀,亢秀萍,李森*
(1.山西农业大学 园艺学院,山西 太谷030801;2.设施园艺工程技术研究中心,山西 太谷030801;3.山西省设施蔬菜提质增效协同创新中心,山西太谷030801)
矾根(Heuchera micrantha)又名珊瑚玲,是虎耳草科矾根属彩叶草本花卉,原产于美洲地区,国内90年代初开始引进并应用于工程花卉方面[1]。其对生长环境要求简单,在半荫(40%遮光度)、全光、干旱、寒冷(−15℃)的条件下都能正常生长,具有抗病虫和吸收重金属的能力[2~4]。矾根叶色丰富,有深紫色,明黄、橙红色等单色系,也有多种类型的复色系,花朵小,花期集中在4~6月[5]。优越的生理特性让矾根拥有广阔的应用市场,如可作室内观赏植物应用于盆栽,也可以应用于花坛、花境、庭院绿化、立体造景等园林绿化。
矾根繁殖方式因品种而异,主要有播种、叶插、分株、组织培养等,但前3种方式受繁殖速度慢、养护难度大、成活比率低、成苗规模小等缺点限制了优良新品种的推广和应用[6~8]。已有多种研究表明,组织培养是实现快速繁殖种苗和保留良种优势的最佳途径[9]。现已开展了许多矾根品种的组织培养研究,分别建立了以‘瀑布’、‘饴糖’、‘紫色宫殿’3个矾根品种的茎尖[10],矾根杂种‘银王子’带顶芽和腋芽的幼嫩茎段或叶鞘[11],矾根‘莓果’的叶片和叶柄[12],矾根‘葡萄苏打’带有腋芽的茎段[13]等为外植体的组织培养和快速繁殖技术。由于基因型不同,品种之间有一定的差异,仍有大部分矾根品种的组织快繁技术体系尚未成功建立。
矾根‘莱姆里基’(Heuchera micrantha‘Lemriki’)叶色黄绿,生命力旺盛,清新明亮的颜色使其在与其他叶色较暗植物进行园林配置时发挥了重要作用。此前还没有关于矾根‘莱姆里基’品种组织培养方面的研究,本研究通过对矾根‘莱姆里基’幼嫩茎段、叶柄、叶片为外植体进行组织培养,明确不同消毒时间的灭菌效果以及对3个外植体愈伤诱导的影响,研究不同配比的激素对3个外植体愈伤组织诱导,对茎段不定芽及不定根诱导的影响。旨在初步建立一套矾根‘莱姆里基’快速繁殖体系,为解决矾根传统繁殖方式速度慢的难题,促进矾根标准化、规模化生产和新品种的开发和应用提供理论依据。
1 材料与方法
1.1 试验材料
以山西农业大学花卉实践教学基地盆栽矾根‘莱姆里基’为试验材料,分别取其幼嫩茎段,叶片及叶柄作为外植体进行组织培养。
1.2 外植体预处理
矾根‘莱姆里基’爆盆后,取其新萌芽的分枝,从根茎交接处切开取其幼嫩茎段和健康完整叶在流水中轻轻揉搓冲洗,洗净后浸泡在无菌水中放置于超净工作台备用。
1.3 试验方法
1.3.1 不同消毒时长对不同外植体污染率、褐化率和愈伤率的影响
采用单因素完全随机设计,选择预处理后的幼嫩茎段、叶片、叶柄分别作为外植体材料,首先用75%的酒精浸泡30 s,无菌水冲洗2~3次,再用0.1%的升汞溶液浸泡不同时间(6 min、8 min、10 min)后无菌水冲洗6~8次,分别切成3~5 mm厚的茎段,1 cm左右长的叶柄,约1 cm×1 cm的叶片接 种 于4.8 g·L-1MS粉+1 mg·L-16-BA+0.1 mg·L-1NAA+30 g·L-1蔗糖+5.3 g·L-1琼脂,pH:5.8~6.2的培养基上,每瓶接种6个外植体,重复3次,培养30 d后统计其污染率、褐化率和愈伤率。
1.3.2 不同浓度激素对叶柄和叶片诱导愈伤的影响
参考孙翊等[14]对矾根叶柄或叶片作为外植体进行组织培养研究结果,筛选激素浓度范围。采用两因素完全随机设计细化不同激素浓度6-BA(0.1、0.5、1.0 mg·L-1)和NAA(0.01、0.05、0.10 mg·L-1)组合分别对叶柄、叶片诱导愈伤的影响,每瓶接种6个外植体,重复3次,培养45 d后统计其愈伤率和生长状况。
1.3.3 不同浓度激素对茎段诱导愈伤和不定芽的影响
参考陈宏等[15]对矾根茎段作为外植体进行组织培养研究的结果,筛选激素浓度范围。采用两因素完全随机设计研究不同激素浓度6-BA(0.1 mg·L-1、0.5 mg·L-1、1.0 mg·L-1)和NAA(0.01 mg·L-1、0.05 mg·L-1、0.10 mg·L-1)对茎段诱导愈伤和不定芽的影响。每瓶接种3个外植体,重复3次,培养45 d后统计其愈伤率和不定芽率。
1.3.4 不同浓度激素对茎段不定芽诱导生根的影响
选取生长状况良好的茎段不定芽作为生根培养的试验材料,以1/2MS固体培养基为基本培养基,采用单因素完全随机设计,选取植物激素IBA(0.1 mg·L-1、0.2 mg·L-1)和NAA(0.5 mg·L-1、1.0 mg·L-1)分别对茎段不定芽诱导生根,其它条件设置为蔗糖30 g·L-1,琼脂5.3 g·L-1,MS粉4.8 g·L-1,pH:5.8~6.2,每瓶接种2个芽,每个处理重复4次,培养45 d后统计其生根率和根系状况。
1.3.5 培养条件
组培室温度维持在21℃,诱导初期进行遮光处理,出现愈伤组织或不定芽后,每日光照16 h,黑暗8 h。
1.4 数据统计与分析
污染率=污染外植体数/总外植体数
褐化率=褐化外植体数/总外植体数
愈伤率=产生愈伤外植体数/总外植体数
不定芽率=产生不定芽外植体数/总外植体数
生根率=生根芽数/接种芽数
使用Excel 2019和SAS 9.2分别进行试验数据统计和方差分析。
2 结果与分析
2.1 不同消毒时长对不同外植体污染率、褐化率和愈伤率的影响
随着消毒时间的增加,各处理中污染率逐渐降低,褐化率逐渐增加,愈伤率的大小因外植体材料而异(表1)。由表1可见,当叶柄为外植体时,消毒10 min污染率(3.70%)极低于其它处理,褐化率(27.78%)稍高于其它处理,但愈伤率(66.67%)最高,消毒6 min时,褐化率(3.70%)和愈伤率(56.79%)最低,污染率(37.07%)偏高,所以叶柄的最佳消毒时长为10 min。当茎段为外植体时,消毒时间6 min污染率(18.51%)偏高,但愈伤率(66.67%)明显高于其它处理,褐化率(24.69%)明显低于其它处理,所以依据本试验目的,消毒6 min是茎段的最佳消毒时长。当叶片为外植体时,消毒时间6 min时所有材料褐化,不能进行下阶段试验。消毒8 min愈伤率(62.22%)约为消毒10 min的2倍,污染率(22.22%)偏高,但褐化率(4.44%)极低,所以消毒8 min为叶片的最佳消毒时长。

表1 不同消毒时长对不同外植体污染率、褐化率和愈伤率的影响Table 1 Effect of different disinfection duration on pollution rate,browning rate and callus rate of different explants
2.2 不同浓度激素对叶柄诱导愈伤的影响
由表2可见,处理2、处理3、处理8、处理9的愈伤率较其它处理高,都达到90%以上,其中处理2、处理8诱导出的愈伤组织玻璃化程度严重,处理3、处理9诱导出愈伤组织色绿紧密通透,未出现玻璃化,处理9愈伤率(91.11%)高于处理3。叶柄愈伤组织诱导最佳激素配比为处理9,最佳培养基配方为:4.8 g·L-1MS粉+1 mg·L-16-BA+0.1 mg·L-1NAA+30 g·L-1蔗 糖+5.3 g·L-1琼 脂,pH:5.8~6.2,愈伤率为91.11%。图1为色绿紧密通透的不同时期叶柄愈伤组织。

表2 不同浓度激素对叶柄诱导愈伤的影响Table 2 Effects of different concentrations of hormones on callus induction from petiole
2.3 不同浓度激素对叶片诱导愈伤的影响
不同激素配比对叶片作为外植体诱导愈伤的差异显著。由表3可见,通过对比分析在6-BA浓度 相 同 时,当NAA浓 度 为0.1 mg·L-1愈 伤 率 最高,当NAA浓度为0.01 mg·L-1愈伤率最低;处理6与处理9愈伤组织深绿,体积大;且处理9愈伤率最高,达90%。叶片愈伤组织诱导最佳激素配比为处理9,最佳培养基为:4.8 g·L-1MS粉+1 mg·L-16-BA+0.1 mg·L-1NAA+30 g·L-1蔗 糖+5.3 g·L-1琼脂,愈伤率为90%。图2为矾根‘莱姆里基’叶片绿色致密愈伤组织。
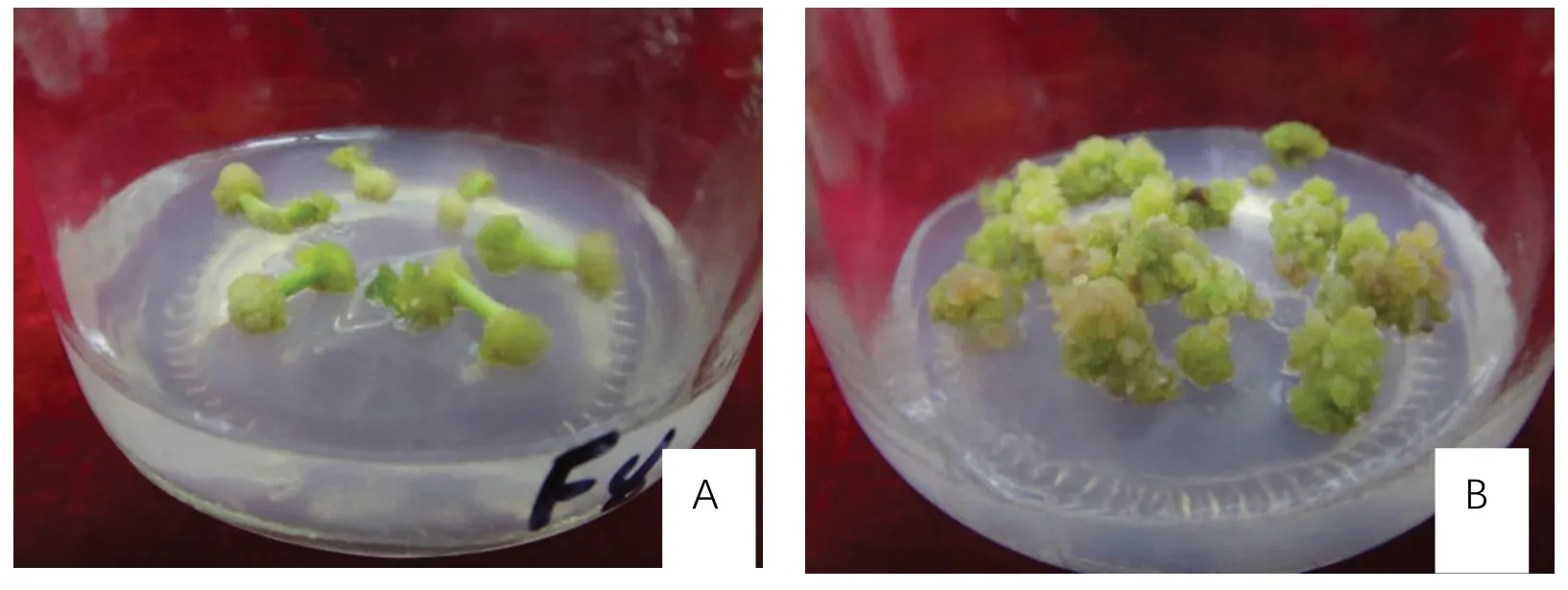
图1 不同时期的矾根‘莱姆里基’叶柄愈伤组织Fig.1 Petiole callus of Heuchera micrantha‘Lemriki’at different stages

表3 不同浓度激素对叶片诱导愈伤的影响Table 3 Effects of different concentrations of hormones on callus induction from leaf

图2 矾根‘莱姆里基’叶片愈伤组织Fig.2 Callus of Heuchera micrantha‘Lemriki’leaves
2.4 不同浓度激素对茎段诱导愈伤、不定芽、生根的影响
2.4.1 不同浓度激素对茎段诱导愈伤和不定芽的影响
不同激素配比对茎段作为外植体诱导的影响差异显著。由表4可见,6-BA浓度为0.1~0.5 mg·L-1时,外植体可以直接诱导出不定芽,当激素配比为处理2时,不定芽率(72.20%)最高。当6-BA浓度为1 mg·L-1时,外植体则诱导出愈伤组织,NAA浓度为0.05 mg·L-1时,愈伤率(75.00%)最高。6-BA浓 度 高 于0.5 mg·L-1时,随着NAA浓度的升高,芽上叶片开始出现水肿,形状扭曲,6-BA浓度高于1 mg·L-1时,叶片形状几乎完全扭曲,伤口处出现大量愈伤组织。茎段最佳愈伤诱导激素配比为处理8,培养基为:4.8 g·L-1MS粉+1 mg·L-16-BA+0.05 mg·L-1NAA+30 g·L-1蔗糖+5.3 g·L-1琼脂,愈伤率为75.00%。茎段不定芽诱导的最佳激素配比为处理2,最佳不定芽诱导培养基 为:4.8 g·L-1MS粉+0.1 mg·L-16-BA+0.05 mg·L-1NAA+30 g·L-1蔗 糖+5.3 g·L-1琼脂,诱导率高达72.20%。图3为矾根‘莱姆里基’茎段诱导的不定芽。
2.4.2 不同浓度激素对不定芽诱导生根的影响
不同激素种类生根效果不同,生根率差异较大,根系状况不一。由表5可以看出,处理2、处理3根系状况良好,但生根率较低,处理4、处理5根系状况略差,但生根率最高,说明在添加NAA时,根系健壮,须根密集,但生根率较差,添加IBA时,诱导率最高,主根较粗,虽须根较稀疏,但很健壮,当IBA浓 度 达 到1 mg·L-1时,生 根 率 可 达 到100%。生根培养的最佳培养基为:2.4 g·L-1MS粉+1.0 mg·L-1IBA的+30 g·L-1蔗糖+5.3 g·L-1琼脂。图4为矾根‘莱姆里基’茎段不定芽的根系。

表4 不同浓度激素对茎段诱导愈伤和不定芽的影响Table 4 Effects of different hormone concentrations on stem callus and adventitious bud induction

图3 矾根‘莱姆里基’茎段诱导的不定芽Fig.3 Adventitious buds induced by stem segments of Heuchera micrantha‘Lemriki’
3 讨论与结论
消毒时间对矾根不同部位的消毒效果影响显著,本试验得出矾根‘莱姆里基’叶柄、茎段和叶片的最佳消毒时间分别为:0.1%升汞6 min,8 min,10 min。矾根叶片表面有绒毛,彻底消毒所需时间最长,叶柄和茎段表面光滑,消毒时间稍短于叶片。外植体消毒不仅要求杀菌剂能把材料表面上的各种微生物杀灭,同时又不能损伤或只轻微损伤组织材料而不影响其生长。预试验中使用2%次氯酸钠为消毒液时,处理时间为3 min时外植体伤口处开始出现褐化,6 min时伤口处完全褐化,这可能与次氯酸钠溶液的碱性很强,对植物材料有强大的破坏作用有关[16],所以2%次氯酸钠不适宜矾根‘莱姆里基’品种的消毒,但2%次氯酸钠在‘欧布西迪昂’、‘红贝露’等矾根品种组培外植体消毒过程中仍然适用[17,18],矾根品种与消毒方式的选择影响很大。
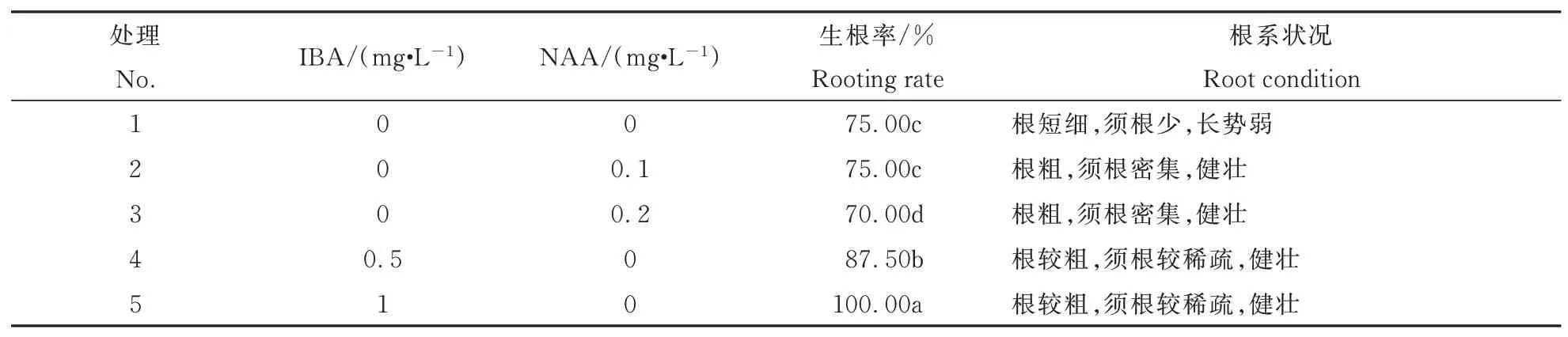
表5 不同浓度激素对生根的影响Table 5 Effects of different hormone types and concentrations on root system

图4 矾根‘莱姆里基’茎段不定芽根系Fig.4 Root system of adventitious buds in stem segment of Heuchera micrantha‘Lemriki’
培养基中激素的配比对植物的分化与生长具有重要的调节作用,是影响植物离体快繁的重要因素之一。本试验得出矾根‘莱姆里基’叶柄和叶片的最佳愈伤诱导培养基为:4.8 g·L-1MS粉+1 mg·L-16-BA+0.1 mg·L-1NAA+30g·L-1蔗 糖+5.3 g·L-1琼脂,愈伤率为91.11%、90.00%。茎段最佳愈伤诱导培养基为:4.8 g·L-1MS粉+1 mg·L-16-BA+0.05 mg·L-1NAA+30 g·L-1蔗 糖+5.3 g·L-1琼脂,愈伤率为75%。陈宏等[15]研究的矾根‘布朗尼’带茎尖幼嫩茎段的最佳愈伤诱导培养 基 为MS+0.5 mg·L-16-BA+0.05 mg·L-1NAA,王晶等[8]研究的矾根‘香茅’和‘饴糖’芽最佳愈伤诱导培养基为MS+0.5 mg·L-16-BA+0.5 mg·L-1NAA,激素比例差异明显,这表明不同品种和不同外植体愈伤诱导培养基种类差异极大。
矾根‘莱姆里基’茎段可以直接诱导出不定芽,省去了由愈伤组织诱导不定芽的时间,提高了组培育苗的效率。本试验中茎段可以直接诱导出不定芽,最佳不定芽诱导导培养基为:4.8 g·L-1MS粉+0.1 mg·L-16-BA+0.05 mg·L-1NAA+30 g·L-1蔗 糖+5.3 g·L-1琼 脂,诱 导 率 高 达72.2%。邵雅东等[12]研究发现矾根‘莓果’不定芽的诱导培养基为:MS+1.0 mg·L-16-BA+0.1 mg·L-1NAA。这说明高浓度的6-BA和低浓度的NAA更适于植物组织不定芽的诱导。
矾根‘莱姆里基’茎段不定芽最佳生根诱导培养基为:2.4 g·L-1MS粉+1.0 mg·L-1IBA+30 g·L-1蔗糖+5.3 g·L-1琼脂,生根率可达100%,且根系健壮。除矾根‘花毯’的生根最佳基本培养基为MS固体培养基外[19],其余都是1/2 MS固体培养基。田莉等[20]研究发现矾根‘巴黎’不定芽的最适生根培养基为1/2 MS+1.0 mg·L-1IBA,生根率高达100%,孙翊[14]等研究发现矾根‘紫色宫殿’的最适生根诱导培养基是1/2 MS+0.2 mg·L-1NAA,生根率为100%。IBA和NAA都是人工合成生长激素,添加IBA处理可有效提高组培苗生根率,促进产生较多根系数量;NAA可使根系直径变大[21,22]。可见,在生根培养 基中单独使用IBA或NAA都能达到最佳的生根效果。
