非水相脂肪酶催化合成β-谷甾醇正辛酸酯的研究
2020-11-13孙玉莹王玉婷李俊杰何文森
孙玉莹,赵 佳,王玉婷,李俊杰,曲 嵛,何文森
(1.江苏大学 食品与生物工程学院, 江苏 镇江 212013; 2.丰益油脂科技(连云港)有限公司,江苏 连云港 222042)
植物甾醇主要包括β-谷甾醇、豆甾醇、菜油甾醇、菜籽甾醇4种,广泛存在于植物油、坚果等植物性食物中。植物甾醇化学结构与胆固醇类似,具有显著的降胆固醇功效。然而,植物甾醇的熔点高、油溶性差,极大地限制了其实际应用。为了改善植物甾醇的油溶性,许多学者以脂肪酸或植物油为亲油修饰剂合成植物甾醇脂肪酸酯[1-2]。常见的亲油修饰剂包括棕榈酸[3]、油酸[4]、亚油酸[5]、共轭亚油酸[6]、亚麻酸、大豆油、葵花籽油等[7]。经酯化修饰后,植物甾醇的油溶性得到了明显的改善。这些修饰剂均是长链脂肪酸或相应的甘油三酯,长期大量摄入会引起高血脂。相比之下,中链脂肪酸进入消化道后可直接通过门静脉进入肝脏,迅速地提供能量,不会增加肝脏负担,可有效预防心血管疾病的发生[8]。因此,中链脂肪酸受到了越来越多的关注。正辛酸是一种含8个碳原子的典型中链脂肪酸,目前鲜有催化合成植物甾醇正辛酸酯的报道。
合成植物甾醇酯的方法主要包括化学法、酶法。酶法因具有反应条件温和、选择性高、绿色环保等优点而备受关注。目前,用于催化植物甾醇酯合成的脂肪酶主要包括Novozym 435、Candidarugosa、Lipozyme RM IM、Lipozyme TL IM等[7]。Candidasp.99-125是一种新型脂肪酶,已被广泛用于催化各种酯化、酯交换等反应[9]。迄今为止,尚无利用Candidasp.99-125脂肪酶催化合成植物甾醇正辛酸酯的报道。本文首次以Candidasp.99-125脂肪酶为催化剂,以正辛酸为修饰剂,以β-谷甾醇作为植物甾醇的代表,催化合成β-谷甾醇正辛酸酯,以改善其油溶性。利用薄层色谱、核磁共振波谱对产物的化学结构进行表征,利用高效液相色谱对产物的转化率进行定量分析,通过单因素试验优化了产物的合成工艺。
1 材料与方法
1.1 试验材料
β-谷甾醇(纯度>95%),西安百川生物科技有限公司;正辛酸(纯度>95%),上海阿拉丁生化科技股份有限公司;Candidasp.99-125脂肪酶(酶活20 000 U/g),北京凯泰新世纪生物技术有限公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
THZ-92B气浴恒温振荡器,上海博迅医疗生物仪器股份公司;LC-20A型液相色谱仪,日本岛津公司;蒸发光散射检测器(ELSD),德国珊贝克公司;AvanceⅡ核磁共振仪(400 MHz),瑞士Bruker公司;NETZSCH DSC 204 F1型动态热流式差示扫描量热仪,德国耐驰公司。
1.2 试验方法
1.2.1β-谷甾醇正辛酸酯的合成
分别称取一定量的β-谷甾醇、正辛酸、Candidasp.99-125脂肪酶、3Å分子筛于20 mL棕色小瓶内,加入一定体积的反应溶剂,置于提前预热的气浴恒温振荡器中反应一段时间。每隔12 h取样一次,每次取样200 μL,保存待测。
1.2.2 薄层色谱分析
提前配制好正辛酸、β-谷甾醇、反应液。用毛细管吸取10 μL样品均匀点样在硅胶薄层色谱板上,边点样边用吹风机吹干。点样完成后,将薄层板置于层析缸中展开。展开剂为石油醚(60~90℃)-乙酸乙酯(体积比8∶2),充分展开后,放入烘箱中烘干,在碘缸中显色约30 min,取出观察显色情况。组分在薄层板上不同的位置,可用比移值(Rf)表示。
Rf=L1/L2
(1)
式中:L1为组分位置至点样原点中心的距离;L2为溶剂前沿至点样原点中心的距离。
1.2.3 硅胶柱层析分离纯化
将1.2.1中反应液转移至圆底烧瓶,利用旋转蒸发仪除去溶剂,得β-谷甾醇正辛酸酯粗品。取出约200 mL 200~300目的柱层析硅胶放入烧杯,加入一定洗脱剂浸泡一段时间,缓慢装入扩口层析柱。将一定量的β-谷甾醇正辛酸酯粗品溶于5 mL洗脱剂,缓慢加入硅胶柱中。用石油醚(60~90℃)-乙酸乙酯(体积比8∶2)洗脱剂进行洗脱,用试管收集洗脱液。利用薄层色谱检测产物,收集只含有目标产物的洗脱液,经旋蒸、干燥得β-谷甾醇正辛酸酯纯品。
1.2.4 核磁共振波谱分析
将β-谷甾醇正辛酸酯纯品溶于氘代氯仿(CDCl3),用于核磁共振波谱分析。四甲基硅烷作为内标物,CDCl3作为溶剂,1H谱频率为400 MHz,13C谱和DEPT-135谱的频率为100 MHz。
1.2.5 熔点测试
利用差示扫描量热仪(DSC)测定β-谷甾醇、β-谷甾醇正辛酸酯纯品的熔点。分别称取5 mg样品均匀平铺于铝制坩埚底部,以空白坩埚作对照。分析条件为初始温度20 ℃,以10 ℃/min的速率升温至180℃。
1.2.6 高效液相色谱定量分析
将反应液用无水乙醇溶解(反应液与无水乙醇体积比为0.1∶1),经有机滤膜过滤后注入玻璃样品瓶,进行高效液相色谱分析。分析条件:Symmetry C18色谱柱(5 μm, 4.6 mm×150 mm,Waters),柱温35℃,流动相为甲醇-异丙醇-正己烷(体积比7.8∶1.1∶1.1),流速1.0 mL/min,进样量10 μL,ELSD温度35℃,氮气作为载气,压力0.05 MPa。采用面积归一化法计算转化率(x)。
x=S1/(S1+S2)×100%
(2)
式中:S1为产物峰面积;S2为β-谷甾醇峰面积。
1.2.7 数据分析与处理
试验数据均采用SPSS 16.0软件处理,组间各指标比较采用单因素方差分析(ANOVA),试验数据以“平均值±标准差(x±s)”的形式表示,不同的字母代表差异显著(p<0.05)。
2 结果与讨论
2.1 薄层色谱层析图
图1为β-谷甾醇、正辛酸、反应液及产物的薄层色谱图。
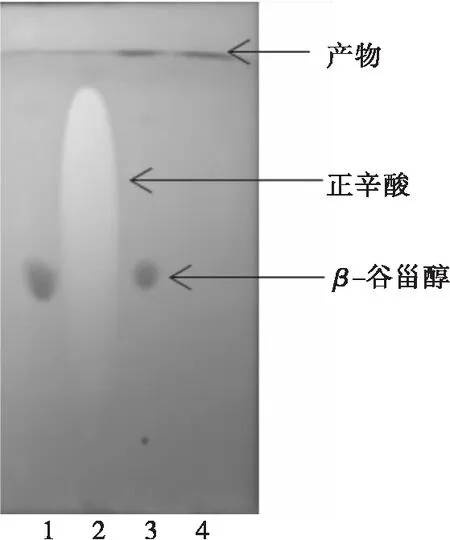
注:1.β-谷甾醇;2.正辛酸;3.反应液;4.β-谷甾醇正辛酸酯。
由图1可知,β-谷甾醇的Rf为0.4~0.5,正辛酸的Rf为0.8~0.9,产物β-谷甾醇正辛酸酯的Rf接近1.0。通常,Rf越小,极性越强,反之越弱。说明β-谷甾醇正辛酸酯的极性远远小于β-谷甾醇。图1说明合成了目标产物,且产物与底物可以很好地分离开来。
2.2 核磁共振波谱图
产物的化学结构及其1H、13C、DEPT-135核磁共振波谱分析结果如图2~图4所示。通过积分,氢谱上共有64个氢原子,正好与β-谷甾醇正辛酸酯分子结构上氢原子数目一致(见图2)。其中,化学位移4.5~4.7之间的多重峰对应于3位CH上氢原子,化学位移5.3~5.4之间的峰为6位CH上氢原子的波谱吸收信号(见图3)。
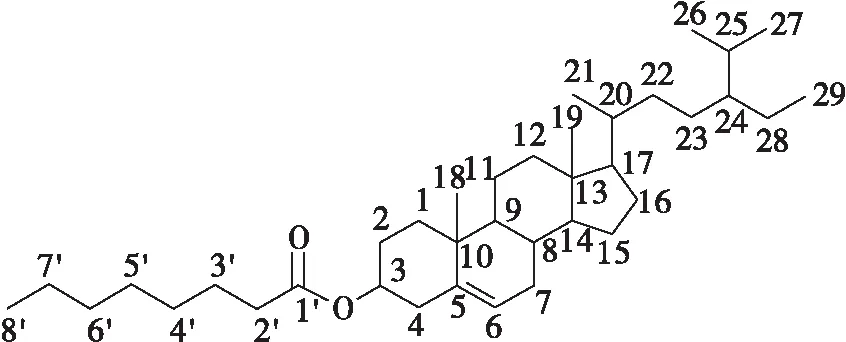
图2 β-谷甾醇正辛酸酯结构式
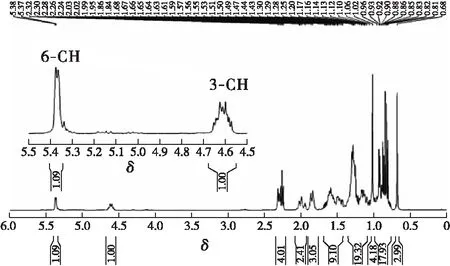
图3 β-谷甾醇正辛酸酯的1H NMR谱图
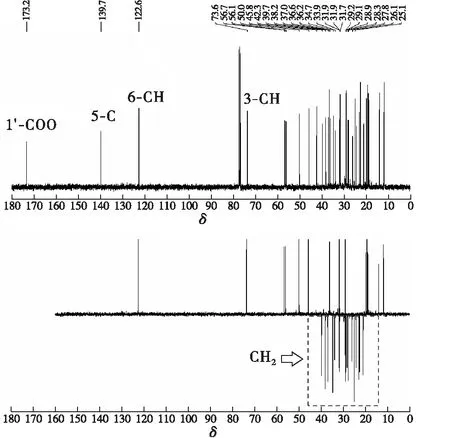
图4 β-谷甾醇正辛酸酯的13C、DEPT-135 NMR谱图
通常,13C谱上出现测试样品中所有的碳原子,而DEPT-135谱可以区分不同类型的碳原子。本文中,13C谱上总共出现了37个碳,与β-谷甾醇正辛酸酯分子式碳原子数目一致(见图2)。在DEPT-135谱中,季碳不会出现,伯碳(CH3)、叔碳(CH)的信号峰朝上,而仲碳(CH2)的信号峰朝下。由图4可知,与13C谱相比,DEPT-135谱少了4个峰,对应于β-谷甾醇正辛酸酯分子结构上的4个季碳。其中,化学位移173.2对应于1′羰基碳;化学位移139.7对应于5位碳;化学位移42.3和37.0分别对应10位和13位碳。DEPT-135谱中有17个朝下的峰,正好与β-谷甾醇正辛酸酯分子结构上亚甲基数目一致(见图2)。化学位移73.6和122.6分别对应于3位和6位CH的碳原子。综上,目标产物为β-谷甾醇正辛酸酯。
2.3 熔点
β-谷甾醇和β-谷甾醇正辛酸酯的DSC曲线如图5所示。
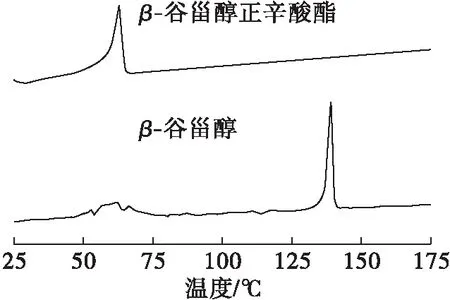
图5 β-谷甾醇、β-谷甾醇正辛酸酯的DSC曲线
由图5可知,β-谷甾醇的熔点为139℃,而β-谷甾醇正辛酸酯的熔点仅为63℃。β-谷甾醇经与正辛酸酯化后,其熔点显著降低,有助于拓宽植物甾醇的应用范围。
2.4 高效液相色谱图
图6为底物混合物(β-谷甾醇、正辛酸)、反应液的高效液相色谱图。
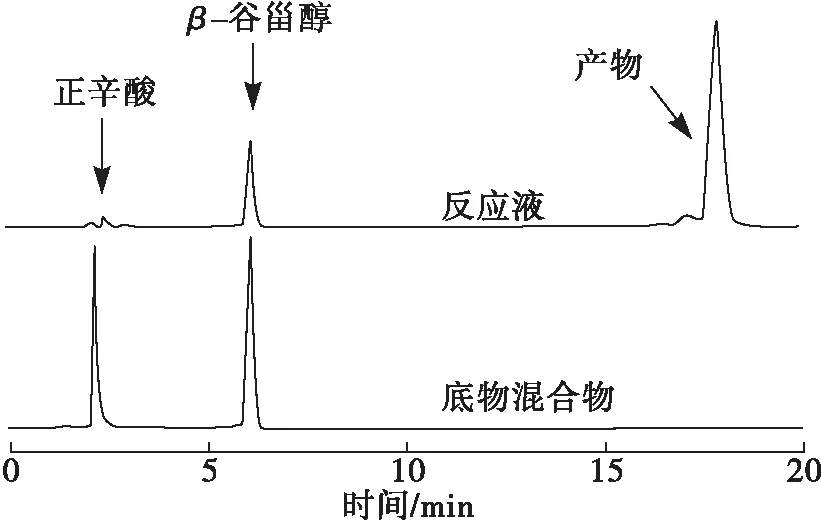
图6 底物混合物、反应液高效液相色谱图
由图6可知,正辛酸的保留时间为2.3 min,β-谷甾醇的保留时间为6.2 min。与底物混合物相比,反应液在18 min多了一个色谱峰,对应为产物β-谷甾醇正辛酸酯。图6说明可以用高效液相色谱法对目标产物进行定量分析。
2.5 反应工艺参数的确定
2.5.1 溶剂种类
反应溶剂是影响酶催化反应的重要因素之一。一方面,反应溶剂可以通过改变底物的溶解度来影响反应体系的传质;另一方面,反应溶剂可以通过改变脂肪酶的结构,进而影响酶的活性和稳定性。正己烷、异辛烷是非水相脂肪酶催化酯化、酯交换反应常用的两种溶剂[2, 10-11],其对产物转化率的影响如图7所示。
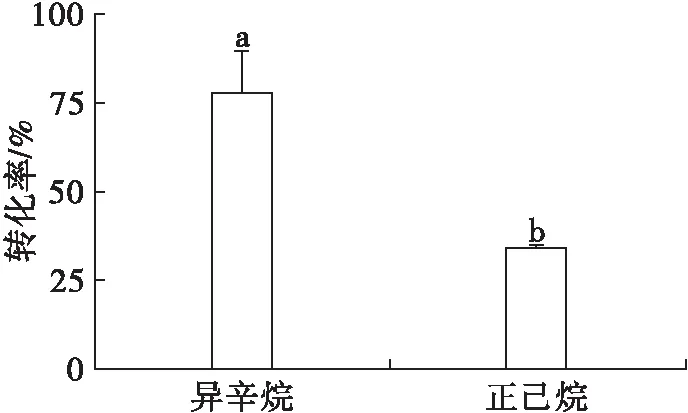
注:反应条件为50 mmol/L β-谷甾醇,50 mmol/L 正辛酸,20 mg/mL脂肪酶,120 mg/mL 3Å分子筛,5 mL溶剂,反应温度40℃,反应时间12 h。图中不同的字母代表具有显著性差异(p<0.05),下同。
由图7可知,异辛烷作为反应溶剂,转化率达到77.9%,明显高于正己烷(34.2%)。原因为:通常有机溶剂极性越强,对酶的结构影响越大,从而降低转化率;反之,有利于提高转化率。一方面,异辛烷的疏水性较正己烷强,前者有利于维持脂肪酶原有的构象,从而表现出更高的转化率。另一方面,异辛烷的疏水性强,产物β-谷甾醇正辛酸酯极性较弱,故产物在异辛烷中有很好的溶解度,这也有利于使反应向酯合成方向进行。因此,最终选择异辛烷为反应溶剂。
2.5.2 反应温度
反应温度是影响酯化反应的主要因素,可能通过两方面影响反应。一方面,温度可以影响底物在溶剂中的溶解度;另一方面,温度与脂肪酶的活性、稳定性密切相关[12]。图8是反应温度对转化率的影响。
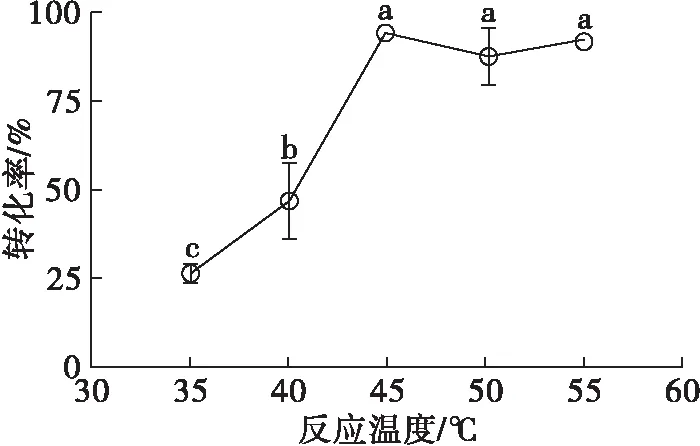
注:反应条件为50 mmol/L β-谷甾醇,50 mmol/L 正辛酸,20 mg/mL脂肪酶,120 mg/mL 3Å分子筛,5 mL异辛烷,反应时间12 h。
由图8可知:反应温度为35℃时转化率较低,不到30%;随着反应温度的升高,转化率逐渐升高,当反应温度升高到45℃时转化率达到了90%;反应温度进一步升高至50℃和55℃,转化率无明显变化。这表明Candidasp.99-125脂肪酶催化该反应的最适温度是45℃。
2.5.3 脂肪酶用量
脂肪酶用量对转化率的影响如图9所示。

注:反应条件为50 mmol/L β-谷甾醇,50 mmol/L 正辛酸,120 mg/mL 3Å分子筛,5 mL异辛烷,反应温度45℃,反应时间12 h。
由图9可知:当脂肪酶用量从10 mg/mL 上升到20 mg/mL时,β-谷甾醇的转化率明显增加,转化率达到91.3%;当脂肪酶用量进一步增加时,转化率虽略有增加但无显著变化。这表明对该反应而言,Candidasp.99-125 脂肪酶用量为20 mg/mL时已达到饱和,继续增加其用量并不能促进酯化反应进行。万晓红[13]在利用Candidasp.99-125脂肪酶催化合成环氧油酸酯时也发现了类似的结果。因此,选择脂肪酶用量为20 mg/mL。
2.5.4 底物摩尔比
β-谷甾醇和正辛酸分别为一元醇和一元酸。理论上讲,等摩尔β-谷甾醇与正辛酸是最理想的摩尔比。然而,酯化反应是一个可逆反应,难以完全朝着酯合成方向进行,适当提高其中一种底物的用量,可以促进另一种底物转化[12]。β-谷甾醇与正辛酸摩尔比对转化率的影响如图10所示。
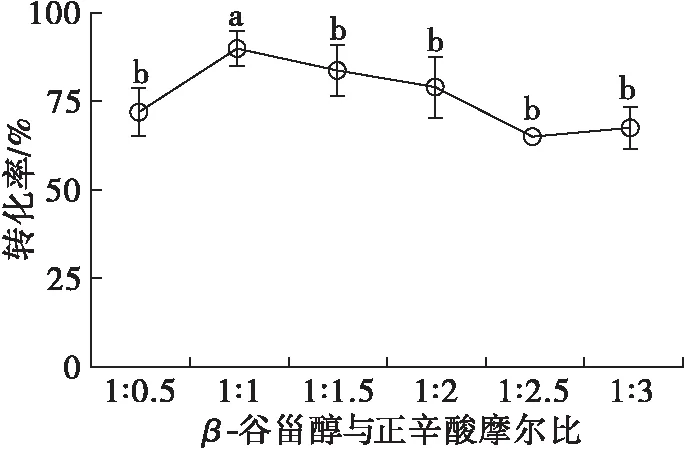
注:反应条件为50 mmol/L β-谷甾醇,20 mg/mL脂肪酶,120 mg/mL 3Å分子筛,5 mL异辛烷,反应温度45℃,反应时间12 h。
由图10可知:当β-谷甾醇过量即β-谷甾醇与正辛酸摩尔比为1∶0.5时,转化率低于75%;当β-谷甾醇与正辛酸摩尔比为1∶1时,转化率达到了90%以上;正辛酸用量继续增加,转化率下降。以前的研究表明,适当增加脂肪酸可以促进植物甾醇酯的合成[12]。然而,本研究中等摩尔比时转化率最大,当酸过量时转化率反而下降。这可能是由于以前合成植物甾醇酯时大多选用长链脂肪酸为酰基供体,而本研究选用正辛酸为酰基供体。一般而言,脂肪酸碳链越长,极性越弱;反之,极性越强。当极性强的脂肪酸增多时,会破坏脂肪酶的结构,进而导致转化率下降。因此,选择β-谷甾醇与正辛酸的最适摩尔比为1∶1。
2.5.5 底物浓度
底物浓度对转化率的影响如图11所示。
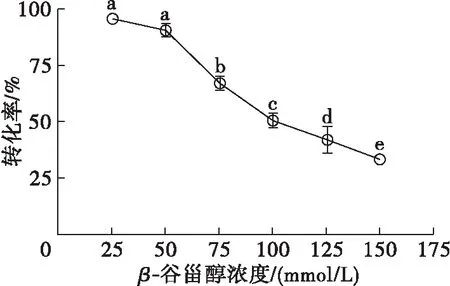
注:反应条件为β-谷甾醇与正辛酸摩尔比1∶1,20 mg/mL 脂肪酶,120 mg/mL 3Å分子筛,5 mL异辛烷,反应温度45℃,反应时间12 h。
由图11可知,β-谷甾醇浓度在25 mmol/L时,转化率几乎达到了95%,这可能是由于脂肪酶Candidasp.99-125相对底物而言过量,足以使得β-谷甾醇反应完全。进一步增加β-谷甾醇浓度至50 mmol/L,转化率略有下降,β-谷甾醇浓度增加至75 mmol/L,转化率急速下降。这可能是由于在较高浓度下,大多数底物在有机溶剂中不溶解。因此,综合考虑转化率和β-谷甾醇浓度的关系,并从提高生产效率和降低生产成本的角度考虑,选择50 mmol/L作为反应最适的底物浓度。
2.5.6 反应时间
反应时间对转化率的影响如图12所示。
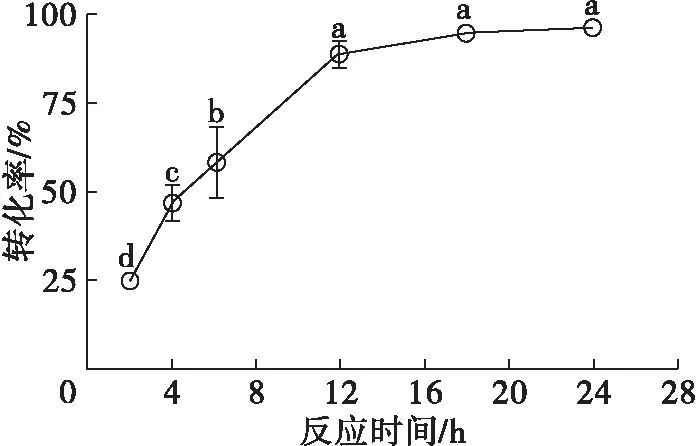
注:反应条件为50 mmol/L β-谷甾醇,50 mmol/L正辛酸,20 mg/mL脂肪酶,120 mg/mL 3Å分子筛,5 mL异辛烷,反应温度45℃。
由图12可知:2~12 h内,转化率随反应时间的延长呈上升趋势;12~24 h内,转化率没有明显变化;反应12 h产物的转化率已经达到90%以上。因此,选择12 h作为最适反应时间。
3 结 论
本文首次利用Candidasp.99-125脂肪酶催化合成β-谷甾醇正辛酸酯。利用薄层色谱、核磁共振波谱、差式扫描量热分析、高效液相色谱对产物进行分析与表征,证实合成产物为β-谷甾醇正辛酸酯,β-谷甾醇经与正辛酸酯化后熔点显著降低。通过单因素试验考察了溶剂种类、反应温度、脂肪酶用量、底物摩尔比、底物浓度、反应时间对转化率的影响。结果表明:以20 mg/mLCandidasp.99-125脂肪酶为催化剂,5 mL异辛烷,50 mmol/Lβ-谷甾醇,β-谷甾醇与正辛酸摩尔比1∶1,120 mg/mL 3Å分子筛,45℃下反应12 h,转化率可达90%以上。
