副猪嗜血杆菌环介导等温扩增检测方法的建立及应用
2020-11-13李璐璐骆延波张庆赵效南任金瑞胡明张印齐静刘玉庆
李璐璐,骆延波,张庆,赵效南,任金瑞,2,胡明,张印,齐静,刘玉庆
(1.山东省农业科学院畜牧兽医研究所/山东省畜禽疫病防控与繁育重点实验室,山东济南 250100;2.山东师范大学生命科学学院,山东 济南 250014)
副猪嗜血杆菌(Haemophilus parasuis,Hps)是存在于猪上呼吸道的一种共栖菌[1],也是一种条件性致病菌,可以在猪抵抗力较弱或者病毒感染后易感,引起以浆液性或纤维素性多发性浆膜炎、关节炎、脑膜炎等为特征的Gläserser病,也称为副猪嗜血杆菌病[2]。副猪嗜血杆菌病多发于保育仔猪和青年猪[3],严重时死亡率可达50%以上[4]。
目前对于副猪嗜血杆菌的检测主要采用PCR方法,包括普通 PCR[5]、实时 PCR[6]、荧光定量 PCR[7,8]、多重 PCR[9]等。PCR检测的特异性和灵敏性毋庸置疑,但是需要昂贵的PCR扩增仪和凝胶成像系统。Notomi等[10]在2000年发明了一种环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术,针对靶基因序列的6个区域,设计4条引物,利用Bst DNA聚合酶的链置换作用,在恒温条件下进行高效特异的扩增反应。LAMP技术目前已经用于多种临床常见细菌的鉴定,如大肠杆菌、沙门氏菌、金黄色葡萄球菌、肠球菌、铜绿假单胞菌等[11-13],以及细菌耐药基因和毒力基因的检测[14,15]。本研究拟采用LAMP技术,建立一种针对Hps的快速检测方法,并对该方法的特异性和灵敏度进行研究。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株 大肠杆菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、金黄色葡萄球菌(ATCC 25923)、粪肠球菌(ATCC 29212)、猪链球菌(ATCC 43765),购自中国兽医药品监察所;30份带有明显呼吸道症状的猪肺样品,用于LAMP方法的验证。
1.1.2 试剂与仪器 胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB),OXOID公司产品;小牛血清,北京鼎国昌盛生物技术有限责任公司产品;辅酶Ⅰ(烟酰胺腺嘌呤二核苷酸,NAD),Sigma公司产品;脱氧核糖核酸扩增试剂盒(环介导等温扩增法)、LAMP浊度实时分析仪(LA-320C)、荧光目视检测试剂盒(SLP221),荣研生物科技有限公司产品;细菌DNA提取试剂盒、2×Taq PCR MasterMix,天根生化科技(北京)有限公司产品;凝胶成像仪、分光光度计 Nanodrop 2000,美国Bio-rad产品;引物由上海生工生物工程有限公司合成。
1.2 病原菌的分离与基因组DNA的提取
将30份猪肺样品在无菌条件下使用接种环划线接种于TSA培养基(5%小牛血清+1%的2 μg/mL NAD),37℃恒温培养 20~24 h。在 TSA培养基上挑取针尖大小、边缘整齐、表面光滑湿润、无色近似透明的菌落,再次划线接种于TSA培养基,进行纯培养后,挑取单个疑似菌落接种于TSB培养基(5%小牛血清 +1%的 2μg/mL NAD)中,37℃摇床振荡培养18 h后,通过水煮法提取模板DNA。
将纯化后的大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、粪肠球菌分别划线于TSA培养基,猪链球菌划线于添加5%小牛血清的TSA培养基,37℃恒温培养18~20 h后,挑取单个疑似菌落接种于TSB培养基或添加5%小牛血清的TSB培养基,37℃摇床振荡培养18 h后,按照天根生化科技有限公司细菌基因组DNA提取试剂盒说明书提取相关菌株的基因组。
1.3 引物设计
根据GenBank中已发表的Hps 16S rRNA序列,采用Blast获得高度保守区域。针对保守区域序列,根据LAMP引物设计原则,使用蓝谱公司Primer Explorer V5软件 (http://primerexplorer.jp/lampv5e/index.html)设计3组引物(分别标记为HP-1L、HP-2L和HP-3L),每组引物均包含一对外引物(F3和B3)和一对内引物(FIP和BIP)。为提高扩增效率,对筛选出的最佳引物组设计一条或两条环引物(LF和LB)。PCR引物序列参考之前的文献报道[5]。
1.4 反应体系的建立
LAMP反应体系(25μL):2×反应缓冲液(RM)12.5μL,Bst聚合酶 1μL,FIP和 BIP各0.4μL,F3和 B3各 0.1μL,模板 DNA 2.0μL,加ddH2O至25μL。
PCR反应体系(25μL):2×Taq PCR反应液10μL,16SrRNA-F和16SrRNA-R各1μL,DNA模板2μL,加 ddH2O至25μL。反应程序:94℃ 5 min;94℃ 45 s,55℃ 45 s,72℃ 45 s,30个循环;72℃ 10 min。
1.5 反应条件的优化
选择Hps 16SrRNA呈阳性的H21菌株作为阳性对照株,进行LAMP反应最佳引物组和最佳反应温度的筛选以及灵敏度、特异性试验。
1.5.1 最佳引物组的筛选 将Hps的16S rRNA的3组引物按上述反应体系分别配置后,65℃恒温反应 60 min后,80℃恒温反应 5 min,根据LAMP浊度仪实时记录的650 nm的浊度值绘制浊度曲线,以最先出现扩增反应并且扩增效率较高的引物组为最佳引物组。选择特异性好的引物组,根据需要设计环引物,再进行特异性验证,从而筛选出最佳引物组。
1.5.2 最佳反应温度的筛选 使用筛选出的最佳引物组,分别于60~67℃扩增60 min,绘制浊度曲线,选择扩增反应最早出现、扩增效率较高的温度为最佳反应温度。
1.6 LAMP灵敏度测试
使用Nanodrop 2000测定H21菌株基因组DNA浓度,然后用灭菌去离子水将模板浓度调至1 ng/μL进行灵敏度试验。继续对 1 ng/μL的DNA进行10倍连续稀释,使用同样的一组DNA模板进行LMAP反应和PCR扩增,比较两种方法的灵敏度。
1.7 LAMP特异性测试
首先使用5株标准菌株和H21进行LAMP反应特异性试验。之后选取30份临床采集的猪肺样品的DNA作为样本,采用LAMP和PCR两种方法进行检测,比较两种方法的符合程度。
1.8 试验结果的判读
1.8.1 LAMP结果判读 包括两种方式:(1)LA-320C仪器每6 s测定一次反应管中的浊度,可根据浊度绘制实时的浊度曲线图[16]。按照实验仪器的说明书,一般浊度>0.1时,认为反应结果呈阳性。(2)在LAMP反应中,DNA延伸时脱氧核酸三磷酸基质(dNTPs)中析出的焦磷酸离子与反应溶液中的镁离子结合,生成一种焦磷酸镁衍生物的白色沉淀物[17],因此使用肉眼观察是否有白色沉淀,即可判断反应扩增与否。
1.8.2 PCR结果判读 取 PCR产物5μL进行1%琼脂糖凝胶电泳,置于凝胶成像系统下观察有无条带。
2 结果与分析
2.1 最佳引物组的筛选
以H21基因组DNA为模板,分别以HP-1L、HP-2L和HP-3L为引物,浊度监测60 min并绘制浊度曲线,见图1。相同温度和反应条件下,引物HP-1L和HP-3L出现明显扩增,并且这两组引物出现扩增反应的时间差不多,但HP-1L的扩增效率明显高于HP-3L。对这两组引物组设计环引物,HP-1L引物组可设计出一组环引物(LF和LB),而HP-3L引物组只有一个环引物LB。进行特异性试验后,最终选择HP-1L+LF+LB为试验引物组,引物序列见表1。

图1 不同扩增引物下的浊度曲线

表1 LAMP和PCR方法的引物序列
2.2 最佳温度的筛选
以H21基因组DNA为模板,以表1中LAMP序列作为引物,分别在60~67℃进行反应,根据浊度仪实时监测的浊度结果绘制浊度曲线(图2)。当反应温度为64、65、66℃时,最先发生扩增反应。由于64℃时的扩增效率比较高,因此设定64℃为最佳反应温度。

图2 不同温度下的浊度曲线
2.3 LAMP方法的特异性检测
以H21作为阳性对照菌株,ddH2O作为阴性对照,使用5株标准菌株验证LAMP方法的特异性,结果(图3)表明,本研究中建立的 Hps 16SrRNA的LAMP方法具有较高的特异性,可特异性检测Hps。

图3 LAMP特异性试验
2.4 LAMP方法的灵敏度检测
以1 ng/μL的模板DNA为基础进行10倍稀释后,选择1~10-6ng/μL的7个浓度为模板,分别进行LAMP和PCR的扩增。由图4可以看出,LAMP反应的最低检测限为10-4ng/μL,PCR反应的最低检测限也为10-4ng/μL,LAMP方法与PCR的灵敏度相当。由图4 A可以看出,当DNA浓度分别为1 ng/μL和10-4ng/μL时,反应时间分别为22 min和39 min。考虑到样品的复杂性,因此将LAMP方法的反应时间设置为45 min。
2.5 临床样品检测结果
对采集的30份猪肺临床样品进行LAMP检测,结果发现12份结果为阳性;利用常规PCR进行检测,与LAMP结果吻合,证明LAMP方法可在临床样品中特异性检测Hps。
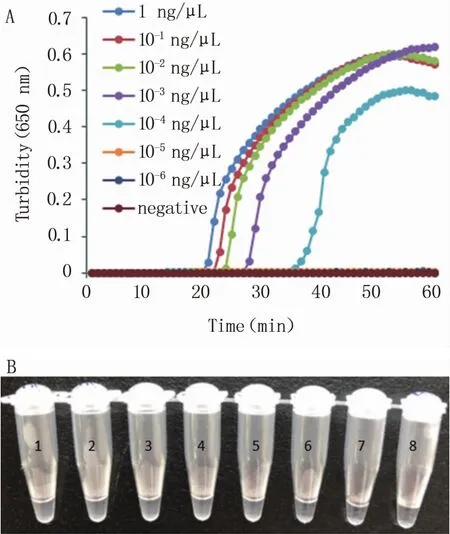
图4 LAMP和PCR反应灵敏度试验
3 讨论与结论
目前针对Hps的PCR鉴定主要使用3个靶基因,分别为16SrRNA基因、infB基因和OMP基因。16SrRNA基因在细菌各种属之间具有高度保守性,被广泛用于细菌之间的种属鉴定。
国内外对Hps快速检测的LAMP方法已有研究。Zhang[18]、Chen[19]等均根据 infB基因建立了Hps的 LAMP方法,两者的检测限分别为10 CFU/mL和 5拷贝/管。魏晓媛[20]根据 OMP P2基因建立了LAMP方法,其检测限为0.2 pg/μL。根据Hps的16S rRNA基因建立的LAMP方法,其检测限为 0.3~0.68 pg[21,22]及 0.2~0.241 pg/μL[23,24]。本试验建立的 LAMP方法灵敏度与PCR方法相当,但比上述方法灵敏。此外,上述LAMP方法的反应时间均在50~65 min,本研究建立的LAMP方法反应时间为39 min,比之前报道的LAMP方法更适用于Hps的快速检测。
LAMP被认为是快速检测核酸的一种方法,具有高特异性和高灵敏度,目前已经广泛应用于人类和动植物中。LAMP方法与PCR方法相比,成本低廉,不需要昂贵的仪器设备,即可使用Bst聚合酶达到快速反应的目的。与传统的检测方法相比,本研究建立的LAMP检测方法具有耗时短、成本低廉、操作简单等优点,尤为适合基层的疫病检测。
目前,全球养猪业受到了Hps的严重威胁,建立及时、准确的检测方法是成功防治该病的关键。本研究建立的LAMP方法为快速鉴定Hps提供了依据。
