与RABV感染相关表观遗传修饰酶的筛选
2020-11-13赵铭昕赵维荣徐婧郭艺迪张茂林
赵铭昕,赵维荣,徐婧,郭艺迪,张茂林
(1.吉林大学人兽共患病研究所/人兽共患病研究教育部重点实验室,吉林 长春 130062;2.吉林大学动物医学学院,吉林长春 130062)
狂犬病是由狂犬病病毒(rabies virus,RABV)感染引起的一种嗜神经性的人兽共患传染病,致死率100%[1]。在RABV感染中,不同毒株引发的临床表现差异很大,引起了研究者的广泛关注[2]。表观遗传学调节机制主要包括DNA甲基化、组蛋白修饰和非编码RNA作用等。DNA甲基化是目前研究最深入的表观遗传修饰方式,涉及的 DNA甲基转移酶主要有 DNMT1、DNMT3a、DNMT3b和DNMT3L。组蛋白表观遗传修饰包括甲基化、乙酰化、磷酸化、泛素化等,修饰过程动态可逆,主要有组蛋白甲基转移酶、组蛋白乙酰转移酶、组蛋白激酶和组蛋白泛素化酶等参与,催化修饰基团结合到组蛋白的氨基残基。相应地,组蛋白去甲基化酶、组蛋白脱乙酰基酶、组蛋白磷酸酶和组蛋白去泛素化酶可去除结合在组蛋白端氨基残基上的分子基团。非编码RNA最终使基因沉默从而调控基因表达[3-5]。
通常病毒感染会影响宿主细胞部分正常生理功能,本质上就是宿主基因表达的修饰,因此病毒自身或引起表观遗传学的变化已成为近年来的研究热点[6]。已有研究发现,表观遗传修饰酶参与调控多种病毒感染,例如,位于病毒长末端重复序列(LTR)上的组蛋白的去乙酰化和甲基化作用,使潜伏的HIV前病毒被沉默[7];乙肝病毒的转录和复制过程依赖于病毒HBx蛋白与 LSD1和Set1A的协同作用[8];流感病毒NP蛋白在真核细胞中通过乙酰化修饰,调控病毒颗粒的成熟和释放[9]。已有研究发现,RABV街毒与固定毒株在体内感染的细胞类型不同,而且前者引起病毒基因的转录水平也远远低于后者,并将此归结为前者逃避机体免疫的机制[2]。对RABV病毒基因组表观遗传学特征进行研究,有利于揭示不同病毒株在同类感染介质中转录和复制水平的变化,有关RABV的同类研究也在进行中[10]。鉴于目前RABV感染的表观遗传机制尚不清楚,本试验通过对小鼠神经母细胞瘤(N2a)感染实验室标准攻击毒株CVS-11,并在感染后不同时间点检测多种类型表观遗传修饰酶基因表达水平变化情况,筛选参与调控RABV感染的表观遗传修饰酶,以期为不同RABV毒株的可行性研究提供参考。
1 材料与方法
1.1 细胞和毒株
BHK细胞和N2a细胞,均由本实验室保存;实验室标准攻击毒株CVS-11,由长春兽医研究所OIE狂犬病参考实验室涂长春研究员惠赠。
1.2 主要试剂
细胞培养基DMEM,购自Corning公司;胎牛血清FBS,购自Biological Industries公司;Trizol试剂,购自TaKaRa公司;反转录试剂,购自Bioteke;荧光定量试剂FastStart Universal SYBR Green Master,购自 Roche。
1.3 病毒的培养
将BHK细胞接种在T25细胞培养瓶中,待细胞密度达到70%时,将CVS-11以MOI=1接种于细胞瓶中,37℃下感作1 h后,加含1%FBS的DMEM培养基,继续培养96 h。-80℃反复冻融细胞及培养基3次,收取混合液,将混合液4℃、1 000 r/min离心10 min,收取上清培养基,分装保存于-80℃。
1.4 病毒的感染及增殖曲线
在六孔细胞培养板中接种适宜密度的N2a细胞,37℃过夜培养后弃掉上清液,将CVS-11按照病毒量MOI=1接种于细胞,以接种与病毒等体积的磷酸盐缓冲液(PBS)为对照。37℃感作1 h,并在感染后 0、3、12、24、48 h提取细胞总RNA,对RABV N基因和相关表观遗传修饰酶基因进行定量检测。
1.5 实时荧光定量PCR
采用FastStart Universal SYBR Green Master染料进行分析。试验所用RABV N基因,DNA甲基化转移酶 DNMT1、DNMT3a、DNMT3b,组蛋白去乙酰化酶 HDAC1、HDAC2、HDAC3、HDAC5、HDAC6,组蛋白甲基转移酶 EZH2、MLL1、SETDB1、SUV39H1和组蛋白去甲基化酶 KDM6B、PHF8、LSD1以及内参GAPDH基因扩增引物见表1。
反应体系(25μL):上、下游引物各1μL,模板 cDNA 5μL,SYBR Green 12.5μL,ddH2O 5.5 μL,将配好的体系加入96孔板中。反应程序:95℃ 10 min,95℃ 15 s,60℃ 1 min,40个循环。得到Ct值进行统计分析。
1.6 数据统计与分析
数据分析使用GraphPad Prism 5软件,统计方法为t检验。P<0.05有差异(*),P<0.01有显著差异(**),P<0.001有极显著差异(***)。

表1 扩增表观遗传修饰酶基因、RABV N基因与内参GAPDH的引物序列
2 结果与分析
2.1 N2a细胞上的RABV增殖曲线
为了明确RABV在N2a细胞上的增殖曲线,将不同时间点收集并提取的细胞总RNA反转录进行荧光定量检测。结果表明,RABV感染量随时间的推移而增加,并在感染48 h达到最大值(图1)。
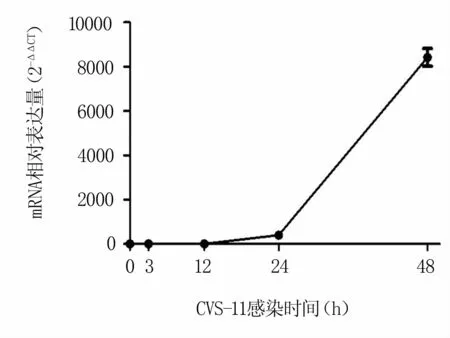
图1 N2a细胞上的RABV N基因增殖曲线
2.2 与RABV感染相关的DNA甲基化转移酶筛选
对参与甲基化的主要DNA甲基化转移酶进行检测发现,N2a感染 RABV后,DNMT1、DNMT3a基因表达水平虽然有变化,但与对照组(ctrl)相比无统计学差异(图2 A、B)。DNMT3b基因表达水平在病毒感染12 h后极显著下调(图2 C)。以上结果表明,RABV感染抑制DNA甲基化转移酶DNMT3b基因的表达。
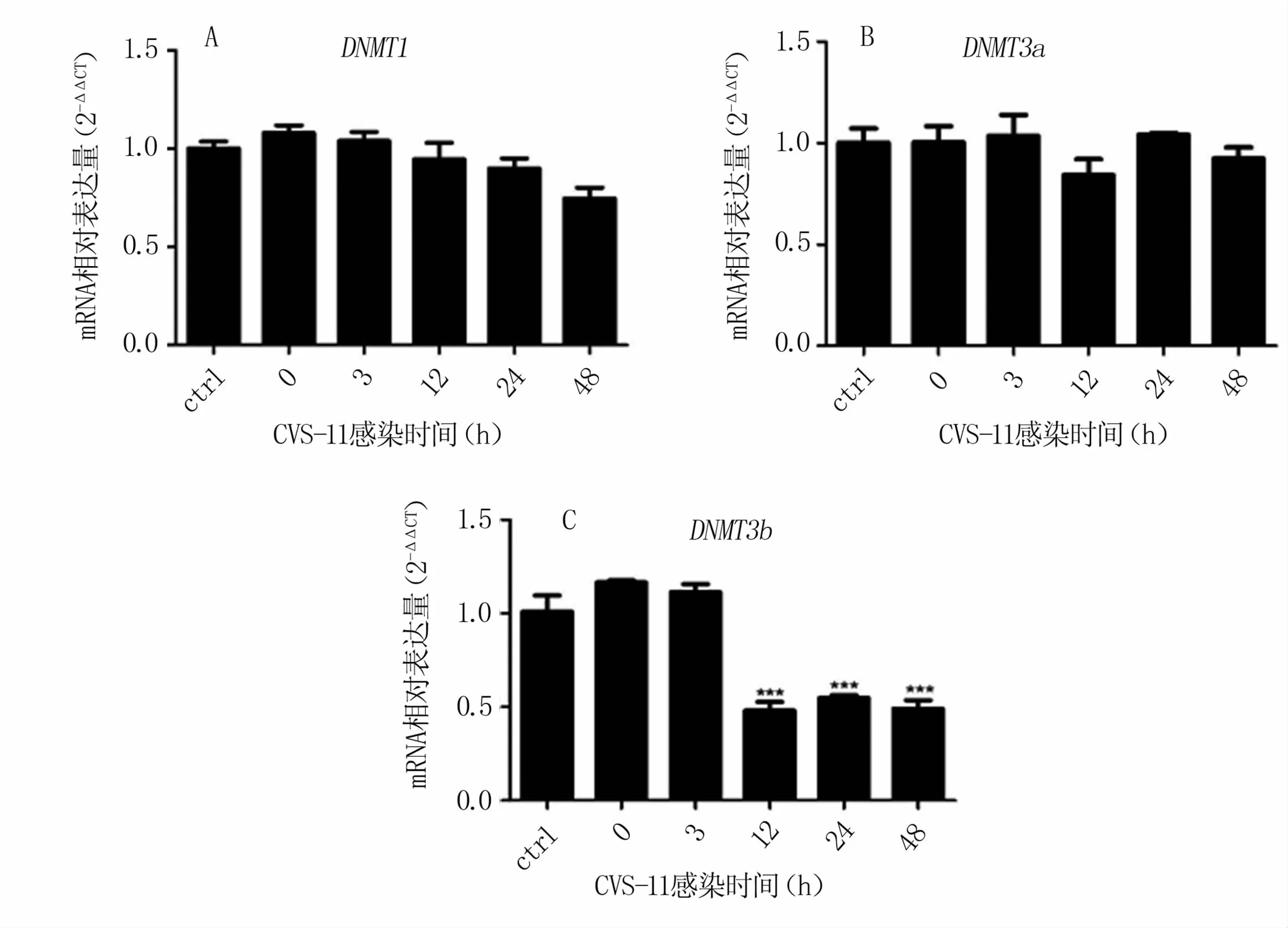
图2 与RABV感染相关的DNA甲基化转移酶基因的表达量
2.3 RABV感染相关的组蛋白去乙酰化酶筛选
对参与RABV感染相关的组蛋白去乙酰化酶进行检测发现,HDAC2、HDAC5基因表达水平与对照组相比无统计学差异(图3 B、D);HDAC1基因表达水平24 h开始极显著下降,下降约50%(图3 A);HDAC3基因表达水平下调不明显(图3 C);HDAC6基因表达水平在感染RABV后各时间点与对照组相比均极显著下降,在感染24 h后表达水平下降50%以上(图3 E)。以上结果表明,RABV感染抑制组蛋白去乙酰化酶 HDAC1、HDAC3、HDAC6基因的表达,且对HDAC6基因表达水平抑制最为显著。

图3 与RABV感染相关的组蛋白去乙酰化酶基因的表达量
2.4 与RABV感染相关的组蛋白甲基转移酶、去甲基化酶筛选
N2a感染 RABV后,组蛋白去甲基化酶KDM6B、LSD1基因表达水平与对照组相比无统计学差异(图4 A、C);PHF8在3、12、24、48 h的表达水平约下调至对照组的60%以下,差异极显著(图4 B)。
组蛋白甲基转移酶MLL1基因表达水平在感染12 h后呈上升趋势,但与对照组相比无统计学差异(图4 E);EZH2基因表达水平在感染后出现降低趋势,48 h后约降低至对照组的60%(图4 D);SETDB1基因表达水平在病毒感染12 h后显著下调,并在感染24 h后下降极显著,只占对照组的14%左右(图4 F);SUV39H1基因表达水平在病毒感染3 h后极显著降低,48 h后约降低至对照组的30%(图4 G)。
以上结果表明,RABV感染显著下调组蛋白去甲基化酶PHF8和组蛋白甲基转移酶SUV39H1基因的表达,而组蛋白甲基转移酶SETDB1基因表达在RABV感染晚期被显著抑制。
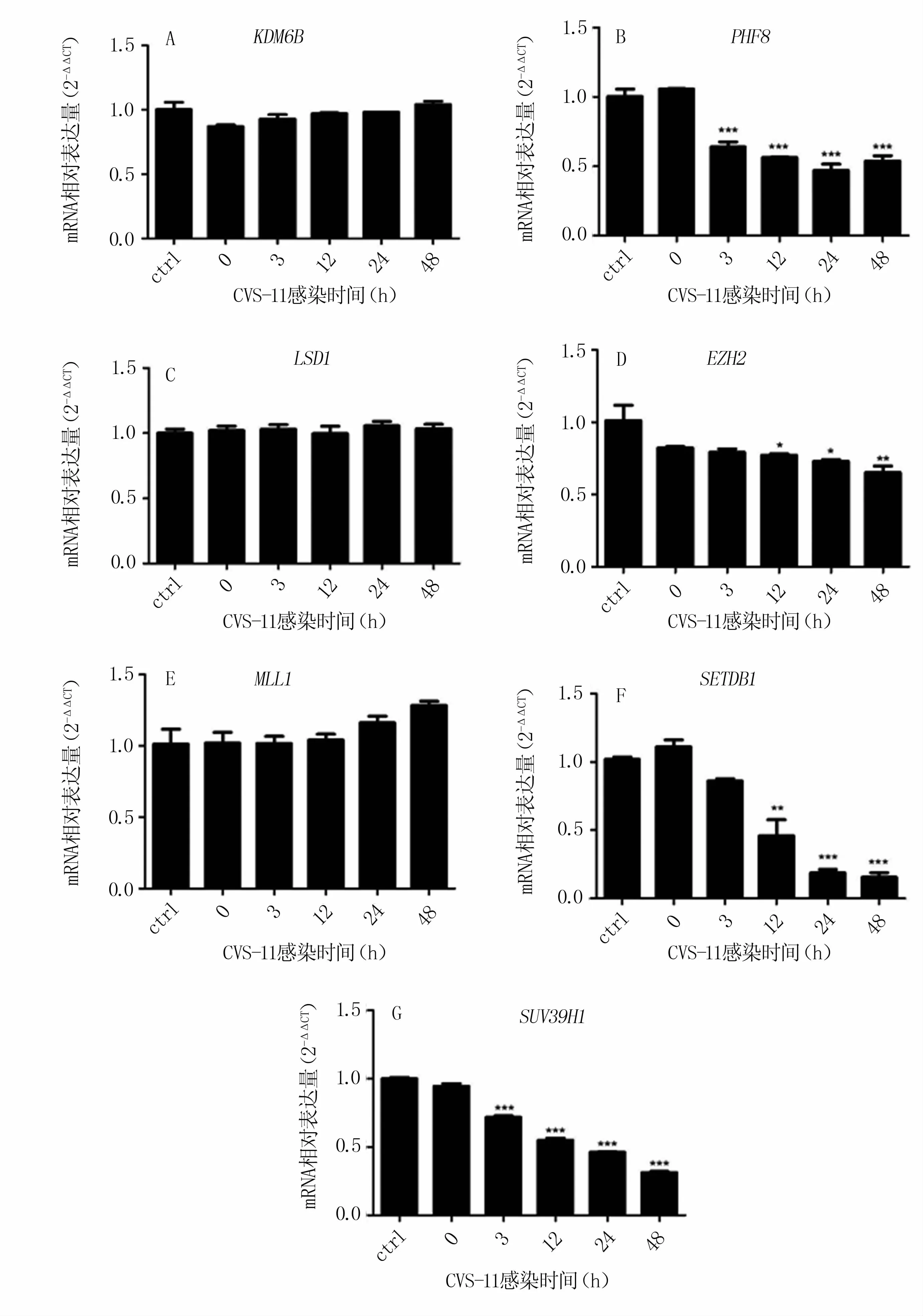
图4 与RABV感染相关的组蛋白甲基转移酶、去甲基化酶基因的表达量
3 讨论与结论
本研究通过对小鼠神经母细胞瘤(N2a)接种CVS-11,探讨表观遗传修饰系统在该毒株感染神经细胞中的作用,从中筛选出与RABV感染相关且变化显著的表观遗传修饰酶,以期从表观遗传修饰水平解析RABV引起临床表现的致病机制。
已有研究表明,HIV直接感染调节性T细胞(regulatory T cells,Tregs),诱导 DNMT3b的表达增加,造成转录因子Foxp3高度甲基化,破坏宿主Tregs的免疫调节功能[11]。本研究发现,甲基化转移酶DNMT3b在RABV感染12 h后表达水平降低,说明RABV可能通过调节DNMT3b表达水平影响靶基因DNA甲基化以利于RABV感染细胞,具体机制仍有待研究。甲型流感病毒NP蛋白的超乙酰化和乙酰化缺失均影响甲型流感病毒的复制[9]。过表达HDAC6可导致乙酰化微管蛋白减少及病毒 -细胞融合减少[12]。本研究中,HDAC6表达水平在RABV感染0 h与对照组相比呈现极显著降低的趋势,HDAC6可能通过乙酰化微管蛋白调节微管稳定性进而影响病毒侵入、胞内运输、复制、出芽等感染过程。组蛋白甲基化修饰是动态可逆的,组蛋白甲基转移酶和组蛋白去甲基化酶在病毒感染过程中可以协同发挥调节作用,例如HPV的E6蛋白可以和组蛋白甲基转移酶相互作用并通过降低酶活性使抑癌基因P53转录水平降低,E7蛋白能够催化组蛋白去甲基酶聚集到TLR9启动子区域最终降低TLR9的功能[13,14]。本研究发现,RABV感染影响了组蛋白去甲基化酶PHF8和组蛋白甲基转移酶EZH2、SETDB1、SUV39H1基因表达水平,说明在RABV感染过程中,组蛋白甲基化酶和组蛋白去甲基化酶可能协同调控下游靶基因的表达。
在病毒感染过程中,可能存在多种机制利用表观遗传系统调节生命周期中的生物活性。本研究仅针对RABV感染中的表观遗传修饰酶进行初步筛选,所调控的下游靶基因及具体调控机制还有待进一步研究。
