四种培养基对大丽轮枝菌V991b及突变体的影响
2020-11-09黄薇袁斌金利容杨小林张瑞洋万鹏
黄薇 袁斌 金利容 杨小林 张瑞洋 万鹏
摘要:为了解黄萎病菌V991b及其突变体V991w的生物学特性和致病力,调查了不同条件培养基对2种病原菌的生长及致病力的影响。结果表明,2种病原菌的生长曲线基本呈线性。V991b在PDA培养基上的生长速率与其他培养基之间差异显著,其他3种培养基之间差异不显著;V991w在PDA和PCA培养基上的生长速率之间差异不显著,与其他两种培养基之间差异显著。接种于PDA培养基15d后,V991b与V991w的菌落生长直径之间无显著差异。经查氏液体培养基摇菌后接种棉苗,25d时V991b和V991w的致病力分别为56.63和23.23,而经查氏-棉叶组织液体培养基摇菌后接种棉苗,其病情指数明显降低,接种25d时V991b和V991w的病指仅为12.12和7.32。棉叶组织培养基对大丽轮枝菌微菌核的直径生长无显著影响,但对微菌核的数量和菌丝生长有明显的抑制作用。
关键词:黄萎病;培养性状;生长速率;菌落直径;致病力
中图分类号:S43 2.4+4 文献标识码:A
文章编号:0439-8114(2020) 16-0078-07
DOI: 10.14088/j.cnki.issn0439-8114.2020.16.016
大丽轮枝菌(Verticillium Kleb.)是一种土传性的病原菌,其寄主范围广,在世界范围内都造成了不同程度的危害,且还在逐年扩大[1]。该病原菌的变异程度高,产生的微菌核抗逆性强,在土壤中可存活10年以上,且一旦定殖就很难清除掉,目前由于缺乏有效的抗病品种,土壤中微生物生态的失衡、肥料的滥用、大气环境的变化等多方面的影响,大丽轮枝菌上升成了棉花上的一种主要病害,在中国的棉区都存在着较大的影响[2,3]。由于黄萎病菌的形态和致病力容易发生变异,不同地区和来源的病原菌之间差异较大,甚至在同一块棉田中黄萎病菌的致病力也存在分化,已有研究表明长江流域的棉花黄萎病菌培养性状变化最大[4],近年来研究重心从调查不同地区的致病力分型和分化上逐渐向侵染机制上转变,但对病原菌在实验室内产生变异的原因尚无定论。Puhalla[5]认为紫外线会对病原菌产生诱变,前人研究[6-8]认为光照、温度等环境条件对轮枝菌微菌核的形成有一定的影响,32℃以上不能形成微菌核,添加黑色素外源的中间产物[9,10]处理也可以对病原菌的形态产生显著影响。但对不同营养条件下病原菌及其突变体生物学特性等方面的研究较少,本试验从不同条件的培养基入手,以V991b及其突变体V991w为研究对象,调查病原菌的培养特性和显微结构,并从生长速率和苗期接种等方面探讨其致病力发生改变的原因。
1材料与方法
1.1材料
1.1.1 供试菌株 野生型V991b为菌核型菌株,由华中农业大学作物遗传改良育种国家重点实验室惠赠;V991w为湖北省农业科学院植保土肥研究所棉花病害实验室在PDA培养条件下从V991b菌落中分离得到的突变体,为菌丝型菌株,每2周继代1次,用5mm打孔器于菌落外缘生长旺盛的区域打取菌饼,其性状经过多次继代后可稳定遗传。
1.1.2 鉴别寄主 鉴别寄主均为常规棉,其中,冀棉11为感病品种,豫棉2067为耐病品种,鲁棉28为抗病品种。各品种种子由中国农业科学院棉花研究所朱荷琴老师惠赠,在湖北省农业科学院植保土肥研究所繁育所得。
1.1.3 棉花种植及接种 棉花种子经硫酸脱绒和双氧水表面消毒后,置于平皿中以无菌水浸泡1~2 h。种子泡好后,采用无土基质来育苗。育苗基质与过筛后的河沙以重量比1:1搅拌均匀,用大方盒适量分装备用。将棉花种子播种到浸润均匀的基质中,分行播种。保持湿度,保证温室自然通风,勤加管理。使室温保持在22~28℃,待棉苗长至2~3片真叶时采用裸苗伤根法接种病原菌[11]。
1.2 方法
1.2.1 培养基制备
1)PDA培养基。PDA培养基的制作参照《植病研究方法》[12]。
2) PCA培养基。PCA液体培养基的制作同PDA培养基,但去掉琼脂粉15g,定容分装备用。
3) 水琼脂培养基。琼脂粉15g,加热溶化琼脂后用纱布过滤,定容补齐至1000 mL,121℃灭菌20 min 。
4) 棉叶组织培养基。各个棉花品种于室内26~?28℃条件下育苗,湿度70%,光照:黑暗12 h: 12h,先在浅口托盘中播种,待刚长出2片子叶后移栽,每钵移栽4~5颗棉苗,待第4片真叶完全展平后,作为试验材料取样,棉叶及棉柄作为一组,棉花茎部组织及根部组织作为一组,分别称鲜重。称重后在叶片部分加入干冰隔毛巾碎样,使样品完全粉碎而干冰仍有剩余为佳,整个过程使叶片组织完全处于低温干燥状态。碎样后放入-80℃冰箱保存待用。称取琼脂粉15g,煮沸至溶化,加入20 g叶片组织,稍加搅拌,以双层纱布过滤,定容至1000 mL。121℃灭菌20 min。
5) 查氏培养基。查氏培养基的制作参照《植病研究方法》[12]。
6) 查氏-棉叶组织液体培养基。制作1 000 mL的查氏培养基,加入20g叶片组织,稍加搅拌,以双层纱布过滤,定容至1000mL分装备用后,121℃灭菌20 min。
1.2.2 病原菌的形态结构及菌落形态的观察 将纯化培养后的V991b和V991w用5mm的打孔器打出菌饼,分别接种于4种培养基平皿上,在(25±1)℃条件下恒温培养15 d,分别观察其形态结构和菌落特征。
1.2.3 生長速率的测定 选取纯化培养后的大丽轮枝菌,从供试菌株的菌落边缘取直径2~3 mm的菌丝块,分别接种到PDA、水琼脂培养基、棉叶组织培养基和PCA培养基的平皿中央,于25℃恒温培养箱内黑暗培养,每个处理3次重复。用十字交叉法每隔1d测定菌落直径,并计算生长速率,直至接种后15d。
1.2.4 微菌核数量和直径 每皿分别吸取100μL浓度为1×l06CFU/mL V991b和V991w菌株的分生孢子悬浮液均匀涂布于培养基平板上,置于(25±1)℃恒温培养10d,每个处理3次重复,并记录微菌核产生的时间。
使用40倍倒置M微镜(Olympus IX-81,Nikon)统计每个视野下微菌核的数量。每个重复随机统计30个视野下的微菌核数量,并求出平均数。使用倒置显微镜(Olympus IX-81,Nikon)在100倍条件下,随机测量每个重复100个微菌核的长和宽,计算长和宽的平均值作为微菌核直径的代表值。从供试菌株的菌落边缘取且径2~3mm的菌丝块,分别接种到PDA、水琼脂培养基、棉叶组织培养基和PCA培养基的平皿中央,于25℃恒温培养箱内黑暗培养,4次重复,每隔1d采用十字交叉法调查菌落直径,直至接种后15 d。
在直径为90mm的培养皿中每皿倒入15mL培养基,不同培养基分别标记,接入孢子液。倒置静置,于25℃黑暗条件下培养,每个处理3次重复,并记录微菌核产生的时间。
1.2.5 病原菌致病力测定 将待测菌株接种到查氏培养液中,于25℃条件下180 r/min摇菌7d,获得菌悬液,经过双层滤纸真空抽滤,配制成浓度为5×106CFU/mL的孢子悬液。将棉花品种经无土基质育苗后移栽到直径为15 cm的营养钵中,待2~3片真叶展平后,采用浸根法接种。接种前将棉苗慢慢托起,不致大量伤根和伤苗。每个品种至少取60棵苗,将3个鉴别品种分开标记,保持根部基本整齐一致,然后置于同一菌系的菌悬液中,使根能够充分接触到菌液。裸苗浸根接种30min后移栽到营养钵中。每个营养钵中4~5株棉苗,置于22~28℃温室中自然通風培养,精心管理[11]。
1.2.6 不同培养基对微菌核产生的影响 将2种病原菌的孢子液分别接种于PDA培养基、PCA培养基、水琼脂培养基和棉叶组织培养基上,置于25℃的培养箱中黑暗培养,每个温度处理重复3皿,静置培养20d后,置于倒置显微镜下观察,并记录微菌核数量、长度、直径等参数。
1.3数据分析
采用DPS的单因素方差和Dimcan's新复极差测验的多重比较分析试验数据。
2结果与分析
2.1病原菌的形态结构及培养15d菌落直径的生长曲线
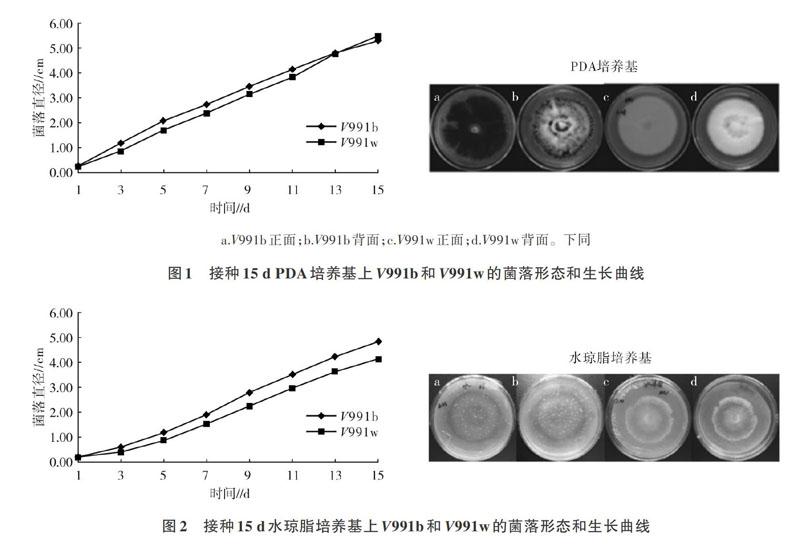
2.1.1 接种15 d PDA培养基上V991b和V991w的菌落形态和生长曲线由图1可以看出,在PDA培养基上,V991b和V991w菌落形态特征差异非常显著,V991b为菌核型菌落,微菌核多,菌落背面呈黑色,菌落表面气生菌丝少;V991w为菌丝型菌落,无微菌核,菌落背面呈白色,菌落表面气生菌丝茂密。两者的菌落外观迥异。在接种15d内菌落生长曲线呈线性关系。
2.1.2 接种15 d水琼脂培养基上V991b和V991w的菌落形态和生长曲线 由图2可以看出,在水琼脂培养基上,V991b和V991w的菌落形态特征与在PDA培养基上类似,但菌落表面的气生菌丝茂密程度明显下降,气生菌丝稀疏分布在菌落表面,V991b仍然有着肉眼可见的黑色素,是纠结成团的微菌核;V991w无微菌核,是白色的菌丝型菌落,两者菌落特征差异明显。接种15 d内菌落生长曲线呈线性关系。
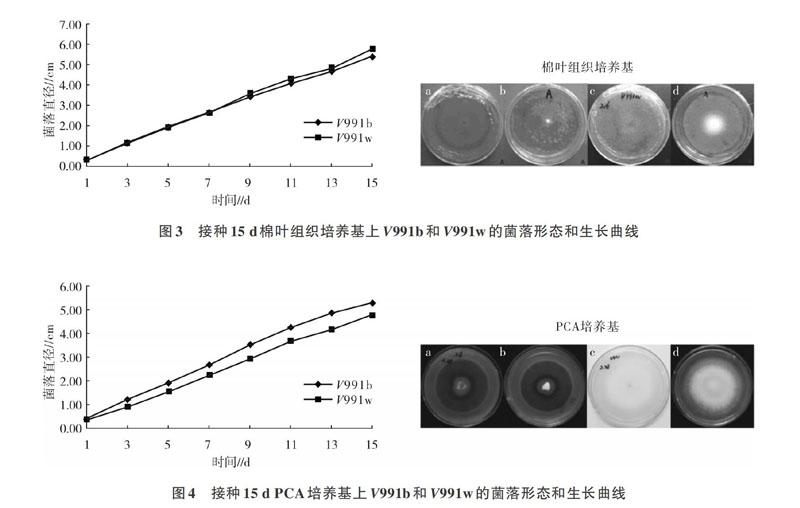
2.1.3 接种15d棉叶组织培养基上V991b和V991w的菌落形态和生长曲线 由图3可以看出,在棉叶组织培养基上,V991b和V991w平皿上的形态非常相似,但V991b的微菌核四处分散,气生菌丝少。镜检发现其气生孢子多,轮枝状结构典型且清晰,4、5个孢子丛生,产孢量高于V991w;V991w无微菌核,气生菌丝少,主要集中在菌饼处,镜检发现菌丝占大多数,轮枝状结构少,气生孢子相对来说较少。接种15 d内菌落生长曲线基本呈线性关系。
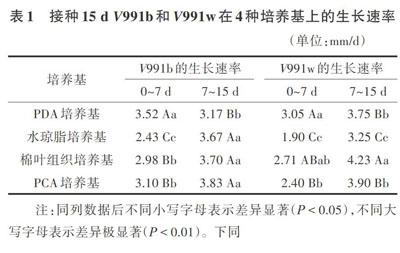
2.1.4 接种15d PCA培养基上V991b和V991w的菌落形态和生长曲线 由图4可以看出,在PCA培养基上,V991b和V991w的菌落形态特征与在PDA培养基上类似,菌落表面的气生菌丝稀疏分布在菌落表面,V991b仍为黑色菌核型,V991w为白色菌丝型,菌落特征差异明显。接种15d内菌落生长曲线基本上呈线性关系。
2.2 对病原菌生长速率的测定
由表1可知,V991b在PDA培养基上的生长速率与其他培养基之间差异显著,而其他3种培养基之间差异不显著;7~15d V991w在PDA培养基与PCA培养基上的生长速率差异不显著,而与其他2种培养基之间差异显著。接种到PDA培养基上,V991b和V991w接种15d后的菌落直径无显著差异,但在静置培养过程中,V991b与V991w的生长速率有差异,在接种后0~7 d,V991b的生长速率高于V991w,而在接种后7~15 d, V991b的生长速率低于V991w。将V991b和V991w接种到PCA培养基和棉叶组织培养基上时,也出现类似情况。仅接种到水琼脂培养基上,在静置培养的15d内,V991b生长速率始终明显高于V991w,而最终的菌落生长直径V991b也明显大于V991w。
2.3 不同类型培养基对病原菌菌落直径的影响
由表2可以看出,不同培养基条件下,接种15d后V991b和V991w的菌落直径差异不显著。接种到PDA培养基上,15d后V991b和V991w的菌落直径分别为5.27cm和5.37cm;接种到PCA培养基上,15d后V991b和V991w的菌落直径分别为5.35cm 和4.93cm; 接种到棉叶培养基上,15d后V991b和V991w的菌落直径分别为5.20cm和5.48cm;接种至水琼脂培养基上,菌落直径最低,15d后V991b和V991w菌落直径分别为4.83cm和4.13cm。
2.4 不同培养基对病原菌形态特征和显微结构的影响
如图5所示,在PDA培养基上,V991b和V991w的形态特征差异非常明显,V991b为菌核型菌落,菌落表面气生菌丝少,微菌核和分生孢子多;而V991w为菌丝型菌落,菌落表面气生菌丝茂密,显微结构以菌丝为主,菌落外观迥异。PCA培养基和水琼脂培养基上,V991b和V991w的菌落形态特征与PDA培养基上类似,而菌落表面的气生菌丝茂密程度明显下降,气生菌丝稀疏分布在菌落表面,V991b和V991w的菌落特征仍然非常明显。在棉花组织培养基上,V991b和V991w平皿上的形态非常相似,但V991b的产孢量高于V991w,气生孢子多,轮枝状结构典型且清晰,4、5个孢子丛生,微菌核四处分散。放大400倍[13]后发现,微菌核为多个厚壁的黑色细胞集结形成,纠结成团,在外缘有部分呈半透明状的细胞。V991w的气生孢子较少,稀疏分布,镜检表明菌丝占大多数,气生孢子相对来说较少,轮枝状结构少,无微菌核。
2.5 不同培养基对微菌核产生的影响
以棉花叶片组织为营养来源的培养基上,25℃条件下,黑暗静置培养3~4d即出现了肉眼可见的黑色素;在PDA培养基上,经过6~7d才出现相同情况,而在PCA培养基上约36h即出现肉眼可见的黑色素。在水琼脂培养基上6~7 d才出现微菌核。由表3可知,在PDA培养基上微菌核的长度最大,平均长度为62.975μm,视野内微菌核的数量也较多,平均数量为245.2个;在PCA培养基上产生的微菌核数量最多,平均数量可达377.3个,PCA培养基有利于微菌核的产生,但其长度在4种培养基中最短,平均长度仅有20.682 μm。棉叶培养基不利于微菌核的产生,得到的微菌核数量最少,与菌落表型基本对应。
2.6 不同培养基对病原菌致病力的影响
根据病指调查结果显示,以棉叶组织培养基摇出的病原菌致病力明显低于查氏液体培养基摇出的病原菌,V991b和V991w平均病指分別为12.12和7.32。而经查氏液体培养基扩大培养后接种棉苗,V991b的平均病指为56.63, V991w的平均病指为23.23。在查氏液体培养基中加入棉叶后摇菌接种,两种病原菌的病情指数均有下降,分别是51.10和17.38。说明棉叶组织培养基可能会影响病原菌的生长。在4种培养基中,菌核型V991b的病情指数均高于菌丝型V991w的病情指数。
3讨论
3.1病原菌的生长曲线基本呈线性关系
经测定病原菌的生长直径发现,2种病原菌的生长曲线基本呈线性关系,与湖北省农业科学院植保土肥研究所棉花病害实验室不同来源病原菌的调查结果类似,生长速率大多也呈线性关系。除了水琼脂培养基外,其他3种培养基上都是接种后7d,V991b的生长速率高于V991w;接种后15d,V991b的生长速率一般低于V991w,可能是接种前期V991b的菌丝生长速率更快。仅在水琼脂培养基上,15d内V991b生长速率始终高于V991w,导致最终的菌落生长直径V991b也明显大于V991w。
不同类型的培养基对病原菌的生长速度有影响,V991b在PDA培养基上的生长速率与其他3种培养基上有显著差异;而V991w在PDA培养基和PCA培养基上的生长速率差异不显著,而与其他2种培养基上的差异显著。接种15d后,2种病原菌在水琼脂培养基上的菌落直径均显著小于其他3种培养基。表明菌落的生长速率和菌落直径与营养条件有关,在接入平皿前期,营养条件越丰富,菌落的生长速率越快。在静置培养条件下,棉叶组织培养基不影响菌丝的伸长,俞燕等[14]认为不同碳氮比营养条件对大丽轮枝菌的产孢能力和菌丝生长有影响,低碳氮比有利于大丽轮枝菌的产孢和菌丝生长,本试验结果与之类似。
3.2大丽轮枝菌微菌核出现的早晚可能与营养成分密切相关
杨家荣等[15]发现微菌核在偏碱性的条件下更容易产生。测定4种培养基的pH发现,水琼脂培养基最高,PCA培养基次之,PDA培养基最低。PCA培养基中微菌核的产生时间先于PDA培养基和棉叶组织培养基,水琼脂培养基的pH最接近7.0,但其营养成分最低,微菌核出现的时间最晚。培养条件的pH可能会影响微菌核出现的时间,但更与培养基的营养成分有关。
前人研究将黄萎病菌按菌落特性分为菌核型、菌丝型和中间型三大类[4,16]。以PDA培养基继代培养时,菌核型菌落会出现退化现象,表现为菌落背面仅有少量微菌核,菌落正面的气生菌丝明显减少,培养2周内菌落特征趋向中间型,但静置培养时间超过1个月后,其仍表现为菌核型。多次继代培养的菌核型菌株有向中间型转化的趋势,若将退化的菌株转入PCA培养基中,发现无论是有大量微菌核的类型还是只有少量微菌核的类似中间型都很快转化为黑色菌核型,大约2d就会出现明显黑色素;而菌丝型的培养形态无改变。大丽轮枝菌的微菌核作为一种抗逆性结构,用来抵御不良环境对病原菌的影响,白应文等[17]发现将BM培养基中葡萄糖的用量减半,并在培养基表面覆盖玻璃纸可使大丽轮枝菌微菌核产量提高。那么在营养优越的条件下,微菌核的产生可能会下降。而在PCA培养基上,气生菌丝体的生长受到抑制,生长量少但很健康。这与《植病研究方法》中的结论一致[12]。
3.3 不同营养条件影响病原菌微菌核的数量和直径
病原菌微菌核的直径和数量与培养基的条件有关,营养条件不同会影响病原菌微菌核的数量,白应文[18]认为大丽轮枝菌微菌核的数量及大小与pH、温度等因素有密切关系。本研究发现不同培养基显著影响菌落表面的气生菌丝,营养丰富的培养基上气生菌丝茂密,分生孢子和微菌核显著多于营养条件较低的培养基,前者形成的气生菌落更致密,典型的轮纹状结构也更清晰。镜检显示,棉叶组织培养基中微菌核的数量明显少于其他3种培养基,扩大培养6~7d后的孢子量也显著低于其他培养基,但平皿上的菌落生长直径并未受到明显抑制,表明该培养基对菌丝生长没有太大影响。但对微菌核的数量可能有抑制作用,却未显著影响其微菌核的直径。黄薇等发现不同碳氮比营养条件明显影响大丽轮枝菌落叶型菌株微菌核的形成,在低碳氮比(25:1~30:1)中形成的微菌核明显多于在高碳氮比(45:1~50:1)中形成的微菌核。PCA相对PDA来说,淀粉含量低,碳氮比更低,因此PCA培养基中微菌核数量明显多于PDA培养基。PCA平皿中微菌核的数量虽多,但微菌核长度较短,黑色厚壁细胞多聚成团,而非常见的长条状,因此PCA培养基多用于真菌菌株的保存。
3.4 棉叶组织培养基对病原菌的生长可能有抑制作用
查式液体培养基多用于真菌的扩大培养,黄薇等[13]发现40:1的碳氮比更有利于大丽轮枝菌的孢子萌发,查氏液体培养基中约为40:1,本试验也发现所用的4种培养基中最适宜的是查式液体培养基。在抗病品种中,碳氮比为35:1时才利于大丽轮枝菌致病,过高或过低都不利于其致病。本调查结果与上述研究一致。
陆家云等[19]通过对大丽轮枝菌单孢菌株的单孢后代进行多次致病力接种试验,认为表现为野生型的菌株致病力保持不变,而表现为绒毛型变异体的致病力有分化,有减弱的趋势。石磊岩等[20]在试验中推测T9菌系可能因室内多次继代使其致病性衰退。因此,在试验中通常以接种棉苗来复壮菌株,使其致病力得到恢复。经棉叶组织培养基摇菌后发现,棉叶组织培养基对微菌核的直径虽然没有显著影响,但抑制了病原菌微菌核的数量和菌丝的生长,减缓其生长速率,可能对病原囷在棉苗中的扩张产生了不利影响。即使在接种浓度相当的条件下,随着接种时间的延长,病原菌V991b和V991w在棉叶组织培养基中病原菌的数量也可能比其他处理低。在复壮的过程中可能是植物中的其他物质在起作用,这些物质经过高温灭菌后已丧失掉其活性,无法对病原菌的扩繁起促进作用,导致棉苗发病程度和病指的下降。
参考文献:
[1]石磊岩.我国棉花黄萎病研究进展[J].棉花学报,1995,7(4):243-245.
[2]姚耀文,马存,谭永久,等.长江流域棉区棉花黄萎病发生消长与气象因子关系的研究[J].中国农业科学,1986,19(3):59-64.
[3]王瑞卿,张旭,王景怀,等.影响我国棉花黄萎病发生的综合因素分析[A].中国棉花学会2007年年会论文集[C].2007.455-458.
[4]朱荷琴,馮自力,尹志新,等.我国棉花黄萎病菌致病力分化及ISSR指纹分析[J].植物病理学报,2012,42(3):225-235.
[5] PUHALLA J E. Differences in sensitivity of verticillium species toultraviolet irraclialion[J].Phytopathology, 1973,63: 1488-1492.
[6]张绪振,张树琴,陈吉棣,等.我国棉花黄萎病菌“种”的鉴定[J].植物病理学报,1981,11 (3): 13-18.
[7]TJAMOS E C, FRAVEL D R. Detrimental effects of sublethal heat-ing and Talaromyces flavus on microslerotia of Verticillium dahliae[J] .Phytopathology ,1995,85(4): 388-392.
[8]商文静,陈婷,白应文,等.大丽轮枝菌微菌核的萌发条件及致死温度[J].菌物学报,2013,32(6): 986-992.
[9]BASSAM S E,BENHAM()U N,CARISSE 0. The role of melanin inthe antagonistic interaction between the apple scab pathogen Ventu-ria inaequalis and Microsphaeropsis ochracea [J]. Canadian journal ofmicrobiology, 2002,48(4): 349-358.
[10]曹志艳,杨胜勇,董金皋.植物病原真菌黑色素与致病性关系的研究进展[J].微生物学通报,2006,33( 1):154-158.
[11]金利容,万鹏,孔令甲,等.湖北省棉花黄萎病病菌致病力分化研究[J].棉花学报,2011,23(6):566-572.
[12]方中达.植病研究方法[M].第3版.北京:中国农业出版社,1998.134-137,140-145.
[13]黄薇,袁斌,金利容,等.大丽轮枝菌V991b及其变异体的培养性状及致病力研究[J].湖北农业科学,2017,56(24):4777-4781.
[14]俞燕,蔡梦杭,徐灿,等.不同碳氮比对棉花黄萎病菌主要生物学性状及致病力的影响[J].新疆农业科学,2019,56(1): 84-92.
[15]杨家荣,商鸿生,高立强.土壤环境因素对棉花黄萎病菌微菌核存活的影响[J].植物病理学报,2004,34(2): 180-183.
[16]宋晓轩,朱荷琴,郭金城.棉花黄萎病(Verticillum Kleb.)安阳菌系致病力分化研究[J].中国农业科学,1997,30(1): 13-18.
[17]白应文,胡东芳,胡小平,等.大丽轮枝孢微菌核的形成条件[J].菌物学报,2011,30(5): 695-701.
[18]白应文.大丽轮枝菌微菌核生物学特性研究[D].陕西杨凌:西北农林科技大学,2011.16-18.
[19]陆家云,王克荣.大丽轮枝菌致病力稳定性的研究[J].植物保护学报,1990,17(2): 105-108.
[20]石磊岩,冯洁,王莉梅,等.北方植棉区棉花黄萎病菌生理分化类型研究[J].棉花学报,1997,9(5):273-280.
收稿日期:2020-05-18
基金项目:湖北省农业科技创新中心资助项目(2016-620-000-001-016);国家转基因新品种培育重大专项(2016ZX08012004-006)
作者简介:黄薇(1981-),女,湖北武汉人,助理研究员,硕士,主要从事棉花病害防治研究,(电话)13487097672(电子信箱)34966440@qq.com;通信作者,万鹏(1972-),男,湖北监利人,研究员,博士,主要从事农业昆虫与转基因环评研究,(电子信箱)wanpenghb@126.com。
