大孔吸附树脂分离纯化羊肚菌水提取物中糖苷酶抑制剂的研究*
2020-11-08张雪松凡军民谢春芹
张雪松,凡军民,谢春芹,曹 正,刘 硕
(江苏农林职业技术学院茶与食品科技学院,江苏 句容 212400)
随着当今人们生活方式的改变,糖尿病的发病率也在不断攀升。通过延缓糖类的消化、吸收从而降低血糖,是治疗糖尿病的一个重要途径[1]。人体摄入的糖类主要在小肠内被消化吸收,如在淀粉酶的作用下食物中的淀粉水解为麦芽糖,然后被α-葡萄糖苷酶水解为可以被小肠吸收的葡萄糖[2-3]。因此可以通过服用糖苷酶抑制剂抑制糖类消化,减缓人体内糖类的吸收,最终达到抑制餐后血糖快速升高的目的。目前常见的研究方法为体外酶活性抑制试验,即以淀粉、麦芽糖、PNPG或蔗糖为底物,通过比色法测定糖苷酶抑制率[4]。
当前糖苷酶抑制剂的常用药物有阿卡波糖、米格列醇和伏格列波糖,但都存在不同程度的不良反应[5]。很多中药材以及食(药)用菌提取物对于糖尿病具有一定的治疗及减缓症状的作用,相对西药无明显副作用且成本较低,而多糖是其主要生物活性成分[6]。研究表明,灵芝、虫草、香菇等食用菌中的多糖具有降低血糖的功效,对糖苷酶具有一定的抑制作用[7]。羊肚菌(Morchella spp.)由于其菌盖布满网状褶皱,形状如羊肚而得名。是一种珍稀的食用菌,其营养丰富,含有大量氨基酸及多糖[8]。目前,有关羊肚菌提取物生物活性的研究主要集中在抗氧化、抑菌、抗疲劳、抑制肿瘤及抗癌等方面[9],而几乎未有关于羊肚菌提取物降糖方面的研究,缺乏其体外糖苷酶活性抑制试验,对其分离纯化研究的报道更是少见。
大孔吸附树脂是一种新型的人工合成有机高聚物吸附剂,吸附性能优异且价格便宜,通过选择性地吸附有机物质,以达到分离纯化的目的。目前已广泛的应用于各种中草药有效活性成分的分离及纯化研究[10]。研究表明,大孔吸附树脂对于许多食用菌提取物具有较好的吸附作用,常用于食用菌提取物中多糖的分离纯化,如虫草多糖[11]、灵芝多糖[12]、香菇多糖[13]等,具有较好的分离纯化效果。课题组前期的研究表明羊肚菌水提取物对α-淀粉酶、麦芽糖酶、α-葡萄糖苷酶、蔗糖酶均有一定的抑制作用。分别以α-淀粉酶抑制率、麦芽糖酶抑制率、α-葡萄糖苷酶抑制率、以及蔗糖酶抑制率为参数,采用大孔吸附树脂分离纯化羊肚菌水提取物中的糖苷酶抑制剂,优化其分离纯化条件。
1 材料与方法
1.1 材料与试剂
六妹羊肚菌(Morchella sextelata),江苏农林职业技术学院食用菌教学基地栽培。
麦芽糖、蔗糖、淀粉、氢氧化钠、无水碳酸钠、磷酸二氢钾、3,5-二硝基水杨酸、磷酸氢二钾、盐酸、氯仿、正丁醇、95%乙醇、4-硝基苯基-α-D吡喃半乳糖苷均为分析纯,国药集团化学试剂有限公司。
蔗糖酶(100 U·mg-1)、α-淀粉酶(20 000 U·mL-1)、α-葡萄糖苷酶(700 000 U·mL-1)、麦芽糖酶(50 U·mg-1),上海麦克林生化科技有限公司。
1.2 仪器与设备
Nicolet 5700傅里叶红外光谱仪,美国Thermo公司;GZLYZ-1真空冷冻干燥机,诸城市博汇机械有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;KQ-500DV型数控超声波清洗器,昆山市超声仪器有限公司;HWS24型电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;SY-5000旋转蒸发器,上海亚荣生化仪器厂;CP214电子天平,奥豪斯仪器(上海)有限公司;磁力搅拌器,金坛市杰瑞尔电器有限公司。
2 试验方法
2.1 样品的制备
参考刘奕辰水提醇沉法[14],采用超声波辅助提取[15]并略作修改。取羊肚菌子实体洗净、去除杂质,置于105℃的烘箱中灭菌10 min,65℃烘干。将烘干的羊肚菌子实体粉碎过40目筛,并以1∶10的比例与蒸馏水混合。设置超声功率为400 W,在55℃下提取45 min,提取2次,将提取物合并,于4℃冰箱中过夜。取上清液,通过4层纱布过滤,离心获得上清液。在85℃水浴中浓缩,通过Sevag法将浓缩液离心2次以获得上清液。加入6倍体积的无水乙醇,在-20℃的冰箱过夜,沉淀多糖。弃去上清液,收集沉淀物,真空冷冻干燥后得到羊肚菌多糖。
2.2 糖苷酶抑制活性测定
2.2.1 淀粉酶抑制率的测定
α-淀粉酶抑制率的测定方法采用让一峰[16]的方法略加改动。加入2%淀粉溶液0.5 mL,在抑制管和抑制对照管中加入1.0 mL样品溶液,在空白管和空白对照管中加入1.0 mL蒸馏水作为对照,后于空白管和抑制剂管加入α-淀粉酶稀释液(20 U·mL-1)0.5 mL,对照管加入0.5 mL蒸馏水。置于37℃水浴10 min后,加入配置好的DNS试剂1.0 mL,再放入沸水浴中5 min,加入10.0 mL蒸馏水,冷却至室温,最后于540 nm处测其吸光值。酶抑制试验重复3次。抑制率(InR,%)计算公式为:
式中:A0、AⅠ、AⅢ和AⅢ分别为540 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
2.2.2 麦芽糖酶抑制率的测定
麦芽糖酶抑制率的测定采用吴彬彬[17]的方法略加改动。加入2%麦芽糖溶液0.5 mL,在抑制管和抑制对照管中加入1.0 mL样品溶液,在空白管和空白对照管中加入蒸馏水1.0 mL进行对照,后在空白管和抑制剂管加入0.5 mL麦芽糖酶(20 U·mL-1),对照管加入0.5 mL蒸馏水。置于37℃水浴中反应10 min后,加入1.0 mL DNS,于沸水浴中反应5 min,加入10.0 mL蒸馏水,冷却至室温,最后于405 nm处测定吸光值(A)。酶抑制试验重复3次。抑制率(InR,%) 计算公式为:
式中:A1、A2、A3和A4分别为为405 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
2.2.3 α-葡萄糖苷酶抑制率的测定
α-葡萄糖苷酶抑制活性的测定方法依据陈海君[18]的方法略加改动。加入PNPG溶液2.0 mL,在抑制管和抑制对照管中加入1.0 mL的样品溶液,在空白管和空白对照管中加入1.0 mL蒸馏水进行对照,再加入2mL磷酸盐缓冲溶液。置于37℃水浴中保温10 min,在空白管及抑制管加入酶液1 mL(20 U·mL-1),在对照管加入蒸馏水1 mL。再次放入37℃水浴中保温15 min,加入5 mL碳酸钠溶液终止试验。冷却至室温,于405 nm处测得吸光值(A)。酶抑制试验重复3次。抑制率(InR,%)计算公式为:
式中:A1、A2、A3和A4分别为405 nm下空白管空白对照管、抑制管和抑制对照管的吸光值。
2.2.4 蔗糖酶抑制率的测定
蔗糖酶抑制率的测定方法采用王璐瑶[19]的方法稍作修改。加入2%蔗糖溶液0.5 mL,在抑制管和抑制对照管中加入1.0 mL样品溶液,在空白管和空白对照管中加入1.0 mL蒸馏水进行对照,后于空白管和抑制剂管加入0.5 mL蔗糖酶(20 U·mL-1),对照管加入0.5 mL蒸馏水。置于37℃水浴中反应10 min后,加入1.0 mL DNS,于沸水浴中反应5 min,加入10.0 mL蒸馏水,冷却至室温,最后于550 nm处测定吸光值(A)。酶抑制试验重复3次。抑制率(InR,%)计算公式:
式中:A5、A6、A7和A8分别为为550 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
2.3 大孔吸附树脂的预处理
按参考文献[20]称取适量大孔吸附树脂,用去离子水润洗,去除树脂表面杂质,滤去水分,加入3倍树脂体积的95%乙醇浸泡24 h,赶出树脂中的气泡并使其充分膨胀。后将树脂用去离子水冲洗至无明显乙醇气味,且流出液不浑浊为止,放在4℃阴暗处备用。本试验选取了5种不同的树脂,分别为AB-8、S-8、D101、NKA-9、LX-17。大孔吸附树脂相关参数见表1。
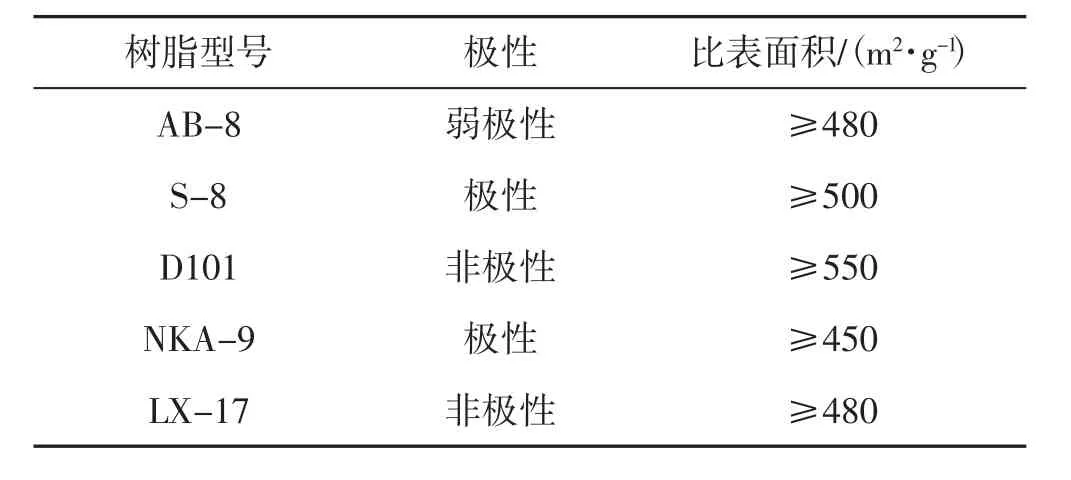
表1 吸附树脂性能参数Tab.1 Adsorption resin performance parameters
2.4 大孔吸附树脂筛选
静态吸附均按照参考文献[21]并略作修改。分别称取经过预处理的5种树脂各2 g于250 mL的锥形瓶中,后加入100 mL的样品溶液(为确保试验测定结果更加准确,以α-淀粉酶抑制率为参数时,样品浓度为200 mg·L-1;以蔗糖酶抑制率为参数时,样品浓度为10 mg·L-1。以麦芽糖酶和α-葡萄糖苷酶抑制率为参数时样品浓度为40 mg·L-1)。将转子放入锥形瓶中,打开磁力搅拌器,设定在100 r·min-1、30℃的条件下进行静态吸附12 h。吸附结束后,测定溶液对4种糖苷酶的抑制率。活性越低则说明树脂吸附效果越好,选取对糖苷酶抑制率最低的树脂进行接下来的试验。
2.5 大孔吸附树脂静态吸附
2.5.1 吸附时间
称取D101树脂2 g于250 mL的锥形瓶中,加入100 mL样品溶液,100 r·min-1、30℃的条件下静态吸附12 h,最终达到饱和状态。静态吸附过程中,每间隔1 h,取样测定4种糖苷酶抑制率。
2.5.2 吸附温度
称取D101树脂2 g于250 mL的锥形瓶中,加入100 mL样品溶液,分别在20℃、25℃、30℃、35℃、40℃条件下静态吸附3 h,测定吸附后溶液的4种糖苷酶抑制率。
2.5.3 树脂质量
分别称取D101树脂1 g、2 g、3 g、4 g、5 g于250 mL的锥形瓶中,加入100 mL样品溶液,在30℃条件下静态吸附3 h,测定吸附后溶液的4种糖苷酶抑制率。
2.6 大孔吸附树脂动态吸附
2.6.1 洗脱剂浓度
洗脱剂浓度确定根据参考文献[22]并略作修改。称取经过预处理的D101树脂10 g装柱(层析柱规格:1 cm×30 cm,1 BV=3.14×12×30/4≈25 mL),加入100 mL样品溶液(pH 7),以2 BV·h-1的流速进行吸附,过柱后静置2 h,然后依次选用各2 BV(50 mL)的蒸馏水、20%乙醇、40%乙醇、60%乙醇、80%乙醇、100%乙醇进行洗脱。洗脱液用旋转蒸发仪将乙醇完全蒸发,定容至100 mL,测定洗脱液的4种糖苷酶抑制率。
2.6.2 样品溶液pH值
取5份100 mL样品溶液,分别用1 mol·L-1HCl或1 mol·L-1NaOH将其pH调至4、5、6、7、8,然后称取经过预处理的D101树脂10 g装柱5根,以2 BV·h-1的流速进行吸附,过柱后静置2 h,2 BV(50 mL) 80%乙醇洗脱。洗脱液用旋转蒸发仪将乙醇完全蒸发,定容至100 mL,测定洗脱液的4种糖苷酶抑制率。
2.6.3 洗脱剂用量
洗脱剂用量确定根据参考文献[23]并略作修改。配制100 mL、pH 6的样品溶液,称取经过预处理的D101树脂10 g装柱2根,以2 BV·h-1的流速进行吸附,过柱后静置2 h,然后量取100 mL(4 BV)80%乙醇进行洗脱,每25毫升(1 BV) 收集1份。洗脱液用旋转蒸发仪将乙醇完全蒸发,定容至100 mL。测定洗脱液的蔗糖酶和α-葡萄糖苷酶抑制率;配制100 mL、pH 7的样品溶液依法操作,测定洗脱液的麦芽糖酶和α-淀粉酶抑制率。
2.7 傅里叶变换红外光谱分析
将样品磨成粉末,与溴化钾混合后一起压片,得到均匀的薄片进行测试。扫描范围为500 cm-1~4 000 cm-1。
3 结果分析
3.1 大孔吸附树脂吸附条件的确定
3.1.1 大孔吸附树脂筛选
将选取的5种大孔吸附树脂进行静态吸附,比较吸附后溶液对4种糖苷酶的抑制率,结果见图1。
由图1可知,经5种大孔吸附树脂静态吸附后,4种糖苷酶抑制率均有所下降,说明选取的大孔吸附树脂对样品中糖苷酶抑制剂都具有一定吸附作用,其中经D101树脂吸附后样品溶液的酶活性抑制率最低,说明D101树脂的吸附效果最好,因此选用该树脂。
3.1.2 吸附时间对树脂吸附效果的影响
在静态吸附过程中,通过吸附速率的高低可以确定吸附过程的最佳时间。D101树脂吸附速率见图2。
由图2可得,4种糖苷酶的酶活性抑制率均在前2 h下降最快,3 h后基本没有明显变化,说明在3 h前吸附速率最快,在3 h后吸附率达到饱和。有效成分在大孔树脂上的有效吸附通常分为4个连续的步骤[24],前3 h下降很快,说明多糖成分的吸附主要是在暴露于表面的活性中心上,其只需要在溶液和液膜中进行扩散,到达树脂表面即可吸附。而3 h以后,随着吸附量的不断增加,树脂表面具有吸附活性的面积减少;多糖分子开始通过树脂的孔道扩散到树脂内表面而被吸附;树脂颗粒内扩散的阻力限制了扩散,从而使得吸附趋于平缓直至达到饱和。
3.1.3 吸附温度对树脂吸附效果的影响
不同吸附温度对羊肚菌水提物溶液糖苷酶抑制率的影响见图3。
由图3可知,吸附温度对D101大孔树脂吸附效果的影响较明显,吸附后的溶液对4种糖苷酶抑制率均在30℃时最低。适当的提高温度可以使得溶液的黏度降低,分子运动加快,从而可以有效提高多糖分子的扩散与吸附。
3.1.4 树脂质量对树脂吸附效果的影响
不同树脂质量对羊肚菌水提物溶液糖苷酶抑制率的影响见图4。
由图4可知,树脂质量对于树脂吸附效果的影响较明显,4种糖苷酶抑制率在树脂质量不断增加过程中,酶活性抑制率不断降低。当树脂质量为4 g后无明显变化,说明吸附率达到饱和,即当树脂质量与羊肚菌水提取物溶液的质量体积比为1∶25时,吸附效果最好。当树脂量较少时,减少了多糖分子与树脂接触的机会,从而使得吸附量下降。
3.2 大孔吸附树脂洗脱条件的确定
3.2.1 洗脱剂浓度的确定
不同浓度的洗脱剂对洗脱液糖苷酶抑制率的影响见图5。
由图5可知,随着洗脱剂浓度的不断增加,洗脱液糖苷酶抑制率也在递增。当洗脱剂浓度为80%时,洗脱液中4种糖苷酶抑制率均为最高,洗脱效果最好。α-淀粉酶、麦芽糖酶、α-葡萄糖苷酶以及蔗糖酶抑制率分别为17.55%、14.81%、38.17%和46.2%。而洗脱剂浓度高于80%时,洗脱液对4种糖苷酶的抑制率则有所下降,由此可以确定洗脱剂乙醇的最佳浓度为80%。不同分子量大小的多糖在乙醇中的溶解度存在较大差异,并且对于非极性大孔树脂而言,洗脱剂极性越小,洗脱能力越强[25]。
3.2.2 羊肚菌水提物溶液pH的确定
样品溶液的pH对洗脱液糖苷酶抑制率的影响见图6。
由图6可知,羊肚菌水提物溶液pH为7时,洗脱液α-淀粉酶酶与麦芽糖酶活性抑制率最高,分别为17.55%与14.81%。羊肚菌水提物溶液的pH为6时,洗脱液对α-葡萄糖苷酶与蔗糖酶酶活性抑制率最高,分别为41.95%与50.30%。由此可以确定不同的糖苷酶种类,羊肚菌水提物溶液分别在pH 6与pH 7时效果最佳。多糖分子中存在羟基,酸性过大的条件下容易质子化,削弱了与溶液中水分子的相互作用力,树脂对多糖分子吸附力下降,从而导致洗脱液4种糖苷酶抑制率下降。而在碱性条件下,大孔树脂容易结成块状物,也不利于样品的吸附[26]。
3.2.3 洗脱剂用量的确定
不同洗脱剂体积对对洗脱液糖苷酶抑制率的影响见图7。
由图7可知,洗脱剂体积为2 BV时,洗脱液中α-淀粉酶与麦芽糖酶酶活性抑制率最高,分别为21.67%与16.02%;洗脱剂体积为3 BV时,洗脱液中α-葡萄糖苷酶与蔗糖酶酶活性抑制率最高,分别为42.23%与53.20%。由此可以确定根据糖苷酶种类的不同,洗脱剂乙醇的最佳用量分别为2 BV与3 BV。用量过少,洗脱不完全;而用量多,则易造成洗脱液中有效成分的浓度下降,从而降低其对4种糖苷酶的抑制率。
3.3 分离纯化前后糖苷酶抑制率的比较
羊肚菌水提物中糖苷酶抑制剂分离纯化前后对糖苷酶抑制率的比较见图8。
由图8可知,利用大孔吸附树脂对羊肚菌水提物中糖苷酶抑制剂进行分离纯化后,4种糖苷酶酶活性抑制率均有较大幅度提高。与分离纯化前相比,α-淀粉酶酶活性抑制率由2.55%提高到21.67%,提高了8.50倍;麦芽糖酶抑制率由10.05%提高到16.02%,提高了1.59倍;α-葡萄糖苷酶酶活性抑制率由17.54%提高到42.23%,提高了2.41倍;蔗糖酶酶活性抑制率由43.80%提高到53.20%,提高了1.21倍。
3.4 分离纯化前后样品表征
羊肚菌水提物分离纯化前后的傅里叶红外光谱图见图9。
由图9可知,羊肚菌水提物及其D101大孔树脂洗脱物的红外图谱基本吻合,官能团种类基本未发生变化。在3 420 cm-1处出现-OH伸缩振动吸收峰,2 928 cm-1为C-H伸缩振动吸收峰,1 635 cm-1处出现-OH弯曲振动吸收峰,1 410 cm-1处出现=CH2的变形吸收峰,1 152 cm-1处出现环上C-O吸收峰,1 078 cm-1处出现了醇羟基的变角振动峰,1 026 cm-1处出现了糖环C-O-C吸收峰,926 cm-1处出现了呋喃环的对称伸缩振动吸收峰,羊肚菌水提物及其洗脱物呈现明显的多糖吸收特征。同时,850 cm-1处出现α型糖苷键的特征吸收峰,760 cm-1出现了振动吸收说明羊肚菌水提物及D101洗脱产物中具有吡喃糖结构,成苷的为α构型[27]。
4 结论与讨论
选择5种不同大孔吸附树脂对羊肚菌水提物中的糖苷酶抑制剂的吸附效果进行研究,通过静态吸附筛选出最佳树脂为D101,确定吸附温度为30℃,样品溶液与树脂比例为1∶25时吸附效果最好。D101大孔吸附树脂对羊肚菌水提取物中α-淀粉酶及麦芽糖酶抑制物最佳分离纯化条件是pH 7的样品溶液吸附后,再以2 BV 80%乙醇洗脱;α-葡萄糖苷酶及蔗糖酶酶最佳分离纯化条件是pH 6样品溶液吸附后,再以3 BV 80%乙醇洗脱。纯化后产物对α-淀粉酶、麦芽糖酶、α-葡萄糖苷酶以及蔗糖酶抑制率分别达到21.67%、16.02%、42.23%和53.20%,相比纯化前提高了8.50倍、1.59倍、2.41倍与1.21倍。
目前,人们通过天然产物分离得到的糖苷酶抑制剂的纯度普遍偏低,无法满足生产所需[28];所以选取一种操作简便,效果显著的纯化方法具有重要意义。许有瑞等[29]曾利用有机溶剂萃取的方法分离甘草中α-葡萄糖苷酶抑制剂,经乙酸乙酯萃取后糖苷酶抑制率从69.77%提升至83.02%,仅提高了1.19倍。曾岚等[30]曾利用大孔吸附树脂分离甘草中α-葡萄糖苷酶抑制物,经处理后α-葡萄糖苷酶从48.11%提升至95.00%,提高了1.97倍。当前,天然糖苷酶抑制剂的研究开发已成为较活跃的领域,以淀粉、麦芽糖和蔗糖为底物的糖苷酶抑制剂定向筛选模式因其作用机制明确、靶向作用具体、假阳性率低等优点备受关注[31]。针对4种糖苷酶抑制剂所建立的大孔吸附树脂的纯化工艺合理可行,具有较好的纯化效果,为羊肚菌水提物体外降血糖能力的研究与应用提供依据。
