薏仁米贮藏过程中油脂氧化规律及原因探究
2020-11-05李永富张晶晶黄金荣陈正行
李永富 张晶晶 史 锋 黄金荣 陈正行
(江南大学食品学院;江南大学粮食发酵工艺与技术国家工程实验室1,无锡 214122)(江苏省生物活性制品加工工程技术研究中心2,无锡 214122)(江南大学食品科学与技术国家重点实验室3,无锡 214122)
薏仁米(coix seed),又称薏米、薏苡仁、六谷子等,是禾本科玉蜀黍族薏苡属植物薏苡的种仁[1]。薏仁米籽粒由包括胚乳、胚芽和皮层三部分构成,去掉胚芽和皮层后得到的就是薏仁米。薏仁米营养价值丰富且兼具药理作用,素被誉为“世界禾本科植物之王”和“生命健康之禾”。《本草纲目》等相关医书记录,薏仁米具有强筋骨、健脾胃、消水肿、去风湿、清肺等多种功效,中国卫生部于1987年10月将薏仁米列入第一批药食兼用名单[2]。薏仁米是我国最古老作物之一,在我国大部分地区都有种植,贵州种植面积最大,其次是云南,另外福建、辽宁、河北、广东、海南等地均有少量种植[3]。在当今保健食品风靡的时代,薏仁米深受消费者喜爱,目前我国的薏仁米产品主要有以薏仁米为原料制作成的酒、膨化食品、饼干、粥、饮品和醋等[4]。
但长期以来,薏仁米作为小品种杂粮作物,并未得到充分的利用和开发。与我国传统主粮相比,薏仁米的脂肪质量分数约5%,相当是大米和小麦的2~3倍[5],其产品的货架期较短,在贮藏过程中品质易发生劣变,从而产生让消费者不愉快的哈败味,降低了薏仁米的营养及商业价值。张立庆等[6]在开发薏米饮品时发现薏仁米由于油脂氧化产生哈败味,李美玲等[7]在开发薏仁米酸奶时也同样出现油脂氧化酸败的现象,李长凤[8]在研发薏米挂面时发现油脂氧化酸败极大影响挂面的食用品质,且货架期不超过6个月。基于此类情况,杨凤仪等[9]发现低温真空包装方式能够将薏仁米的保鲜期由2个月延长至6个月及以上。陈光静等[10]发现薏仁米贮藏过程中异味主要是由于薏仁米油脂氧化产生的,且其二级氧化产物醛类化合物是产生异味的主要原因。虽然针对薏仁米贮藏保鲜方法已有不少研究,但仅仅是通过控制贮藏温度、包装方式和外加抗氧化剂的方式,还是无法达到长期保存的目的。因此,本实验将研究分别用真空和自封袋包装的薏仁米在37 ℃贮藏过程中油脂氧化各项指标的变化规律,并通过检测R·信号强度、脂肪酶和脂肪氧化酶活性等指标来探究油脂氧化的原因,以期为延长薏仁米的货架期提供参考。
1 材料与方法
1.1 材料与试剂
薏仁米:脱壳运输至实验室,及时预冷并储存于-18 ℃冷冻冰箱中备用。
无水乙醇、氢氧化钾、三油酸甘油酯、无水乙醚、丙酮、石油醚(分析纯)、己醛标准品。
1.2 仪器与设备
FW-100高速万能粉碎机,LXJ-IIB低速离心机,GC-2010气相色谱仪,EMXplus-10/12电子自旋共振波谱仪,SCIONSQ-456-GC气质联用仪,Avanti J-26XP高速冷冻离心机,UV-1800紫外-可见光分光光度计,ICAP TQ电感耦合等离子体质谱仪。
1.3 方法
1.3.1 贮藏实验设计
将购买的新鲜薏仁米分别以每180 g装袋,共9袋,其中4袋用真空包装,5袋用自封袋包装,置于37 ℃的恒温培养箱中贮藏,分别测定0、4、8周的脂肪酶、脂肪氧化酶活性和脂肪酸组成,以及0周的高活性二价金属元素,其他理化指标每隔2周测定1次。
1.3.2 贮藏指标的测定
1.3.2.1 水分含量的测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》的直接干燥法进行测定。
1.3.2.2 AV的测定
参照GB/T 15684—2015《谷物碾磨制品脂肪酸值的测定》进行测定。
1.3.2.3 POV的测定
参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》的滴定法进行测定。
1.3.2.4 己醛含量的测定
通过顶空固相微萃取(HS-SPME)和气相色谱-质谱法(GC-MS)联用进行测定[11]。以癸烷标准品作为内标,用甲醇配制成1 mg/mL的内标液。用95%乙醇将己醛标准品配制成100 μg/mL储备液,均置于4 ℃冰箱中避光冷藏备用。将薏仁米样品粉碎过100目筛,取1 g样品粉末于气相瓶中,加入5 mL去离子水和20 μL癸烷内标液,振荡器混匀,待测。另外,将己醛储备液用去离子水稀释至2 μg/mL,再向气相瓶中加入5 mL稀释后的标品溶液和20 μL癸烷内标液,振荡器混匀,待测。顶空气相测定条件参照Mexis等[12]方法。
1.3.3 油脂氧化原因的探究
1.3.3.1 R·信号强度的测定
将薏仁米样品粉碎过100目筛,精确称取薏仁米粉(60.0±5.0) mg于直径为9 mm的核磁管中,装填过程中避免样品粉末沾壁,装填完毕后在桌面上轻敲,使样品粉末在核磁管底部分布均匀,使用电子自旋共振波谱仪(ESR)进行R·信号强度的测定。
测定条件:中心磁场3 355 G,g因子为2.000 0,扫场宽度100 G,扫描时间20 s,微波功率20 mW。R·强度以磁场强度用3 355 G处的峰高与1 g样品(干基)质量的比值来表示。
1.3.3.2 脂肪酶活性的测定
脂肪酶活性参照GB/T 5523—2008《粮油检验粮食、油料的脂肪酶活动度的测定》进行测定并有所改动。将薏仁米样品分别粉碎过100目,称取1 g样品,0.5 g三油酸甘油酯和少量石英砂,在研钵中混合均匀,再加入2.5 mL磷酸缓冲液,研磨成匀浆状,将其转入50 mL离心管中,用2.5 mL去离子水清洗研钵,使匀浆全部转入离心管中,于30 ℃培养24 h。取出后加入25 mL乙醇乙醚混合液振荡,静置1~2 min,3 500 r/min离心5 min后得12.5 mL上清液,用0.01 mol/L KOH乙醇溶液滴定至pH=8为终点,计算脂肪酶活性。脂肪酶活性以中和1 g样品(干基)中生成游离脂肪酸所消耗的氢氧化钾的毫克数表示。
1.3.3.3 脂肪氧化酶活性的测定[13]
底物配制: 0.5 mL 吐温60中加10 mL 0.2 mol/L pH 9.0 硼酸缓冲液, 混匀溶解,再逐滴加入0.4 mL 亚油酸(化学纯),形成乳浊液后滴加10% NaOH 0.5 mL,使全部溶解,溶液透明无色后,再加90 mL上述硼酸缓冲液。取此溶液20 mL,加上述硼酸缓冲液定容到100 mL,避光冷藏备用。使用前,再将此溶液用硼酸缓冲液稀释40倍。
酶粗提液: 取过40目筛的薏仁米样品1 g,加25 mL磷酸盐缓冲液(0.1 mol/L,pH 7.5),4 ℃摇床振荡提取30 min,8 000 r/min 离心10 min,取上清,冷藏备用。
测定方法:取底物2.8 mL,酶液0.2 mL,测定时混合均匀,空白为不加酶液的底物,立即在234 nm处观察OD值的变化,记录1 min内(0 s和60 s)OD值变化数据,重复3次实验。
脂肪氧化酶活力计算:在25 ℃,pH 9.0,反应时间1 min的条件下,以亚油酸为底物的3 mL 反应体系于234 nm处的吸光值增加0.001 计为一个活力单位,计算公式:
式中:EALOX为脂肪氧化酶活力/U/(g·min);OD60’为第60 s时生成过氧化物的吸光值;OD0’为第0 s时生成过氧化物的吸光值。
1.3.3.4 霉菌含量的测定
参照GB 4789.15—2016《食品安全国家标准 食品微生物学检验霉菌和酵母计数》进行测定。
1.3.3.5 脂肪酸组成的测定
脂肪酸组成通过气相色谱法测定。气相色谱测定条件参照李诗炜[14]的方法。
脂肪提取:将薏仁米粉碎过60目筛,称取薏仁米粉3 g左右,利用脂肪抽提器在70 ℃条件下用无水乙醚回流抽提3 h。
脂肪酸甲酯化:脂肪酸甲酯化方法参照王超群等[15]的方法。索氏抽提粗脂肪60~80 mg,加2 mL 0.5 mol/L NaOH甲醇溶液,振荡2~3次之后,60 ℃水浴30 min。冷却后加2 mL 25%三氟化硼甲醇溶液,60 ℃水浴20 min。冷却后加2 mL正己烷和2 mL饱和NaCl溶液,振荡萃取分层,取上层液体1 mL进行气相分析。
1.3.3.6 二价金属元素含量的测定
二价金属元素含量通过微波消解—电感耦合等离子体质谱仪测定。仪器工作参数设定参照李宁涛[16]的方法。
1.4 数据处理
采用Excel 2007计算水分含量、脂肪酸值、过氧化值等指标的平均值和标准差,数据结果以平均值±标准差的形式表示。用Excel 2007和Origin 8.5共同绘制图表,数据处理用SPSS 24.0软件进行方差分析。
2 结果与分析
2.1 贮藏期间薏仁米的含水量变化
含水量是粮食贮藏过程中的基本监测指标之一,可以反映粮食的生理活性和品质状态[17, 18],同时也是其他指标测定的基础。自封袋和真空包装的薏仁米在37 ℃贮藏期间含水量的变化如图1所示,由图1可知,无论是真空还是自封袋包装的薏仁米,其水分含量在前2周处于稳定状态,之后处于下降的趋势,但在6~8周后水分含量均有所上升。两种包装方式下的含水量无明显差异,由此说明包装方式对水分含量变化的影响不大。水分含量的损失可能由于37 ℃下发生了水分的蒸发,贮藏后期水分上升的原因可能由于薏仁米在贮藏过程中产生的呼吸作用生成了水等产物。
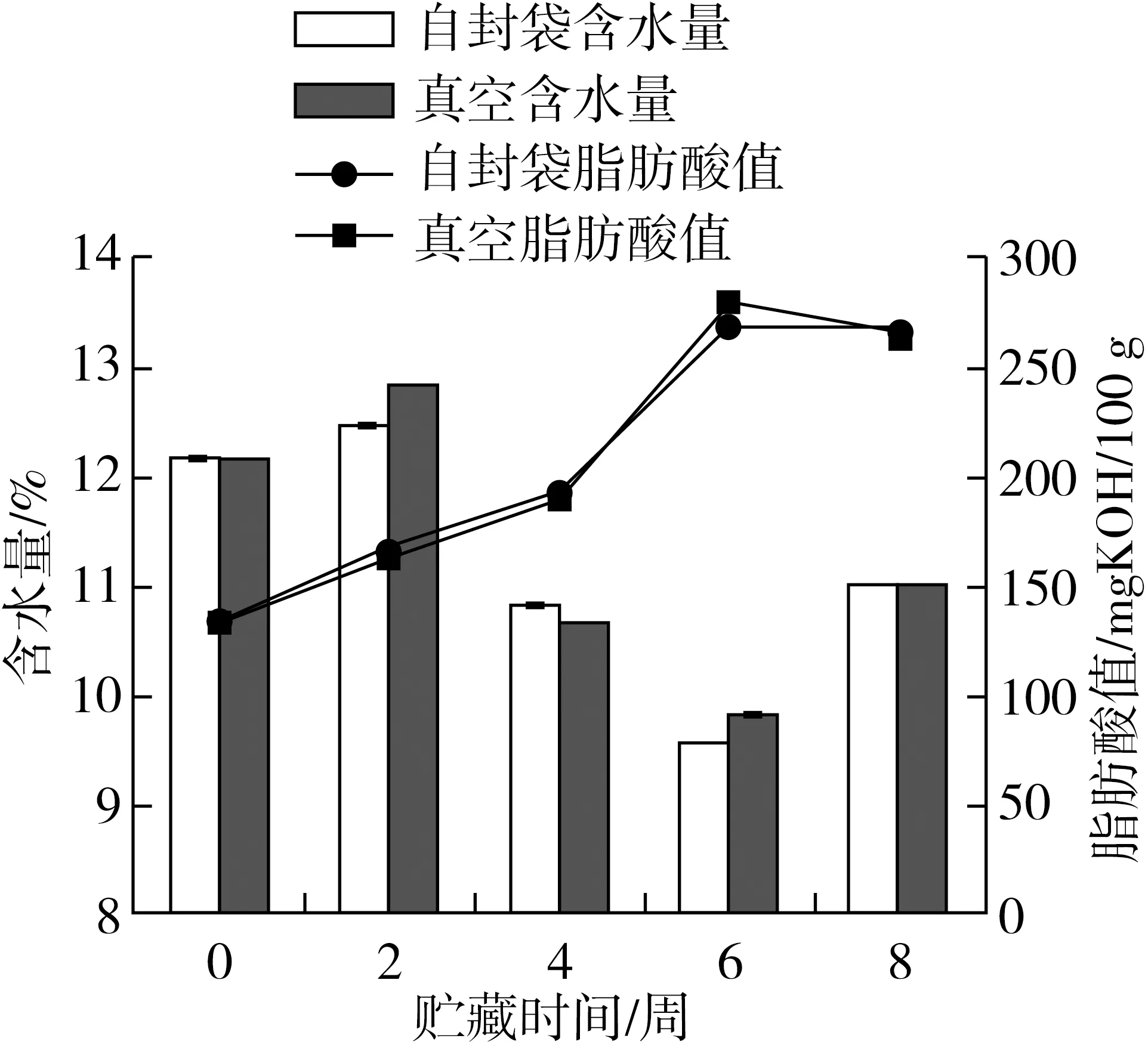
图1 自封袋和真空包装的薏仁米在37 ℃贮藏期间含水量和脂肪酸值的变化
2.2 贮藏期间薏仁米的AV变化
油脂经过水解后生成一系列游离脂肪酸,AV则是衡量粮食中游离脂肪酸的重要指标,可以反映薏米仁在贮藏过程中的品质变化和劣变程度。自封袋和真空包装的薏仁米在37 ℃贮藏期间脂肪酸值的变化如图1所示,无论真空还是自封袋包装,0~6周薏仁米的AV呈快速增长趋势,由此可知,贮藏期间薏仁米发生了脂肪的水解酸败,品质不断劣变;6~8周AV明显下降,原因可能是游离脂肪酸被大量氧化生成了其他次级产物,或其存在形式(如结构等)发生改变,难以检测出来[19]。另外,真空和自封袋包装下AV变化无显著性差异,由此可知,包装方式对薏仁米的AV变化影响不大,这与杨凤仪等[9]的研究结论一致。
2.3 贮藏期间薏仁米的POV变化
油脂氧化的关键产物是氢过氧化物,POV则是判定氧化劣变程度的敏感指标之一。自封袋和真空包装的薏仁米在37 ℃贮藏期间过氧化值的变化如图2所示,在真空包装下,POV在贮藏期间呈上下波动的稳定状态;而在自封袋包装下,POV呈线性增长趋势。真空包装下POV保持相对稳定,一方面可能是因为真空条件下氧气浓度低,氧化反应速率缓慢,另一方面可能因为反应生成的氢过氧化物极不稳定,当浓度达到一定时会自动氧化分解成小分子醛、酮等物质。总之,真空包装可有效抑制薏仁米储藏期间POV的增大,即自封袋相比真空包装更易加速油脂的氧化劣变,这与代来鑫等[20]的研究结论一致。

图2 自封袋和真空包装的薏仁米在37 ℃贮藏期间过氧化值和己醛含量的变化
2.4 贮藏期间薏仁米的己醛含量变化
薏仁米在贮藏期间会产生不愉快的异味,其主要成分是小分子醛、酮类物质,如己醛、庚醛、壬酮等[11],它们是油脂氧化的终极产物,故己醛含量可以作为衡量油脂氧化劣变程度的关键指标之一。自封袋和真空包装的薏仁米在37 ℃贮藏期间己醛含量的变化如图2所示,贮藏8周后,无论是真空还是自封袋包装的薏仁米,己醛含量均呈上升的趋势,说明氢过氧化物发生了进一步氧化分解。但自封袋包装下的己醛含量明显高于真空包装,主要是因为真空条件下氧气浓度较低,氢过氧化物生成速率缓慢,从而其下一级分解产物己醛的生成量较低。
2.5 贮藏期间薏仁米的R·信号强度变化
已有研究表明,油脂氧化反应主要是由油脂的自动氧化和酶促氧化造成的,其中自动氧化占主导作用。自动氧化分为三个阶段,引发期、传递期和终止期,每个阶段都有着自由基的生成或消失,故自动氧化也称为自由基链式反应。酶促氧化中脂肪氧化酶只能作用于1,4—顺,顺—戊二烯基位置,且此基团位于脂肪酸的ω-8位,在脂肪氧化酶作用下脂肪酸的ω-8先失去质子形成R·,而后进一步被氧化。究其本质,油脂氧化的始发原因是R·的存在,为了减缓油脂氧化劣变程度,应降低R·信号强度且尽可能保证在贮藏期间该强度维持在相对稳定的状态。故探究薏仁米的R·信号强度变化是解释油脂氧化最为关键的指标。ESR是一种快速检测自由基的方法[21],0周薏仁米烷基自由基信号强度的ESR光谱图如3所示。
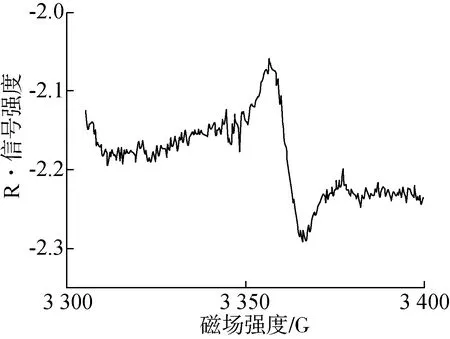
图3 0周薏仁米烷基自由基信号强度的ESR光谱图
自封袋包装薏仁米的R·信号强度在0~2周发生明显下降,可能是因为油脂氧化速率快,R·与氧气大量结合生成烷氧基;2~8周无明显变化,可能是因为自动氧化有R·的减少,同时也有新的R·生成,从而进行氧化反应的循环。真空包装薏仁米的R·信号强度在0~6周无明显变化,可能是因为氧化速率慢,消耗的R·少;6~8周开始发生明显下降,一方面可能是因为AV下降导致R·的来源减少,另一方面可能是在贮藏后期油脂氧化速率开始增大。由此说明在一定的贮藏期间内真空包装下的R·信号强度相对自封袋较稳定,氧化速率较慢,但超过一定期限真空条件下仍能发生严重的油脂劣变。
2.6 贮藏期间薏仁米的脂肪酶和脂肪氧化酶活性变化
脂肪酶是第一个参与油脂分解代谢的限速酶[22],可以调控脂肪由三酰甘油酯向脂肪酸转化的速率,有研究表明,游离脂肪酸的增长速率与脂肪酶活性具有极显著正相关性。另外,脂肪氧化酶是酶促氧化反应中重要的催化介质,能够专一催化含有1,4—顺,顺—戊二烯基的多不饱和脂肪酸,如亚油酸、亚麻酸等,将其加氧转化为氢过氧化物,另外,王志海等[27]研究表明,在恒温、恒湿的条件下贮存豆粉,正己醛的生成量与脂肪氧化酶的活性有明显的线型关系。故探究薏仁米的脂肪相关酶活性变化是解释油脂氧化的另一关键指标。
自封袋和真空包装的薏仁米在37 ℃贮藏期间脂肪酶和脂肪氧化酶酶活的变化如图4所示。由图4可知,贮藏8周后,无论是真空还是自封袋包装的薏仁米,其所含的脂肪酶和脂肪氧化酶活性均略有增大,且第4周和第8周的两种酶活均无明显差异,但真空包装下的两种酶活性均略低于自封袋包装,由此可以解释两种包装下薏仁米油脂氧化指标变化的规律和差异。

图4 自封袋和真空包装的薏仁米在37 ℃贮藏期间脂肪酶和脂肪氧化酶酶活的变化
2.7 贮藏期间薏仁米的霉菌含量变化
贮藏期间薏米中脂肪酶和脂肪氧化酶活性均保持稳定或略有增大,故探究脂肪相关酶活性增大的原因是否由外界微生物所导致,是解释油脂氧化的重要间接指标之一。其中霉菌是外源脂肪酶和脂肪氧化酶的主要来源[28],检测贮藏期间霉菌含量的变化可以一定程度上反映外源酶活性的大小。
贮藏初期霉菌含量180 CFU/g,2周后自封袋包装的薏仁米的霉菌含量迅速降低至55 CFU/g,之后缓慢下降直至稳定;而真空包装的薏仁米的霉菌含量迅速降低至15 CFU/g,之后保持稳定状态。贮藏2周后霉菌突然急骤下降,可能由于水分活度下降到安全范围0.85以下,不适宜霉菌的生存。另外,真空包装薏仁米的霉菌含量下降幅度相较于自封袋包装的大,由此可见真空包装对霉菌有较好的抑制作用,主要原因是霉菌是好氧微生物。总之,无论是真空还是自封袋包装,在贮藏期间薏仁米的霉菌含量始终维持在较低水平,故参与油脂氧化的酶主要是薏仁米的内源酶,且酶活性的增大并不是由外源微生物所导致的。
2.8 贮藏期间薏仁米的脂肪酸组成变化
由研究表明,不饱和脂肪酸(UFA)较饱和脂肪酸(SFA)更易发生氧化反应[29],故探究薏仁米中游离脂肪酸的组成是解释油脂氧化原因的重要指标之一。由结果可知,自封袋和真空包装的薏仁米的脂肪酸主要由单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)组成,共占84.6%左右,其中油酸所占比例最大,其次是亚油酸。随着贮藏时间的延长,薏仁米的脂肪酸组成发生了明显变化,SFA的含量逐渐升高,UFA的含量逐渐下降,说明参与油脂氧化反应的主要是UFA。自封袋包装的薏仁米在37 ℃贮藏期间脂肪酸组成的变化见表1,可知,自封袋包装下薏仁米的亚油酸(C18∶2)、亚麻酸(C18∶3)分别下降了2.68%、6.40%,而油酸(C18∶1)相对上升了0.2%,表明共轭双键越多则越容易氧化。真空包装的薏仁米在37 ℃贮藏期间脂肪酸组成的变化见表2,可知,真空包装下薏仁米中亚油酸和亚麻酸分别下降了0.12%和1.6%,PUFA的氧化速率远小于自封袋包装下的氧化速率,由此证明了真空条件更有利于油脂的稳定性贮藏。
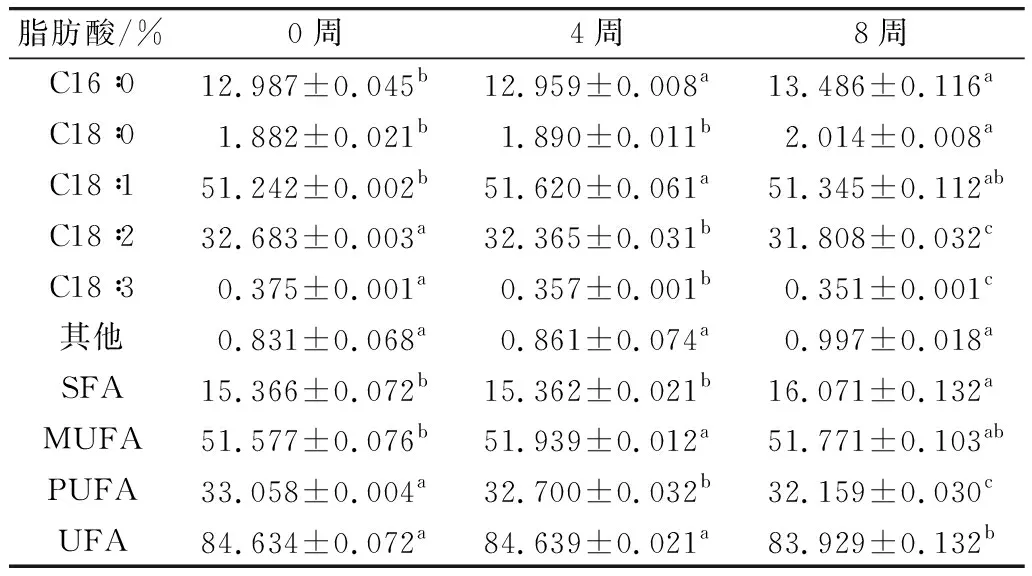
表1 自封袋包装的薏仁米在37 ℃贮藏期间脂肪酸组成的变化

表2 真空包装的薏仁米在37 ℃贮藏期间脂肪酸组成的变化
2.9 贮藏期间薏仁米的部分金属元素含量
金属离子(Fe、Cu、Mn等)的作用在于能够缩短诱导期和提高氢过氧化物的分解速度[30,31],Galeron等[32]研究表明,金属离子是催化油脂氧化的强有力因素。将贮藏0天的薏仁米原料中部分金属元素的含量与已知大米和小麦相应金属含量[33]进行比较对解释薏仁米油脂易氧化现象具有重要意义。薏仁米、大米和小麦的部分金属含量的比较见表3,由表3可知,薏米中金属元素含量排序:Mg>Ca>Fe>Zn>Cu,与刘春兰等[34]的结论一致,且Fe和Cu的含量均远高于大米和小麦相应的金属含量,由此说明薏仁米更易发生油脂的氧化劣变。
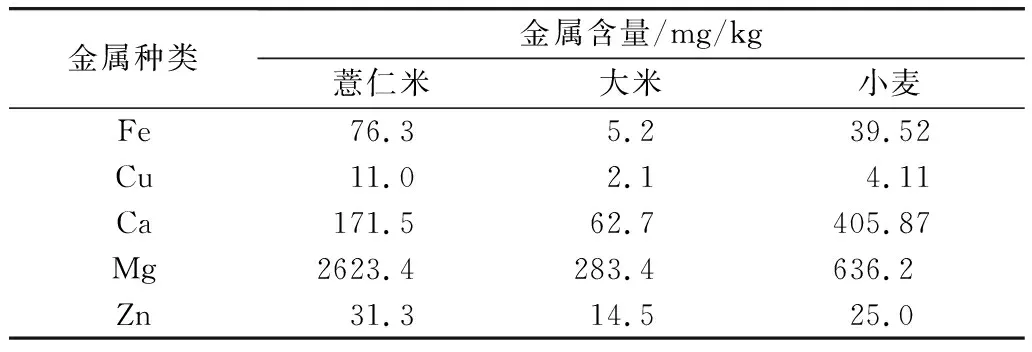
表3 薏仁米、大米和小麦的部分金属含量的比较
3 结论
随着贮藏时间的延长,薏仁米的AV、POV、己醛含量逐渐上升,水分含量逐渐下降,在真空和自封袋的两种包装下均会发生不同程度的油脂氧化,且后者比前者劣变程度要严重。排除外界因素的影响,薏仁米发生油脂氧化的主要原因是R·、内源脂肪酶和脂肪氧化酶的存在,且酶活性在贮藏过程中逐渐增大。另外,薏仁米中的UFA所占比例不断下降,SFA所占比例不断上升,说明R·的主要来源是油酸、亚油酸和亚麻酸等不饱和脂肪酸。除此之外,薏仁米所含二价金属元素较多,其中Fe、Cu等具有助氧化剂作用的金属元素含量高于普通大米、小麦等谷物。因此,仅用真空包装是无法达到长期保鲜的效果,为了延长薏仁米的货架期,应从消除R·和相关酶活性等方面入手。
