牡蛎壳源L-天冬氨酸螯合钙的结构表征及特性研究❋
2020-11-04姜岁岁王润芳李诗洋赵元晖
王 真, 姜岁岁, 张 帆, 王润芳, 冯 雪, 汪 瑞, 李诗洋, 赵元晖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
牡蛎(Crassostreagigas)作为第一批被卫生部批准的药食同源食品,不仅其肉质味道鲜美,营养丰富,而且其壳也是重要的中药材,具有重镇安神、软坚散结、潜阳补阴的功效[1]。中国的牡蛎产量居世界首位,2017年牡蛎的海水养殖产量达 487.94×104t,约占贝类养殖总产量的 34%,较 2016 年幅度增长 4.70%,伴随而生的是大量的占牡蛎整体质量60%以上的牡蛎壳[2-3]。除了部分用作药材和土壤改良剂以及用于石灰生产外,大多数牡蛎壳被填埋、堆肥和向海洋倾倒等,引起很多环境问题。因此,如何把废弃牡蛎壳资源化,备受国内外研究者关注[4]。
牡蛎壳中含有大量的碳酸钙,质量分数占90%以上[5]。近年来不少学者研究利用废弃牡蛎壳制备各种钙制剂,为牡蛎壳的高值化利用提供了一些新的途径[6-8]。目前,对于氨基酸螯合钙的结构和理化特性研究不多,大部分仅局限于螯合物的制备,红外和紫外分析等[9]。本试验基于L-天冬氨酸(L-Aspartate, L-Asp)是酸性氨基酸,且作为钙的载体及钙结合蛋白的重要组成部分,能被细胞膜识别,通过特异性载体蛋白钙通道在小肠绒毛膜上皮进行主动转运吸收,可在加热搅拌条件下直接与牡蛎壳粉反应生成L-天冬氨酸螯合钙[8],经过前期的螯合条件优化后,利用扫描电镜、红外光谱和质谱等对L-天冬氨酸螯合钙进行结构表征,并研究其X射线衍射(X-ray diffraction, XRD)、差示扫描量热(Differential scanning calorimetry, DSC)、热重(Thermogravimetry, TG)等指标及体外稳定性等特点,以期为深入开发和研究L-天冬氨酸螯合钙提供理论基础。
1 实验部分
1.1 试剂与仪器
L-天冬氨酸螯合钙(实验室自制);胃蛋白酶(3 000 U/g,索莱宝公司);胰蛋白酶(50 kU/g,索莱宝公司),溴化钾(光谱纯)和无水乙醇、盐酸、氢氧化钠、二硫腙、茚三酮、硫化钠(均为分析纯,国药集团化学试剂有限公司)。
YK高速万能粉碎机 山东益康中药器械有限公司;CV-600恒温水浴锅(上海福马实验设备有限公司);BD-126W冰箱(青岛海尔电器集团);PHS-3E型pH计(上海仪电科学仪器股份有限公司);JD500-2型电子天平(沈阳龙腾电子称量仪器有限公司);傅立叶变换红外光谱仪FT-IR-4100(佳司科上海贸易有限公司);FW-5A布鲁克红外用压片机(天津博天胜达科技发展有限公司); HF-2B红外压片模具(天津拓普仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);Tescan-vega3扫描电子显微镜(德国Bruker公司);IB-3离子镀膜仪(日本Eiko公司);三重四级杆串联质谱仪1290 Infinity II UHPLC/6460 QqQ MS(美国Agilent科技公司);AA-6300C石墨炉原子吸收分光光度计(日本岛津公司);DSC250差示扫描量热仪(美国TA仪器公司); TG209F3热重分析仪(德国耐驰仪器制造有限公司);D8 Advance X-射线衍射仪(德国Bruker公司)。
1.2 实验过程
1.2.1 L-天冬氨酸螯合钙的制备[10]根据实验室前期优化的条件,取清洗干净的烘干牡蛎壳→用榔头敲成碎块状→将牡蛎壳碎块放入高速万能粉碎机中,调至一档粉碎→粉碎后的壳粉过300~200目筛→将L-天冬氨酸和过筛牡蛎壳粉按摩尔比2∶1配料→加5倍氨基酸和壳粉总质量的蒸馏水→加热至50 ℃→调节pH至5.0→恒温磁力搅拌90 min→趁热过滤→减压浓缩至粘稠状→乙醇沉淀→离心收集沉淀→冷冻干燥得到L-天冬氨酸螯合钙。
1.2.2 L-天冬氨酸螯合钙的定性检验[11]取1~3 g样品,加入50 mL无水乙醇,搅拌静置一段时间后过滤,向滤液中加入二硫腙试剂。若溶液变红,说明样品中可能存在游离金属离子,继续用乙醇洗涤,直至二硫腙检测不变色;之后再加入5滴茚三酮试剂,电炉加热沸腾2~3 min。若溶液不变色,说明样品中无游离氨基酸;若溶液变为蓝紫色,需用无水乙醇继续分离纯化,直至完全去除;之后加入过量硫化钠,静置一段时间。若有大量白色沉淀产生,说明硫离子置换出螯合物中的钙离子,过滤去掉沉淀,收集滤液;向滤液中加入5滴茚三酮试剂,电炉加热沸腾2~3 min。若溶液变为蓝紫色,证明硫离子置换出螯合物里的钙后,螯合态的氨基酸变为游离氨基酸。
1.2.4 L-天冬氨酸螯合钙的红外光谱分析 取适量的L-天冬氨酸和L-天冬氨酸螯合钙于玛瑙研钵,在红外烤灯下分别与少量干燥的光谱纯KBr充分研磨,使其粒度在2.5 μm以下,将混合粉末装入压片模具,于红外用压片机上抽气加压,压力为900 kg/cm2,维持1.5 min,卸掉压力得到透明的KBr薄片,迅速放入样品室,使用傅里叶变换红外光谱仪在400~4 000 cm-1区间扫描,得到红外光谱图[5]。
1.2.5 L-天冬氨酸螯合钙的一二级质谱分析 取少量经过纯化的L-天冬氨酸螯合钙样品溶于超纯水中,采用正离子模式进行一级质谱扫描,设置电压175.0 V,扫描范围m/z为100~1 000,水∶甲醇为7∶3 ,二级质谱碰撞诱导电离(CID)为碰撞能量值55%[13-14]。
1.2.6 L-天冬氨酸螯合钙的XRD分析 采用X-射线衍射仪测定牡蛎壳粉、L-天冬氨酸和L-天冬氨酸螯合钙的结晶性能[15]。X-衍射条件为:Cu Kα辐射源管压40 kV,管流40 mA,扫描速度0.2°/s,步长0.02°,接受狭缝0.2 mm,用X射线在2θ=10°~80°范围内测定样品的X射线衍射强度。
1.2.8 L-天冬氨酸螯合钙的TG分析 在氮气氛围中进行测定,温度范围为25~800 ℃,升温速率10 ℃/min[17]。
1.2.9 L-天冬氨酸螯合钙的稳定性分析[18-19]
1.2.9.1 L-天冬氨酸螯合钙的热稳定性分析 将L-天冬氨酸螯合钙配成0.5%的溶液,分别置于60、70、80、90和100 ℃水浴中加热1 h,冷却至室温后用火焰原子吸收分光光度法测定游离钙离子含量,每组样品平行测定3次。螯合物的热稳定性用钙保留率表示,下同。
钙保留率 =(处理后结合钙量 / 初始总钙量)×100%。
在具体工程数据管理中,数据管理指标可根据花溪区红岩水库往年记录的基础数据指标为核心,通过移民工程数据管理中的位置管理、数据拓扑关系管理建立对应指标数据。
1.2.9.2 L-天冬氨酸螯合钙的酸碱稳定性分析 将L-天冬氨酸螯合钙配成0.5%的溶液,然后用浓盐酸和浓氢氧化钠溶液迅速将溶液pH调至2.0~8.0,静置2 h后,用火焰原子吸收分光光度法测定游离钙离子含量,每组样品平行测定3次。螯合物的酸碱稳定性用钙保留率表示。
1.2.9.3 L-天冬氨酸螯合钙的模拟胃肠消化稳定性分析 将L-天冬氨酸螯合钙配成0.5%的溶液,先经胃蛋白酶酶解1 h(pH=2.0, 37 ℃,加酶量为2 000 U/g),再经胰蛋白酶酶解1 h(pH=8.0, 37 ℃,加酶量为2 000 U/g),酶解后100 ℃灭酶10 min,冷却至室温后用火焰原子吸收分光光度法测定游离钙含量,每组样品平行测定3次。螯合物的模拟消化稳定性用钙保留率表示。
1.3 数据处理与分析
实验结果采用SPSS进行显著性分析,以P< 0.05表示差异显著。利用Origin 2018软件作图。红外光谱数据采用OMNIC处理和分析,XRD数据采用MDIJade6.0软件进行处理和分析。所有处理均设置3次重复,以(平均值±标准差)表示。
2 结果与讨论
2.1 L-天冬氨酸螯合钙的定性检验
采用试验中的检测方法,未检测到螯合物中游离的钙离子和氨基酸。之后加入过量硫化钠后有大量白色沉淀产生,表明样品中有大量的钙元素;再加入茚三酮,将其置于电炉上加热一段时间后发现,溶液由黄绿色变为蓝紫色,证明螯合钙样品中氨基酸的存在。这一结果与刘闪等[9]的研究结果一致。
2.2 L-天冬氨酸螯合钙的表面结构分析
采用扫描电子显微镜对L-天冬氨酸螯合钙进行表面结构表征,分别将样品放大200和1 200倍,扫描结果见图1。
从图1(a)中可以看出,螯合物在放大200倍视野下,颗粒整体分布较为均匀,呈现团块聚集状,有细小颗粒附着其上。这种聚集状可能是牡蛎壳中的钙与L-天冬氨酸中的氨基氮原子和羧基氧原子相互作用,多个氨基酸之间通过钙离子交联相接,形成较大的颗粒,且颗粒间可能相互吸引从而形成聚集[20]。图1(b)中显示,螯合钙的表面粗糙,而且有较多白色晶体吸附,这可能是一些钙结晶。付文雯[21]观察了牛骨胶原多肽螯合钙的扫描电镜图片,也发现了表面“镶嵌”的白色晶体,因而推测在L-天冬氨酸和壳粉中钙的螯合反应过程中,还可能存在一定的吸附作用。

((a)螯合钙, 放大200×; (b) 螯合钙, 放大1 200×。(a)Chelated calcium, 200×; (b) Chelated calcium, 1200×.)
2.3 L-天冬氨酸螯合钙的红外光谱分析
L-天冬氨酸和L-天冬氨酸螯合钙的傅里叶红外光谱测定结果见图2。对比L-天冬氨酸的红外光谱图,可以发现L-天冬氨酸与牡蛎壳粉经水浴螯合后,整体光谱波形出现了明显的移动。在特征区,氨基的不对称伸缩振动引起的3 031.07 cm-1处的宽吸收峰蓝移至3 142.92 cm-1,说明L-天冬氨酸中的N-H键发生化学变化;同样地,在指纹区,羰基的不对称伸缩振动引起的吸收峰1 515.29 cm-1红移至1 397.66 cm-1,这可能是由于L-天冬氨酸的氨基氮和羧基氧参与了配位反应,形成螯合物的结果[22]。另外,L-天冬氨酸在2 085.64 cm-1左右有一个吸收峰,但是螯合之后,在L-天冬氨酸螯合钙的红外光谱图中该峰消失了,这一结果与王青等[23]报道相符,也与日本特许公报中介绍的α-氨基酸在2 100 cm-1处有一特征峰, 络合后该峰就消失的研究结果相一致[24], 进一步表明了螯合钙的生成。而且,螯合钙谱图在1 603.52 cm-1处有一明显的强吸收峰,说明L-天冬氨酸的氨基与壳粉中的钙发生了较强的螯合作用,有力地证明了氨基酸螯合钙的存在。这一结果与Nara等[25]的研究结果相似。
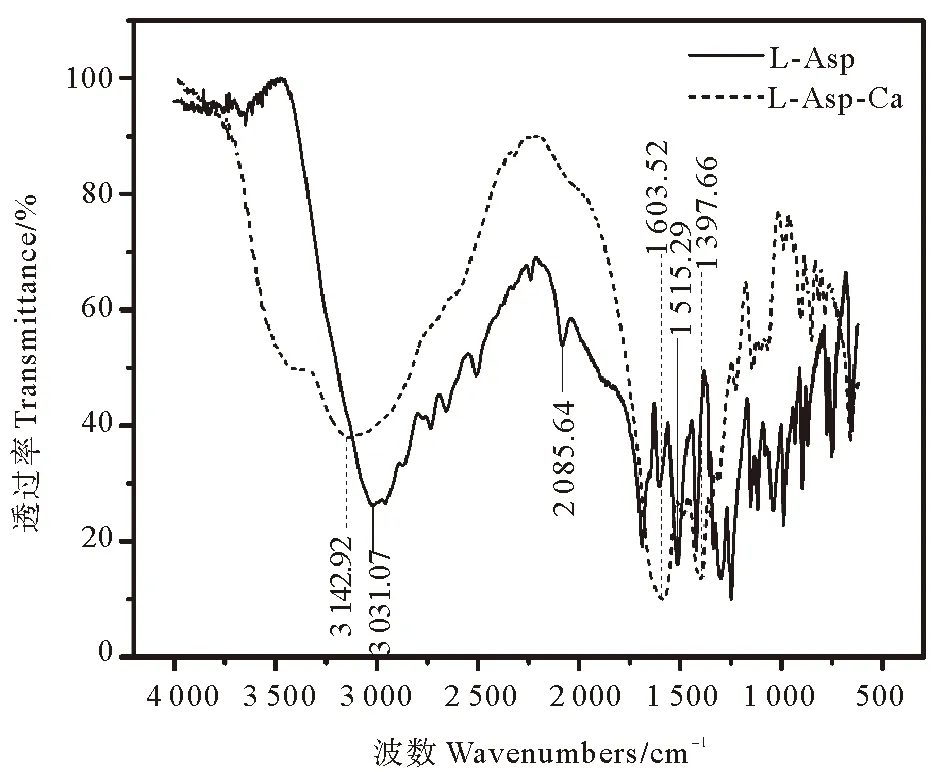
图2 L-天冬氨酸和L-天冬氨酸螯合钙的红外光谱图Fig.2 FT-IR spectra of L-Asp and L-Asp chelated calcium
2.4 L-天冬氨酸螯合钙的一二级质谱分析
电喷雾质谱(ESI-MS)技术具有样品用量少,检测时间短,灵敏度和精确度高等优点,是目前研究金属离子结合位点的有效手段之一[14]。图3为以牡蛎壳为钙源的L-天冬氨酸螯合钙一级质谱图,从图3中可以得到m/z为100~1 000的离子分布情况。从图3中可以看出,其他离子峰的响应信号都较弱,信号较强的母离子m/z为342.9,为单一化合物,这与王晓萍研究报道的小麦胚芽蛋白源锌螯合肽的电喷雾质谱结果类似[26]。所合成的螯合钙主要分子量可能为342.9,结合GB29226—2012可知,天门冬氨酸钙的m/z理论值为304.2,样品螯合钙中最高响应峰为342.9,这可能是由于在正离子模式下,螯合钙与系统中的K离子结合形成[M+K]+为343.2(342.9±0.5)的响应峰,且该峰响应值较高,表明所制备的L-天冬氨酸螯合钙较纯,符合GB29226—2012中天门冬氨酸钙的结合方式,即两个天冬氨酸与一个钙配位。
以牡蛎壳为钙源的L-天冬氨酸螯合钙二级质谱如图4所示,图4是选择图3中m/z为342.9(误差±0.5)的母离子进行归一化能量19%的碎片结果。其中蓝色标记处的342.8为碎片后所选母离子峰的低丰度质荷比,而图4中m/z为276.4的子离子峰响应值最高,相比于母离子其相对分子量丢失了66.5,推测可能是螯合物结构中一些侧链基团被破碎的结果。Zhao等[27]研究报道了纯化肽(Phe-Asp)中的氨基和羧基可以与钙螯合形成共用电子对的情况。
2.5 L-天冬氨酸螯合钙的XRD分析
L-天冬氨酸、牡蛎壳粉和L-天冬氨酸螯合钙的X-射线衍射谱图如图5所示。从谱图中可以看出,L-天冬氨酸与牡蛎壳粉形成螯合钙后,原料中主要吸收峰发生了显著变化,晶面间距(d)和相对强度(I/I0)改变。螯合前,L-天冬氨酸的结晶度非常高,主强峰2θ=23.72°,I/I0=100%,晶面间距d=3.74,两个次强峰2θ分别为11.80°和35.92°,I/I0分别是34.1%和25.9%,晶面间距d=7.49和5.86。牡蛎壳粉在2θ为29.58°和47.70°也显示出其特有的方解石特征峰,I/I0分别为100%和22.2%。然而,在生成的螯合钙中却未发现特征衍射峰,只是在2θ=33.90°处有一个较宽的弥散区域,无结晶特性,即该螯合钙为非晶态物质。何昇鸿等[28]研究发现壳寡糖与铜离子生成的铜螯合物也呈非晶态,其反应物谱图中的强峰在螯合物中完全消失,表明了螯合物的形成。
2.6 L-天冬氨酸螯合钙的DSC分析
通过比较螯合反应前后的DSC曲线图,观察熔融峰或其他热转变峰形、峰面积等的变化,可定性判断有无化学反应或其他相互作用的发生[29-30]。图6所示L-天冬氨酸和L-天冬氨酸螯合钙的DSC图。从图中可以看出,L-天冬氨酸和它的螯合钙在27.5 ℃有一个强放热峰。随着温度的升高,L-天冬氨酸在约31 ℃处出现拐点,吸热速率趋向平缓,在图中所示的温度范围内尚未达到其变性温度,这与其熔点为230 ℃相符合。同样地,其螯合钙在31 ℃左右也出现拐点,吸热速率减慢,但在约135 ℃时出现了一个宽的吸热峰,这个温度点可能即L-天冬氨酸螯合钙的变性温度。

图4 L-天冬氨酸螯合钙的二级质谱图Fig.4 MS/MS spectrum of L-Asp chelated calcium
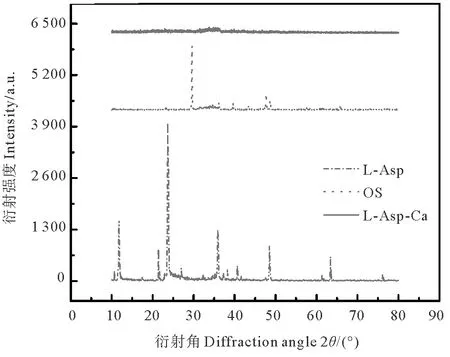
图5 L-天冬氨酸、牡蛎壳粉和L-天冬氨酸螯合钙的X射线衍射图Fig.5 X-ray diffractograms of L-Asp, oyster shell powder and L-Asp chelated calcium
2.7 L-天冬氨酸螯合钙的TG分析
热重分析是通过程序控制一定温度条件,测量物质的质量随温度变化关系的技术,失重速率最大值与TG曲线的失重拐点相对应[31]。L-天冬氨酸和L-天冬氨酸螯合钙的热重曲线如图7所示。随着温度的不断上升,L-天冬氨酸在温度约260 ℃时出现拐点,质量开始迅速下降,L-天冬氨酸开始熔化,热重百分比77.7%,当温度达到390 ℃左右时,出现第二次峰形拐点,此时热重百分比为49.8%,在约790 ℃时,其质量分数降至最低,趋于定值,失重78.1%,即灰分21.9%。

图6 L-天冬氨酸及其螯合钙的差示扫描量热曲线Fig.6 Differential thermal curves of L-Asp and its chelated calcium
对于L-天冬氨酸螯合钙来说,在温度约135 ℃时开始出现质量损失,失重3.2%,这一结果与图6中的螯合钙在135 ℃附近开始变性的结果相对应。此外,与L-天冬氨酸的热重曲线相一致的是,螯合钙在260 ℃附近也有强烈的质量损失,样品开始熔化,此时的热重百分比84.2%,随后在约412和770 ℃处有较快的分解现象。这与管海跃所报道的甘氨酸锌螯合物在温度约295 ℃时开始熔化,随后发生分解相似[16]。但L-天冬氨酸螯合钙在800 ℃左右尚未完全分解,其热重百分比为37.1%,表明螯合后的热稳定性得到了一定程度的提高。
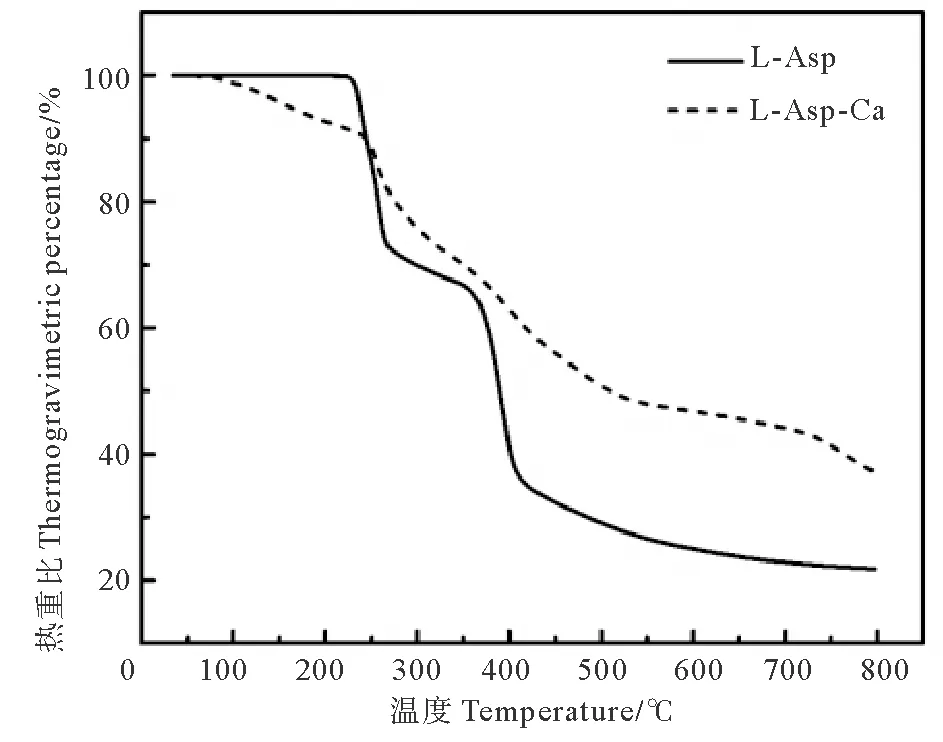
图7 L-天冬氨酸及其螯合钙的热重曲线Fig.7 TG curves of L-Asp and its chelated calcium
2.8 L-天冬氨酸螯合钙的稳定性分析
2.8.1 L-天冬氨酸螯合钙的热稳定性分析 热处理是一种常用于食品的加工方式,研究L-天冬氨酸螯合钙在热处理过程中的稳定性对其在食品工业中的应用具有重要意义。由图8可知,随着加热温度的提高,不同温度下的钙保留率变化不大,与对照组(Control check,CK)相比无显著性差异(p>0.05),这表明所制备的L-天冬氨酸螯合钙具有良好的热稳定性,持钙能力不随温度的改变而发生显著变化。
2.8.2 L-天冬氨酸螯合钙的酸碱稳定性分析 L-天冬氨酸螯合钙的酸碱稳定性见图9。从图中可以看出,随着pH的增加,钙保留率先增加后降低,在pH=6左右达到最大值,钙保留率接近对照组,且与对照组无显著性差异。之后钙保留率显著降低,在pH=10时出现了絮状沉淀,可能是强碱性条件下氢氧根离子和钙离子形成了氢氧化钙沉淀,稳定系数大于螯合钙。而在酸性较强条件下,氢离子的大量存在与钙离子竞争性抢夺供电基团-NH2和-COOH,亦加速螯合钙的解离,这与单因素优化实验的结果相对应。而大多数食品的pH在5~8范围内,且螯合钙在该范围内的钙保留率均在90%以上,因此L-天冬氨酸螯合钙可考虑作为钙营养强化剂添加到大多数食品中。

图8 温度对L-天冬氨酸螯合钙钙保留率的影响Fig.8 The influence of temperature on L-Asp chelated calcium retention rate

(数据以均值±标准差表示,不同小写字母表示差异有统计学意义(p < 0.05,单因素方差分析结合HSD进行事后检验)。Data were expressed as means ± standard deviations, with different lowercase letters marking significant differences (p < 0.05, one-way analysis of variance (ANOVA) followed by Turkey’s Honest Significant Difference (HSD) test).)
2.8.3 L-天冬氨酸螯合钙的模拟胃肠消化稳定性分析 L-天冬氨酸螯合钙受消化酶作用的影响见图10。实验结果表明,螯合钙由胃蛋白酶模拟消化1 h后,钙保留率显著下降了近29%。之后,再经过胰蛋白酶处理1 h的钙保留率恢复至87.6%,表明L-天冬氨酸螯合钙具有一定的抗消化性。在模拟消化过程中,虽然钙保留率有显著下降,但是总体都高于70%,显示其抗消化特性良好,且经过胃蛋白酶、胰蛋白酶共同作用后,仍保留了消化酶作用前的87.6%的持钙能力。

(数据以均值±标准差表示,不同小写字母表示差异有统计学意义(p < 0.05,单因素方差分析结合HSD进行事后检验)。Data were expressed as means ± standard deviations, with different lowercase letters marking significant differences (p < 0.05, one-way analysis of variance (ANOVA) followed by Turkey’s Honest Significant Difference (HSD) test).)
3 结语
本文通过扫描电镜、红外光谱和质谱等技术对L-天冬氨酸螯合钙进行了结构表征,并研究了其物理化学特性。研究结果表明,螯合钙的微观形态整体呈团块状,结构较紧密。L-天冬氨酸中的氨基和羧基主要以配位结合形式参与了螯合反应。所制备的螯合钙主要分子量响应峰值342.9,其结构符合GB29226—2012中天门冬氨酸钙的结合方式。此外,理化特性研究表明,该螯合钙为非晶态物质,具有良好的热稳定性、酸碱稳定性,且在模拟胃肠消化过程后仍能保留87.6%的持钙能力。
本文的研究结果完善了目前对牡蛎壳源L-天冬氨酸螯合钙的结构及理化特性的研究,为牡蛎壳废弃物的高值化利用及新型钙营养强化剂L-天冬氨酸螯合钙的生产、应用研究提供了理论依据,今后将进一步研究牡蛎壳源L-天冬氨酸螯合钙对缺钙大鼠骨密度和生物可利用性等方面的影响。
