苦参碱对大鼠肝缺血再灌注损伤后肝功能及MAPK通路的影响
2020-10-29袁芳杨智承
袁芳,杨智承
(广东药科大学药学院,广东 广州 510006)
肝移植、肝切除术中,需分次、分段阻断肝脏血流,达到控制术中出血的目的,该过程会造成肝脏的缺血再灌注损伤(hepatic ischemic reperfusion injury ,HI/R)[1]。研究显示,HI/R可造成肝窦内细胞损伤,并诱导活性氧自由基,释放促炎症反应细胞因子,引发肝细胞坏死、诱导肝细胞凋亡,最终导致肝功能异常,是肝脏手术的常见死亡原因[1-2]。近年来研究显示,肝细胞凋亡在HI/R的病理过程中发挥重要作用[3]。
目前,针对肝缺血再灌注损伤,临床以对症支持治疗为主,仍缺乏有效措施,亟待寻求预防HI/R的有效手段。国内外多项研究显示,中药单体苦参碱(matrine,MT)有抗氧化、抗炎和护肝等作用[4-5],对于缺血再灌注有保护作用[6-8],但MT对于肝缺血再灌注的作用和机制仍需进一步阐明。本研究在建立大鼠HI/R模型[9]的基础上观察 MT对HI/R的作用并探讨相关机制。
1 材料与方法
1.1 药物与试剂
苦参碱(质量分数≥99%) 购于中国药品生物制品检定所,生产批号:110805-201509;BCA蛋白浓度检测试剂和NE-PERTM细胞核和胞浆提取试剂盒均购于Pierce Biolab 公司;MAPK家族一抗:ERK1/2、p38、JNK、MKK7抗体及内参GAPDH购于Cell Sigaling Technology公司;TUNEL染色试剂盒由美国Promega公司生产;丙二醛(MDA)和超氧化物歧化酶(SOD)试剂盒购于南京建成生物工程公司。
1.2 仪器与设备
Hitachi7180临床分析仪、5810冷冻离心机(Eppendorf);OlympusCKX41倒置显微镜(奥林巴斯);-80 ℃超低温冰箱(Thermo Scientific);免疫印迹系统(BioRad);680XHR凝胶成像系统(GBOX)。
1.3 实验动物
清洁级SD雄性大鼠,体质量200~250 g,购于南方医科大学实验动物中心,生产许可证号: SCXK(粤)2019-0005。
1.4 分组与给药
健康成年雄性SD大鼠24只,随机分为4组,每组6只:(1)肝缺血再灌注组(I/R组):连续7 d腹腔注射含1%吐温80生理盐水;(2)苦参碱(MT组):给药剂量分别为20、40 mg/kg,溶解于含1%吐温80生理盐水,连续7 d腹腔注射。该剂量由临床常用苦参碱剂量折算[10- 11],并通过预实验确定给药天数。(3)假手术组(Sham组):连续7 d腹腔注射含1%吐温80的生理盐水。
1.5 模型建立
大鼠术前禁食12 h,自由饮水。I/R组和MT组分别给予溶媒和苦参碱30 min后,经腹腔注射4%(φ)戊巴比妥钠(40 mg/kg)麻醉,固定,常规消毒。取上腹正中切口入腹,用无创血管夹阻断肝门静脉和肝动脉,造成约70%肝脏缺血。1 h后去除血管夹,恢复缺血肝的血流,缝合腹腔,继续再灌注4 h,取左叶肝脏组织标本和下腔静脉血待测;Sham组给予同体积生理盐水溶媒腹腔注射30 min后,开腹及暴露肝蒂处理后,关腹,不阻断肝血流,然后缝合腹腔,4 h后同上取样本待测[9]。
1.6 标本处理
所有血浆样本,常温离心15 000 r/min×15 min,取上清-80 ℃冻存。肝组织用PBS清洗后,冻存于液氮中,待测。检测时,解冻肝组织,称重,用1∶10(v∶v)的冰浴PBS匀浆,4 ℃,14 000×g离心15 min。分离上清,分别测定酶活性和蛋白定量。肝组织10%(φ)甲醛固定,石蜡包埋制成蜡块备用。将包埋肝组织蜡块进行修块、脱水、包埋、切片等处理后,按照说明,分别进行HE染色和TUNEL染色。另取5 g肝组织,破碎离心后,用于Western blot检测。
1.7 谷丙转氨酶(ALT)、谷草转氨酶(AST)、MDA和SOD的检测
血清ALT、AST用Hitachi7180临床分析仪进行检测。按照说明书,利用酶比色法试剂盒测定组织中MDA、SOD的含量。
1.8 组织病理学检测
HE染色后,在光学显微镜下进行肝组织的病理形态学观察。
1.9 TUNEL法检测肝细胞凋亡
每个切片随机选取10个阳性视野,以细胞内出现棕色颗粒者为凋亡细胞,计算每张切片中的凋亡细胞数目。
1.10 Western blot检测
肝脏组织在冰上用含有10 mmoL/L Tris (pH 7.5),1.5 mmoL/L MgCl2,10 mmoL/L KCl 和0.1% Trition X-100的缓冲液中混悬、匀浆裂解,12 000 r/min,4 ℃离心15 min,取上清收集总蛋白。5×上样缓冲液混合煮沸5 min。垂直板电泳分离条带,转膜,分别加入GADD45Β、MMK7、MAPK家族蛋白ERK1/2、磷酸化ERK1/2、磷酸化p38、p38、磷酸化JNK和JNK一抗(1∶1 000)4 ℃孵育过夜,洗膜后用辣根过氧化物酶(HRP)标记的二抗(1∶2 000,HRP标记)孵育2 h,利用化学发光仪器曝光,采集目标蛋白条带。Western blot图像灰度值采用Quantity One2.4软件分析。
1.11 统计学处理
采用SPSS18.0软件处理数据,各组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组血浆ALT、AST和组织中MDA、SOD的比较
血清学检测结果提示:与假手术组比较,I/R组血清ALT、AST水平均显著升高(P<0.01);MT(20、40 mg/kg)组血清ALT、AST水平与I/R组比较显著降低(P<0.01),且高剂量组的降低程度较低剂量组更显著(见表1 )。
与假手术组比较,I/R组组织中MDA、SOD含量均显著增加(P<0.01); MT(20、40 mg/kg)组组织中MDA与I/R组比较显著降低、SOD含量增高(P<0.01或P<0.05)(见表1)。
2.2 各组肝组织病理学变化
HE染色肝组织,显微镜下可见:Sham组肝索排列规则,肝窦不扩张,仅少量炎性细胞浸润。I/R组肝组织肿胀、肝窦扩张,肝细胞空泡变性和点状坏死,周围有大量红细胞和炎性细胞浸润,伴有空泡变性和点状坏死。 MT 20、40 mg/kg组肝细胞结构清楚,肝细胞肿胀程度和炎性细胞浸润情况,均较I/R组有所减轻(见图1)。
2.3 TUNEL检测各组肝细胞凋亡情况
TNUEL检测结果显示,I/R组、MT 20、40 mg/kg组均有一定数量的TUNEL阳性细胞。较之I/R组,MT 40 mg/kg组降低明显(P<0.01),见图2。
2.4 Western blot结果
2.4.1 各组ERK1/2、p-ERK1/2、JNK、p-JNK、p38和p-p38的表达情况 与Sham组比较, I/R组和MT组的p-JNK和p-p38蛋白表达显著增加 (P<0.01);与I/R组比较,MT 20、40 mg/kg组p-JNK、p-p38表达显著降低(P<0.05),对于p-ERK1/2则无明显影响,见图3。
2.4.2 各组MKK7的表达情况 Sham组仅有少量MKK7表达;与Sham组比较,I/R组MKK7的表达显著升高(P<0.01),MT组可以显著降低MKK7表达(P<0.05),见图4。
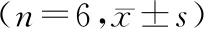
表1 各组ALT、AST、MDA和SOD水平比较Table 1 Comparison of the levels of ALT,ALT,MDA and SOD in each group

A. Sham 组; B. I/R组; C.MT 20 mg/kg组;D. MT 40 mg/kg组。
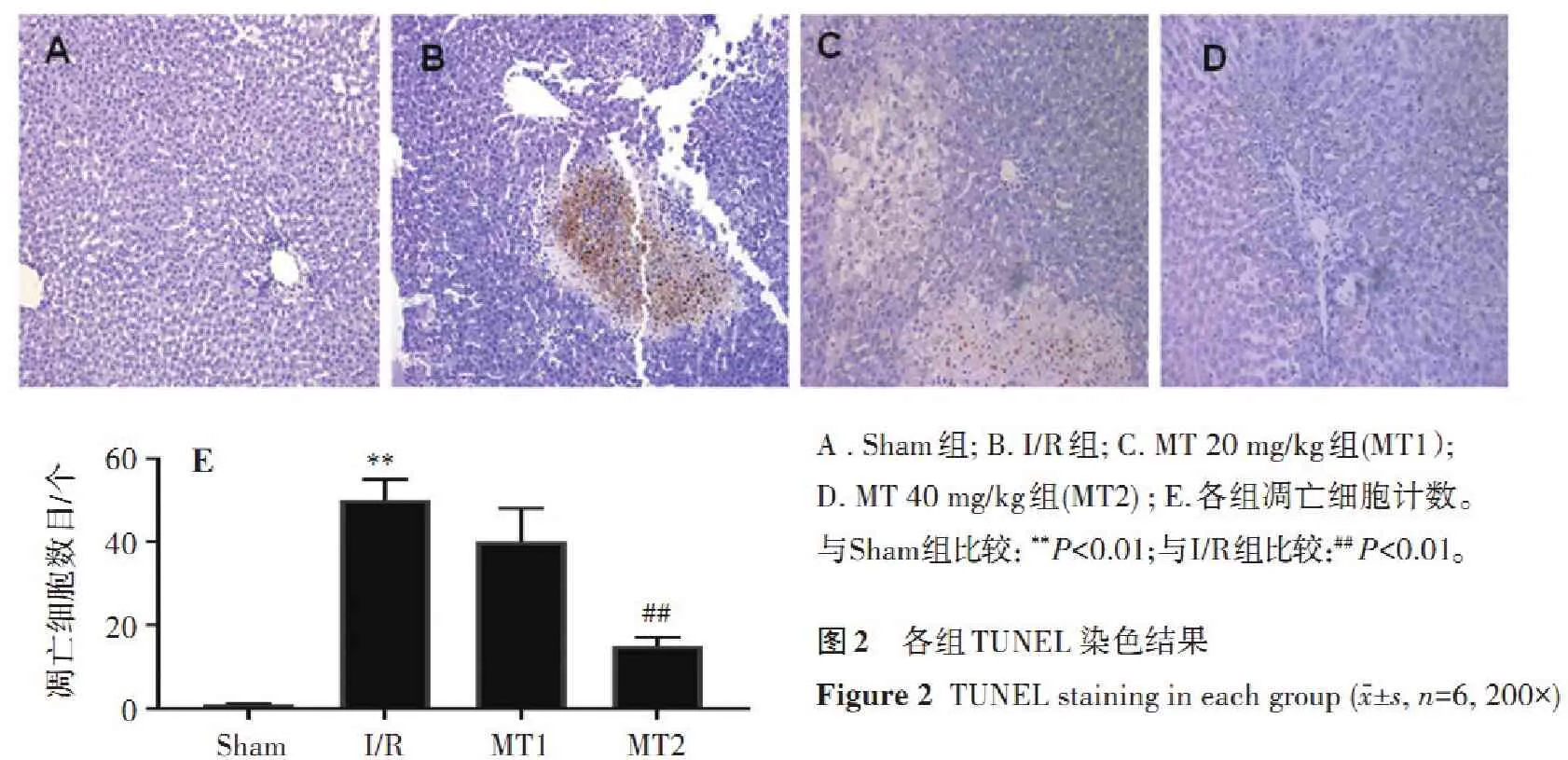
p-ERK1/2ERK1/2p-JNKJNKp-p38p381234p-ERK1/2p-JNKp-p38543210****####1234AB蛋白相对表达量
3 讨论
中药单体苦参碱具有抗氧化[12]、抗炎、抗代谢等一系列作用[7,13],有报道苦参碱术前单次静脉注射,可以通过TRAIL/BAX途径抑制大鼠肝缺血-再灌注损伤后的肝细胞凋亡[13]。但报道多为一次性术前预防给药,与临床治疗模式不符,且苦参碱对于凋亡的作用机制仍有待进一步阐明。因此本研究在建立大鼠HI/R模型的基础上,将临床常用苦参碱剂量折算成动物给药剂量[10-11],大鼠连续7 d给予苦参碱(20、40 mg/kg)腹腔注射后,实施肝缺血再灌注术,术后立即采样,保存标本。肝功能各项指标显示:苦参碱组AST和ALT的含量,肝组织中脂质过氧化反应产物MDA含量明显低于肝缺血再灌注组(P<0.01),肝组织中的抗氧化酶SOD含量,则高于肝缺血再灌注组(P<0.01)。病理学检查发现,肝缺血再灌注组的肝组织标本可见大量炎性细胞浸润,肝窦扩张,肝细胞空泡变性并有多处坏死灶;苦参碱高剂量组的肝小叶结构基本正常,肝细胞坏死、炎症细胞浸润均较肝缺血再灌注组明显减少;苦参碱低剂量组的肝组织损伤也较肝缺血再灌注组轻。结果提示苦参碱连续给药预处理,有助于缓解肝缺血再灌注损伤,具有护肝作用。
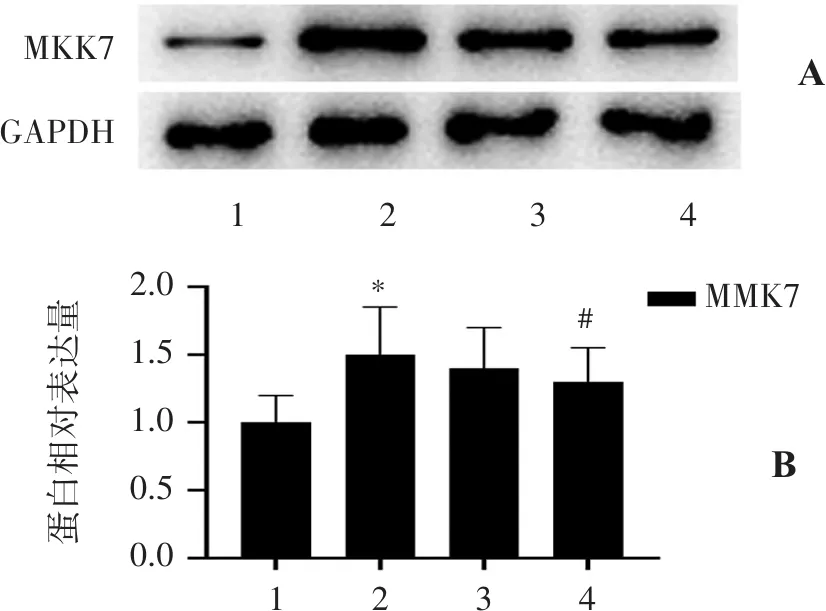
蛋白相对表达量1234AB2.01.51.00.50.0MMK71234MKK7GAPDH#*
本研究同时检测了各组肝细胞的凋亡情况,结果显示,苦参碱高剂量组能够明显减少缺血再灌注后的肝细胞凋亡,低剂量组对凋亡也有改善趋势。
多项研究均显示,在肝缺血再灌注损伤引发的肝坏死、术后死亡等一系列问题中,诱导肝细胞凋亡发挥着至关重要的作用[2],而丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在调控肝细胞凋亡的作用已被诸多研究证实[1,14-15]。MAPK是一组能被不同的细胞外刺激如:细胞因子、神经递质、激素等激活的丝氨酸、苏氨酸蛋白激酶,包括ERK、JNK、p38 MAPK和ERK5四个亚族[16],其中p38和C-Jun 氨基末端激酶(c-JunN-terminal kinase,JNK)通路的磷酸化激活和细胞凋亡与应激时的多种病理生理过程有关[17-18]。
为探讨苦参碱发挥肝缺血再灌注保护作用的机制,进一步研究了苦参碱预处理对于肝缺血再灌注肝组织中MAPK通路的JNK、p38和ERK表达的影响。研究显示,苦参碱预处理可显著降低肝缺血再灌注肝组织中磷酸化JNK、p38表达,且对磷酸化JNK的表达影响最为显著。JNK在多种组织中均有表达,能被MAPK激酶MKK7特异性激活[18-19]。反之,抑制MKK7的特异位点,可以最终达到抑制JNK磷酸化,发挥抗凋亡的作用[20]。本研究进一步观察了苦参碱预处理对于调控JNK磷酸化的MKK7表达,结果显示,苦参碱预处理可以显著降低JNK的调控激酶MKK7的表达,因此苦参碱抗肝缺血再灌注的机制可能与抑制MKK7表达,降低JNK磷酸化有关。
综上所述,苦参碱预处理对大鼠肝缺血再灌注损伤有一定的保护作用,其可能机制与抑制MAPK通路的MKK7/JNK磷酸化以及p38磷酸化,发挥抗肝细胞凋亡作用有关,对于苦参碱预防肝缺血再灌注损伤的临床意义有待进一步研究,其相关信号通路的上游调控机制也有待进一步明确。
