亮菌多糖的理化性质及生物活性研究①
2020-10-29蔡晶晶宋小平王雅洁
蔡晶晶,宋小平,王雅洁,王 蔷
(安徽医学高等专科学校药学系,安徽 合肥 230601)
0 引 言
亮菌(Armillariellatabescens)也叫青杠菌、假蜜环菌,属于口蘑科,假蜜环菌属,营养丰富,是一种稀有、昂贵的野生食用真菌,在国内广泛分布。同时亮菌具有一定的药用价值,主要用于胃炎、胆管炎、胆囊炎等的治疗[1]。亮菌中大分子物质有良好的生物活性,其中亮菌多糖被认为具有提高免疫、抗氧化、抗衰老、预防心脑血管疾病等功效[1]。亮菌糖肽提取物制剂能够有效抑制慢性萎缩性胃炎黏膜腺体的萎缩[2],逆转胃癌前病变[3]、调节肠道免疫应答、促进动物幼崽正常肠道菌群的建立[4],逆转酒精导致的肝损伤,促进核酸、蛋白质的生物合成和组织损伤修复等功效[5]。但亮菌多糖为极性大分子复合物,结构不均一,国内外对其构效关系等机制研究也十分有限[6-7]。
1 仪器与试剂
1)仪器:凝胶色谱仪(ELEOS System,Wyatt);液相色谱仪(Agilent 1200);紫外可见分光光度计(UV-1100,上海美谱达仪器有限公司);酶标分析仪(DNM-9602,北京普朗新技术有限公司);CO2恒温培养箱(Thermo Forma 3111)。
2)试剂:亮菌固体发酵物由合肥诚志生物制药有限公司提供。RPMI-1640(Hyclone公司)、青链霉素混合液(100 X)(Solarbio公司)、0.25% 胰蛋白酶-EDTA消化液(Solarbio公司)、DMSO(Amresco公司)、胎牛血清(GIBCO公司);MTT、单糖标准品等均为sigma公司产品;乙腈为色谱纯;其他试剂均为国产分析纯。
2 实验方法
2.1 亮菌多糖提取及分级沉淀方法
依据文献[8]方法提取亮菌粗多糖(ATP-ALL)。然后加入无水乙醇至粗多糖溶液体积的20%,边加边搅拌均匀,4 ℃静置沉淀4 h后,5000 g离心5 min,取沉淀,冷冻干燥后记为ATP-20组分;上清中加无水乙醇至糖溶液体积的40%,静置沉淀约12 h后,5000 g离心5 min,取沉淀,冷冻干燥后记为ATP-40组分;上清中加无水乙醇至糖溶液体积的60%,其余操作同ATP-40组分,得ATP-60组分;上清中加无水乙醇至多糖溶液体积的80%,其余操作同ATP-40组分,得ATP-80组分。称重并计算得率。
2.2 单糖组成分析
采用1-苯基-3-甲基-吡唑啉酮柱前衍生高效液相色谱法(PMP-HPLC)法测定ATP-20、ATP-40、ATP-60、ATP-80的单糖组成[8],方法如下:
以葡萄糖等十种单糖的混合对照品溶液同法处理做对照。精密称定适量亮菌多糖冻干粉置100 mL锥形瓶中,加入1.0 mL的4 mol/L的三氟乙酸溶液,120 ℃水解2 h。70 ℃水浴,氮气吹干。再加入0.5 mol/L的PMP甲醇溶液和0.3 mol/L的NaOH溶液各0.5 mL,充分混匀后,于水浴70 ℃中反应30 min。冷却至室温后,加入0.3 mol/L HCl 0.5 mL中和。再加入1 mL氯仿充分振荡萃取,去除氯仿层,共萃取三次。水层用0.22μm滤膜过滤,待测。
色谱分析条件:Agilent 1200液相色谱仪,Thermo C18色谱柱;流动相为0.1 mol/L pH 7.0磷酸盐缓冲溶液:乙腈=82:18(v/v);流速为1 mL/min;柱温25 ℃;检测波长为245 nm。
2.3 纯度及分子量测定
采用高效排阻色谱与多角度激光散射仪及示差检测串联(HPSEC-MALLS-RID)法测定各组分的分子量[9]。该法测定多糖分子量,因MALLS为分子量响应型检测器,无需标准品做标准曲线可直接获得多糖的绝对分子量。
称取5 mg样品溶解在水中制成2 mg/mL溶液,4000 g离心5 min取上清,经过0.22 μm水相滤膜过滤后进行分析。
色谱分析条件:Waters515泵;色谱柱OHpak SB-806HQ,流动相为含0.02%叠氮化钠的超纯水,流速1mL/min,柱温40 ℃,运行Astra 5.3.4分析软件进行数据采集和分析。
2.4 抗氧化实验
参考文献[10]方法测定亮菌多糖羟基自由基清除作用。配制不同浓度的多糖样品,各浓度均做3支平行样品管。依次加入9 mmol/L FeSO4溶液0.5 mL,9 mmol/L乙醇-水杨酸溶液0.5 mL,上述多糖溶液0.5 mL,去离子水3.5 mL,10mmol/L双氧水1 mL。以等体积水代替多糖样品做空白管,以等体积水代替乙醇-水杨酸溶液做对照管。各管摇匀,37 ℃水浴加热15 min后取出,测510 nm处的吸光值,以蒸馏水管调零。
·OH自由基清除率=1-[(A样品-A对照)/A空白]
2.5 体外对脾淋巴细胞增殖作用实验
分别称取各个样品5 mg,溶解于适量的培养液中,经0.22 μm的水相微孔滤膜过滤除菌。使用前分别取适量的样品溶液用培养液稀释成高、中、低浓度的工作液,分别为2.5、0.5、0.1 mg/mL。
依据文献方法[11]制备小鼠脾脏淋巴细胞,置于37 ℃,5% CO2的培养箱中进行培养。将处于对数生长期的细胞经胰蛋白酶消化,镜检计数后制成5×106个细胞/mL的细胞悬液。设置组别如下:空白组只加培养液200 μL/孔;阴性对照组加细胞液100 μL与培养液100 μL;样品组中每个样品高、中、低浓度分别单独加样20 μL(细胞液100 μL+样品20 μL,培养基补充至200 μL)。各组均设3个复孔。混匀后放入培养箱5% CO237 ℃孵育48 h。每孔加入20 μL的MTT染色液(5 mg/mL),5% CO2,37 ℃反应4 h后,除上清液,加入100 μL的DMSO充分振荡,避光放置10-15 min直至蓝色颗粒充分溶解,酶标仪570 nm处检测。刺激指数为实验组OD值与阴性对照组OD值的比值。
3 结果与分析
3.1 亮菌多糖各醇沉组分的得率
根据冷冻干燥后的重量计算,ATP-20、ATP-40、ATP-60、ATP-80的得率分别为16.98%、13.10%、10.29%、41.20%,以甘露糖为标准单糖,硫酸苯酚法[8]测定ATP-ALL,ATP-20、ATP-40、ATP-60、ATP-80组分的多糖纯度,结果分别为56.26%、63.90%、70.41%、66.47%、84.82%。数据表明,醇浓度为80%时沉淀下来的多糖所占比例最大,得率最高,多糖纯度最高。
3.2 分级沉淀各组分单糖组成分析
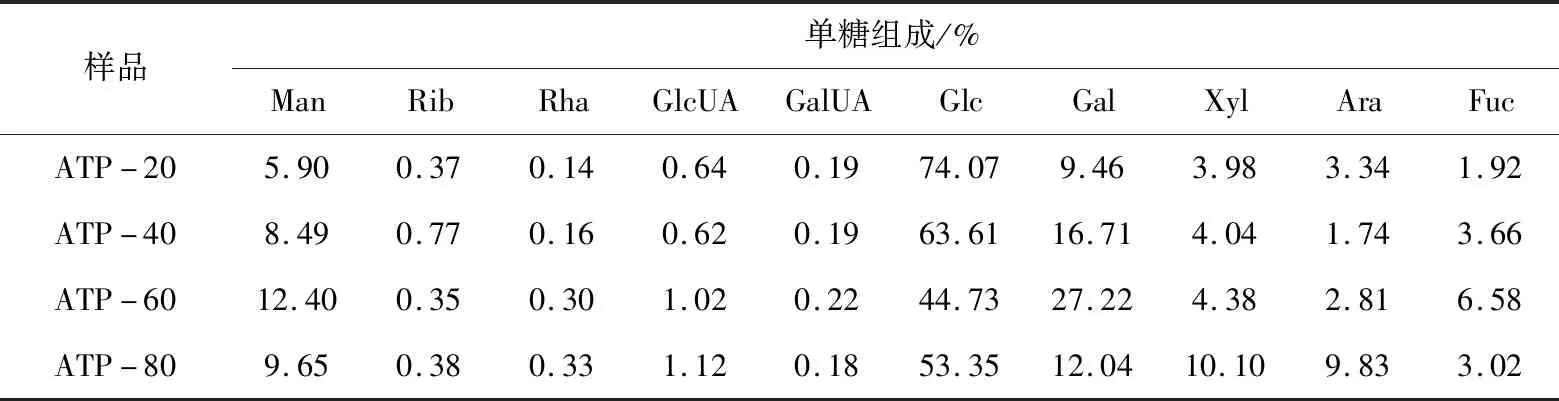
表1 亮菌多糖各醇沉组分的单糖组成
实验数据显示亮菌多糖单糖组成超过1%的有葡萄糖(Glc)、半乳糖(Gal)、甘露糖(Man)、木糖(Xyl)、阿拉伯糖(Ara)、岩藻糖(Fuc)、葡萄糖醛酸(GlcUA),此外还含有极少量的核糖(Rib)、鼠李糖(Rha)、半乳糖醛酸(GalUA)。ATP-20、ATP-40中葡萄糖的含量高,分别为74.07%、63.61%;ATP-60中葡萄糖含量(44.73%)降低,甘露糖、岩藻糖含量升高;而ATP-80组分中,木糖、阿拉伯糖含量显著增加,甘露糖、鼠李糖葡萄糖醛酸含量也较高。
3.3 各组分分子量及分子量分布测定结果
如图1所示,多角度激光散射仪(MALLS)与示差检测仪(RI)色谱峰的出峰时间与峰形均有一定的差异,这主要是因为MALLS为分子响应型检测器,而RI为浓度相应型检测器[13],在凝胶色谱中,大分子物质被优先洗脱出来,此时因为浓度较低,RI无响应,而MALLS对大分子灵敏,响应值高。
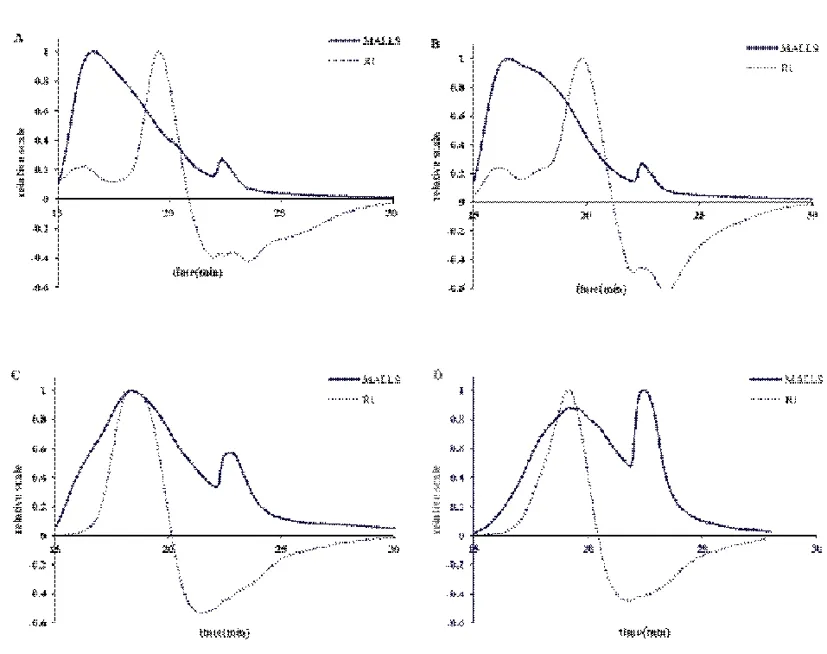
图1 多糖ATP-20(A)、ATP-40(B)、ATP-60(C)、ATP-80(D)的HPSEC-MALLS-RID色谱图
各个组分的重均分子量、数均分子量等数值见表2所示。
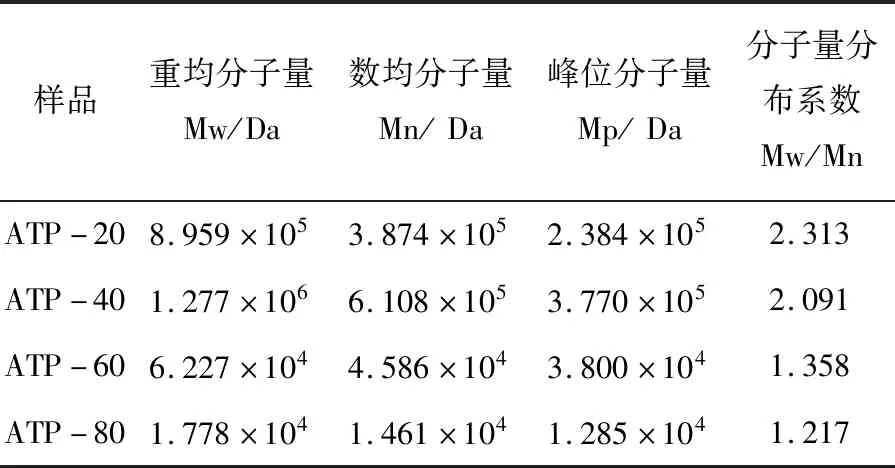
表2 ATP-20、ATP-40、ATP-60、ATP-80的分子量
如表2所示,除ATP-20外,其余几个组分随着沉淀时乙醇浓度的升高,所得多糖的重均分子量、数均分子量逐步降低,而分子量的分散指数Mw/Mn也逐步降低。但是ATP-20的重均分子量低于ATP-40,分析原因主要是因为ATP-20在热水中溶解度较其他组分低,经过微孔滤膜过滤处理后,有少部分大分子多糖损失。ATP-20、ATP-40两个组分的Mw/Mn都大于2,分子量分布比较宽,而ATP-60、ATP-80的Mw/Mn值分别为1.358、1.217,表明其分子量分布相对较窄,均一性良好。
3.4 羟基自由基清除率测定结果
羟基自由基(·OH)会破坏细胞膜,使蛋白变性,损伤基因的分子结构,对机体的危害很大。如图2所示,亮菌多糖分级沉淀各组分都对·OH自由基有清除作用,且呈现明显的剂量依赖关系。不同多糖组分对·OH自由基抑制率的大小依次为:ATP-ALL>ATP-80>ATP-20>ATP-40>ATP-60,其中ATP-80在5 mg/mL时,·OH自由基清除率为76.08%。
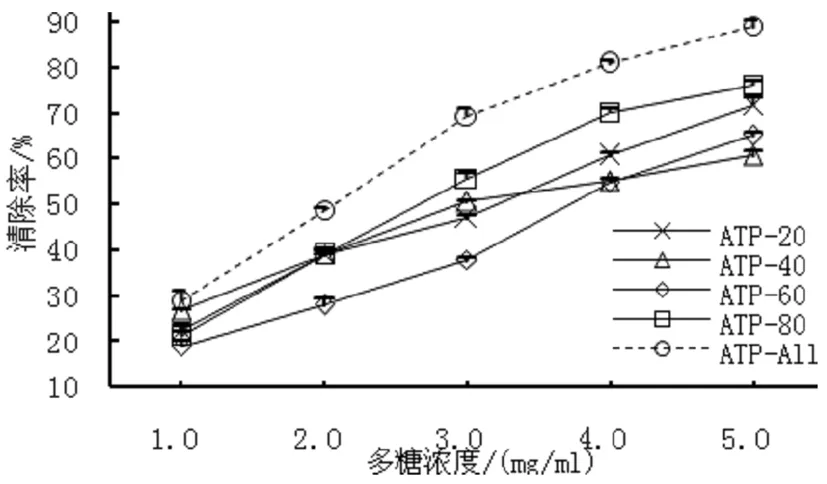
图2 羟基自由基清除率检测ATP-20、ATP-40、ATP-60、ATP-80的抗氧化活性
3.5 体外脾淋巴细胞增殖实验结果
如表3所示,亮菌多糖ATP-20、ATP-40、ATP-60、ATP-80对体外淋巴细胞的增殖均有一定的刺激作用,其中ATP-80在10 μg/mL~250 μg/mL范围内的促淋巴细胞增殖作用高于其他组分,在低浓度下仍然具有显著的促增殖活性(*p<0.05)。ATP-ALL活性最高,但在同等质量下,ATP-80组与ATP-ALL结果差异不显著,而其他几组较ATP-ALL均差异显著,提示活性的主要成分在ATP-80组分。
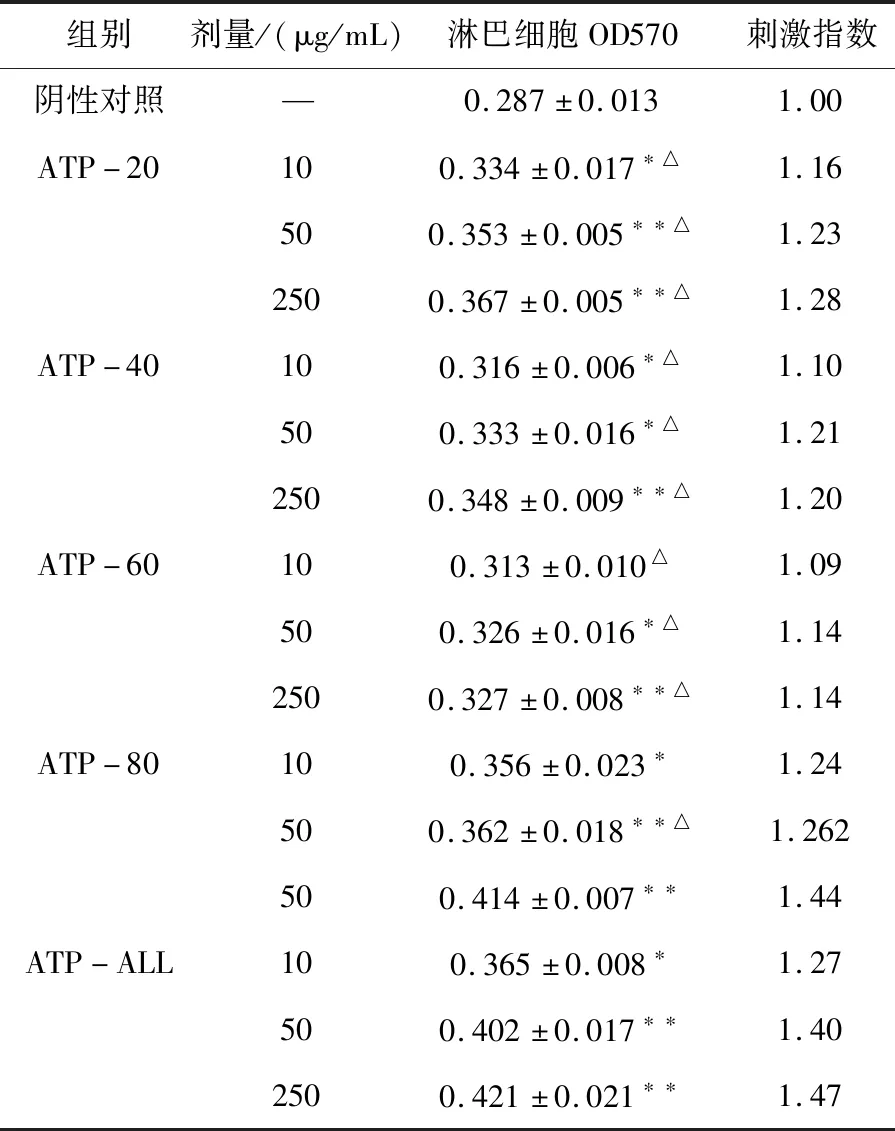
表3 ATP-20、ATP-40、ATP-60、ATP-80对小鼠脾淋巴细胞增殖的影响
4 结 语
(1)分级沉淀后的四个组分的相对分子质量是依次降低的,其中ATP-20、ATP-40分子量分布范围广,组成更复杂,而ATP-60、ATP-80相对较均一,且ATP-80的收率、纯度显著高于其他组分。不同组分之间单糖组成相似,均主要由葡萄糖、半乳糖、甘露糖、木糖、阿拉伯糖、岩藻糖、葡萄糖醛酸七种单糖构成,但组成比例有差异。单糖组成类别比已有资料[6-7]报道的更丰富,可能是检测技术的进步,及长时间固体发酵,有更丰富的代谢产物。大分子量多糖中主要成分是葡聚糖,而小分子量越小杂糖含量越高,尤其是木糖、阿拉伯糖等含量升高显著。推测这是小分子量多糖如ATP-80生物活性较高的原因之一。
(2)对于亮菌多糖抗氧化活性与免疫活性的研究,四种组分都具备·OH自由基清除活性,并呈明显的剂量依赖关系。分子量最小的ATP-80活性最高,在5 mg/mL时,·OH自由基清除率达76.08%。在体外免疫细胞增殖实验中,除ATP-60 的低剂量组外,其余样品都显著促进淋巴细胞的增殖,尤其以ATP-80活性高,与粗多糖ATP-ALL的活性无明显差异。因此认为ATP-80为亮菌多糖的活性主要组分。有报道称1~3万的枸杞多糖抗氧化活性最强[12],另外有研究表明分子量在1.5×104~4.4×104之间的小分子多糖生物活性最高[13],这与ATP-80的分子量范围吻合。在生物体内,分子量太大的不易进入细胞内发挥其活性功能,分子量过低的无法产生活性的聚合结构,适当分子量的多糖是维持其活性的基础。
综上所述,亮菌混合粗多糖的抗氧化与免疫活性均为最佳,优于各分级沉淀组分,体现出不同组分在抗氧化及免疫方面的协同活性大于单一组分。而ATP-80组分得率高,溶解度好,活性略低于粗多糖。由于其分子量相对均一,在样本制备、质量控制上有很大优势,结构也容易解析,适用于深入的亮菌糖生物学研究。
