大肠杆菌热敏肠毒素对仔猪病理及生理学指标的影响
2020-10-23鲁冠杰马维超
鲁冠杰,马维超,张 倩,2,穆 祥,胡 格
[1. 北京农学院动物科学技术学院 兽医学(中医药)北京市重点实验室,北京 昌平 102206;2. 中国农业大学动物医学院,北京 海淀 100193]
目前,仔猪腹泻在规模化养猪场甚至是养殖户中都很常见,其发病率很高,由腹泻引起的仔猪死亡数占仔猪死亡总数30%以上,对养殖业造成了严重的经济损失[1-2]。其中大肠杆菌是导致仔猪腹泻的最常见的原因[3],是全世界生猪生产经济上重要的疾病。产肠毒素大肠杆菌(EnterotoxigenicEscherichiacoli,ETEC)是引起仔猪水样腹泻最常见的病原体[4-5],仔猪腹泻通常与产肠毒素大肠杆菌的大量增殖产生肠毒素有关[6]。大肠杆菌肠毒素包括热敏肠毒素(Heat labile enterotoxin,LT)和耐热肠毒素(Heat stable enterotoxin,ST),其中大肠杆菌热敏肠毒素具有抗原性,是AB5细菌毒素家族的成员[6],在人类中,LT会导致类似霍乱的疾病,并伴有水样腹泻和胃痉挛。在动物中,LT阳性ETEC通常会产生F4菌毛和STb,其发病的特征是仔猪腹泻后的脱水甚至生长迟缓,表明这些毒力因子之间可能存在功能联系。猪环境中ETEC的存在是病原体传播的重要因素,因为这些细菌在受到粪肥保护后能够存活至少6个月[7-8]。本试验旨在利用产热敏肠毒素大肠杆菌和热敏肠毒素建立仔猪动物模型,并在模型基础上检测相关的生理生化指标和病理指标来探讨与其证候的关系。
1 材料与方法
1.1 主要试剂 苏木精-伊红(H.E.)染色试剂盒(批号为C0105),购自上海碧云天生物技术有限公司;4%多聚甲醛(批号为BL539A),购自西安风腾生物有限公司;注射用生理盐水(批号为HG/T3491-1999),购自四川科林药业股份有限公司;麦康凯培养基,由兽医学(中医药)北京市重点实验室配置保存;菌株:标准LT阳性菌株CVCC197,购自中国兽医药品监察所;LT蛋白:兽医学(中医药)北京市重点实验室保存,浓度为0.65 mg/mL[9]。
1.2 实验动物 长白猪12头,22日龄,雌、雄各半,购自北京久久丰实验动物基地。
1.3 试验方法
1.3.1 体重指标 对试验前、后记录的体重数据进行整理,计算平均日增重。
1.3.2 动物模型的建立 12头22日龄长白猪随机分为A组(空白对照组)、B组(细菌组)、C组(毒素组),每组4只,公母各半。适应性喂养3 d,饲养温度(20±2) ℃,饲喂乳猪配合饲料,自由取食,饮水。A组、B组分别灌胃给予生理盐水、细菌悬液,100 mL/只(108CFU/mL);C组腹腔注射给予LT,10 mL/只,LT浓度0.5 mg/mL。
1.3.3 动物模型生理生化指标的测定 试验前以及试验开始后的不同时期对各组进行前腔静脉采血,进行血常规和血液生化指标检测。
1.3.4 病理剖检 常规处死发病猪,打开腹腔后检查腹腔有无积液,各个脏器的位置有无典型性变化。如果有典型性病变,采集病变组织并进行固定切片,组织切片进行H.E.染色。
1.3.5 免疫组化检测组织中LT 将1.3.4中固定好的组织进行免疫组化试验检测其中LT的含量。

2 结果
2.1 平均日增重分析 对各组猪进行平均日增重分析,见表1。细菌组和毒素组平均日增重负增长明显,极显著低于对照组(P<0.01)。

表1 平均日增重Table 1 Average daily gain
2.2 血常规指标检测 经过血液常规分析:试验前各组间各指标(表2)均无显著差异(P>0.05);试验结束后(表3),与对照组相比,细菌组淋巴细胞数显著减少(P<0.05),白细胞数和中性粒细胞数显著增多(P<0.05);毒素组淋巴细胞数显著减少(P<0.05),白细胞和中性粒细胞数极显著增多(P<0.01)。与细菌组相比毒素组各项数据均无显著差异(P>0.05)。综上,2个模型在血常规指标方面,白细胞数和中性粒细胞数均有所升高,淋巴细胞数均有所降低,而且细菌组与毒素组相比无显著差异(P>0.05), 说明2个试验组具有相似的机体反应。

表2 试验前各组血常规指标分析Table 2 Analysis of blood routine indicators of each group before the test
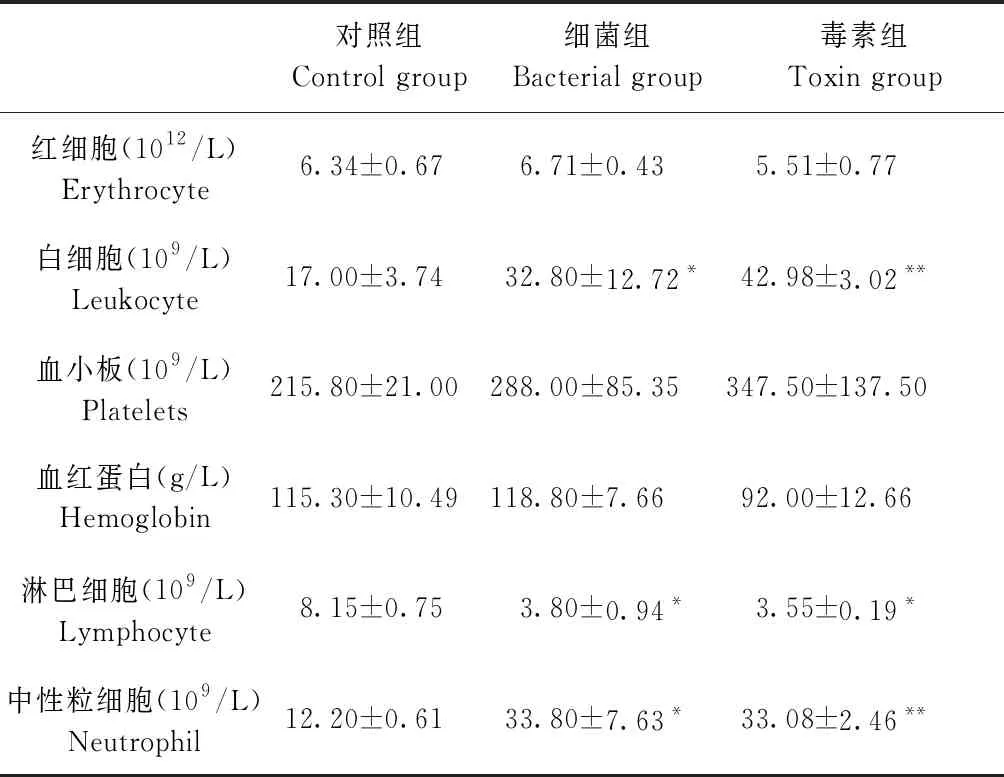
表3 试验结束后各组血常规指标分析Table 3 Analysis of blood routine indicators of each group after the end of the experiment
2.3 血液生化指标检测 经过血液生化指标分析,试验前与对照组各组各项指标变化差异较大,并不能筛选出具有典型性的生化指标,如表4、表5所示。

表4 试验前血液生化指标分析Table 4 Analysis of blood biochemical indicators before the test (n=4)

表5 试验结束后血液生化指标分析Table 5 Analysis of blood biochemical indicators after the end of the experiment
2.4 病理剖检 如中插彩版图1、2所示,细菌组胃膨胀充满,浆膜血管多淤血、怒张,呈树状;幽门部黏膜轻度潮红。小肠内有黄色至灰绿色水状液体,混有气泡,有恶臭气味;小肠、结肠黏膜面上有较多的黏液,呈卡他性炎症变化,肠管失去弹性,严重脱水。肠系膜淋巴结充血、水肿呈黄白色串珠状。肺轻度淤血、肿大,有实质性病变。毒素组不仅表现出相似的肠道病变而且腹腔积液严重,肠系膜严重水肿,肠系膜淋巴结呈白色串珠状;肺脏淤血实质性病变严重;胸腔积液严重;有大量心包积液;肝脏边缘有出血点。

图1 细菌组剖检病变Fig.1 Bacterial group necropsy lesionsA:细菌组肺脏肿大,点状出血,实质性病变严重; B、C、D:小肠和肠系膜充血,松弛,肠腔充满液体; E:小肠内鼓气混有泡沫,黏液A:Bacteria group lung enlargement,spotted hemorrhage,and serious substantive lesions; B,C,D:Small intestine and mesentery are congested and relaxed,and the intestinal cavity is filled with liquid; E:Inflation in the small intestine is mixed with foam and mucus

图2 毒素组剖检病变Fig.2 Toxin group necropsy lesionsA:毒素组肺脏大面积实质性病变,淤血; B:小肠和肠系膜水肿; C、D:腹腔积液、心包积液,胸腔积液严重; E肝脏点状出血A:Toxic group large lung substantial lesions,congestion; B:Small intestine and mesenteric edema;C, D:Ascites,pericardial effusion,severe pleural effusion; E:Liver spotted bleeding
2.5 病理组织学检查 对照组肺泡壁分界清晰,肺泡内无异物,未见炎性细胞,肺泡细胞染色均匀,细胞核形状一致。细菌组出现明显的组织结构变化,肺泡出现病区变实,肺泡壁分界不清楚,无正常肺泡或肺泡壁变窄,肺泡腔内渗出物主要是中性粒细胞和红染细网状的纤维素,染色不均,形态出现改变。毒素组肺组织发生实变,部分肺泡破裂、融合,而有的肺泡代偿性肥大,间质结缔组织增生显著。见封三彩版图3。

图3 肺组织H.E.染色 (200×)Fig.3 H.E. staining of lung tissue (200×)A:对照组; B:细菌组; C:毒素组A:Control group; B:Bacterial group; C:Toxin group
组织切片可见对照组空肠肠壁较厚,肠绒毛结构完整未见脱落,肠道结构正常;细菌组肠壁变薄,黏膜下层充满液体,肠绒毛变短脱落,上皮细胞肿胀,肠腺出血,杯状细胞增多;毒素组肠壁变薄,黏膜间质充满液体,肠黏膜脱落变短,肠黏膜上皮肿胀,肠腺完全被破坏呈现空泡状结构,杯状细胞增多;部分固有膜、黏膜下层、肌层有少量的红细胞。见封三彩版图4。

图4 空肠组织H.E.染色 (200×和400×)Fig.4 H.E. staining of jejunal tissue (200× and 400×)A:对照组(200×); B:细菌组(200×); C:毒素组(200×); D:对照组(400×); E:细菌组(400×); F:毒素组(400×)A:Control group(200×); B:Bacteria group(200×); C:Toxin group (200×); D:Control group(400×); E:Bacteria group(400×); F:Toxin group(400×)
2.6 小肠黏膜组织形态检测 与对照组相比,细菌组十二指肠肠壁极显著变薄(P<0.01),肠绒毛极显著变短(P<0.01);空肠肠壁显著变薄(P<0.05),绒毛长度显著变短(P<0.05);回肠肠壁极显著变薄(P<0.01),绒毛长度极显著变短(P<0.01)。毒素组十二指肠绒毛极显著变短(P<0.01);空肠肠壁极显著变薄(P<0.01),绒毛长度极显著变短(P<0.01);回肠肠壁极显著变薄(P<0.01),绒毛长度极显著变短(P<0.01)。见图5。

图5 小肠黏膜组织形态分析Fig.5 Analysis of small intestinal mucosa morphology
2.7 血液中LT检测以及免疫组化检测 采用WB的方法对各组样品血清进行检测,检测结果表明,各试验组血清中LT含量低于10 ng/mL,血清中毒素含量达不到检测范围。免疫组化在试验组空肠组织检测到少量LT存在。见封三彩版图6。

图6 空肠组织免疫组化图片 (200×)Fig.6 Immunohistochemistry pictures of jejunum (200×)A:对照组; B:细菌组; C:毒素组A:Control group; B:Bacterial group; C:Toxin group
3 讨论
本试验建立的产热敏热敏肠毒素大肠杆菌病模型的发病机理目前尚未清楚,对靶器官了解的还不够全面,对血液生理生化的病理学研究更是稀少[10]。因此对生化指标进行研究,了解血液病理学,为进一步研究仔猪腹泻的发病机理和作用的靶器官提供理论基础[11]。试验结果中,与对照组相比,试验前(表2)各组间血常规各指标均无显著差异(P>0.05),试验后(表3)2个模型组白细胞数和中性粒细胞数均有所升高,淋巴细胞数均有所降低,而且细菌组与毒素组相比无显著差异(P>0.05),说明2个试验组具有相似的机体反应。免疫组化试验中在空肠组织中可以检测到少量的LT的存在,而WB试验中不能检测出,说明LT在体内含量极少;病理剖解的结果中,与正常组相比,毒素组的病变情况比细菌组的肠道和肺脏的病变严重,说明产热敏肠毒素与热敏肠毒素大肠杆菌病具有必然的联系。
与细菌组和病毒组比较,正常组的小肠上皮细胞中杯状细胞较少,绒毛密集,其作用是杯状细胞能缓慢分泌少量黏液,在黏膜表面形成疏水的黏液凝胶层,润滑和保护上皮细胞网[12]。结果中细菌组和毒素组腹泻严重破坏了肠道黏膜完整性,大量肠绒毛脱落,肠壁变薄,间质充水,脱落的黏膜和坏死细胞掉落在肠腔内与杯状细胞分泌的黏液一起形成脓性分泌物。小肠是执行身体营养吸收的主要器官,其主要吸收功能来自于小肠绒毛;小肠绒毛是由小肠上皮和固有层一同向肠腔内突出的突起,突起越多肠道吸收营养物质的面积越大,各试验组小肠绒毛大量脱落,引起了一系列肠道炎症反应[13]。建立产热敏肠毒素大肠杆菌模型能够有效的了解热门肠毒素仔猪模型和产热敏肠毒素大肠杆菌模型的病理模型的联系,推论证明得出热敏肠毒素是产热敏肠毒素大肠杆菌病的主要致病原因。
