基于电子鼻和HPLC分析蜂房哈夫尼菌对海参腐败的影响
2020-10-21姚巧丽,张公亮,毕景然,高美玲,侯红漫
姚 巧 丽, 张 公 亮, 毕 景 然, 高 美 玲, 侯 红 漫
( 大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
近年来,即食海参越来越受到消费者的欢迎,其需求量增加的同时,问题也随之而来,主要集中于即食海参的腐败变质现象[1]。加工过程中灭菌不够彻底、耐冷嗜冷腐败细菌的入侵是导致即食海参腐败变质的主要原因[2]。即食海参受微生物侵染后,不但影响感官品质,降低食用价值,甚至可能严重影响人类健康。
蜂房哈夫尼菌(Hafniaalvei)是一种革兰氏阴性菌,存在于自然界,可从乳制品、肉制品和水产品中分离得到[4]。蜂房哈夫尼菌能够在低温环境中生长,是导致冷藏食品变质的主要腐败菌之一[5]。Nychas等[6]研究发现一些耐冷的肠杆菌,如蜂房哈夫尼夫菌、成团肠杆菌和变形斑沙雷菌等,能够引起肉及肉类制品腐败变质。李婷婷等[7]研究了希瓦氏菌和蜂房哈夫尼菌共生培养对冷藏大菱鲆的致腐能力,发现两者共同作用时腐败效果更为显著。
本实验室从腐败即食海参多种优势腐败菌,通过对其生理生化特性的鉴定分析,认定其中一株为蜂房哈夫尼菌属。由于目前关于蜂房哈夫尼菌对即食海参致腐能力的研究不多,故本实验通过蜂房哈夫尼菌的回接实验,观察海参源蜂房哈夫尼菌致腐特性,研究了该菌的生长情况,接菌前后海参气味变化和海参产生物胺的情况,初步探索蜂房哈夫尼菌对即食海参的腐败作用,以期为后续的研究提供理论支持。
1 材料与方法
1.1 材 料
即食海参,冷冻保藏;蜂房哈夫尼菌(HafniaalveiH4),实验室保藏,分离自腐败即食海参。
L-赖氨酸盐酸盐、L-组氨酸单盐酸盐-水合物、L-酪氨酸二钠盐水合物、L-鸟氨酸盐酸盐、L-精氨酸盐酸盐、L-苯丙氨酸盐酸盐和L-色氨酸盐酸盐、丹磺酰氯,北京索莱宝科技有限公司;胰蛋白胨、琼脂粉、氯化钠、氧化镁,均为国产分析纯,1 mL无菌注射器、0.22 μm有机滤膜、0.22 μm 有机过滤器、色谱级乙腈。
1.2 仪器与设备
PEN3.5便携式电子鼻,德国Airsense公司;1260高效液相色谱仪,安捷伦科技(中国)有限公司;Sorvall ST 16R高速冷冻离心机,赛默飞世尔科技(中国)有限公司;海能K9840自动凯氏定氮仪,济南海能仪器股份有限公司。
1.3 方 法
1.3.1 菌落总数的测定
LB培养基(g/L):胰蛋白胨10.0,酵母浸粉5.0,NaCl 10.0,pH (7.0±0.2),121 ℃、15 min高温湿热灭菌备用。
海参基质培养基:将解冻后的即食海参与超纯水按照质量比1∶19匀浆,110 ℃、15 min高温湿热灭菌,备用。
挑取单菌落于100 mL液体LB培养基中,30 ℃、150 r/min摇床过夜培养,作为种子菌液(浓度1×109CFU/mL)。采用平板计数法,根据GB 4789.2—2016《食品微生物学检验:菌落总数测定》进行菌落总数的测定。
1.3.2 挥发性盐基氮的测定
将解冻后的海参加入适量的超纯水(质量比2∶1)绞碎处理,每50 g分装到250 mL锥形瓶中,110 ℃、15 min湿热灭菌处理,待冷却后,接种1 mL种子菌液,置于恒温恒湿培养箱(30 ℃,湿度60%)中培养。每隔24 h用无菌钥匙称取(3.00±0.10) g,参照国家标准GB 5009.228—2016中的自动凯氏定氮法,对样品进行挥发性盐基氮(TVB-N)的测定。
1.3.3 挥发性风味物质的检测
将冷冻即食海参解冻,切成小块,每块质量(3.00±0.10) g,置于小平板中,110 ℃、15 min湿热灭菌处理,待冷却后,均匀淋洒100 μL 菌液,置于恒温恒湿(30 ℃,湿度60%)培养箱中静置培养,每隔1 d进行一次电子鼻检测,共5 d。采用Winmuster软件进行数据的采集与处理,主要分析方法有主成分分析(principal component analysis,PCA)、线性判别式分析(linear discriminant analysis,LDA)和负荷加载分析(Loadings)。
1.3.4 生物胺的定性和定量分析
1.3.4.1 脱羧酶实验
根据Chang等[8]方法稍有改动,以氨基酸脱羧酶培养基和普通LB培养基同时作为实验组,氨基酸脱羧酶培养基作为空白对照,将菌液按1∶100 接种到培养基中,30 ℃、150 r/min摇床培养,每隔24 h观察颜色变化。
1.3.4.2 HPLC测定生物胺质量分数
样品制备方法根据夏秀东等[9]的方法稍有改动:挑取单菌落于5 mL液体LB培养基中,30 ℃、150 r/min摇床培养,待培养基混浊,吸取100 μL菌液转接于5 mL海参基质培养基中,分别置于10、15、20、25、30和35 ℃下摇床培养,每隔24 h进行一次生物胺提取,提取液过3次0.22 μm 滤膜,除去杂质,即可进行HPLC分析。
HPLC条件:安捷伦ZORBAX SB-C18色谱柱(4.6 mm×150 mm,5 μm),体积流量1.0 mL/min,进样量25 μL,时长35 min,柱温30 ℃,检测波长254 nm,流动相为乙腈和水。0~5 min,乙腈体积分数45%;5~20 min,乙腈体积分数由45%提升至90%;20~30 min,乙腈体积分数保持90%不变;30~33 min,乙腈体积分数由90%降到45%;33~35 min,保持乙腈体积分数45%不变。
1.4 数据分析
每个实验平行重复3次,实验结果使用SPSS 18.0软件进行数据方差分析及多重比较,使用Origin 9.0进行图表绘制。
2 结果与讨论
2.1 野生型蜂房哈夫尼菌在海参基质中的生长
细菌的生长繁殖和代谢活动是引起水产品腐败变质的主要原因。如图1所示,30 ℃下,蜂房哈夫尼菌在海参基质培养基生长迅速,4 h菌落数可达6.27×106CFU/mL,此后生长趋于稳定,12 h达到最高,为6.67×106CFU/mL,16 h开始降低,菌落数为6.42×106CFU/mL。说明蜂房哈夫尼菌能够利用海参的营养物质进行生长繁殖。
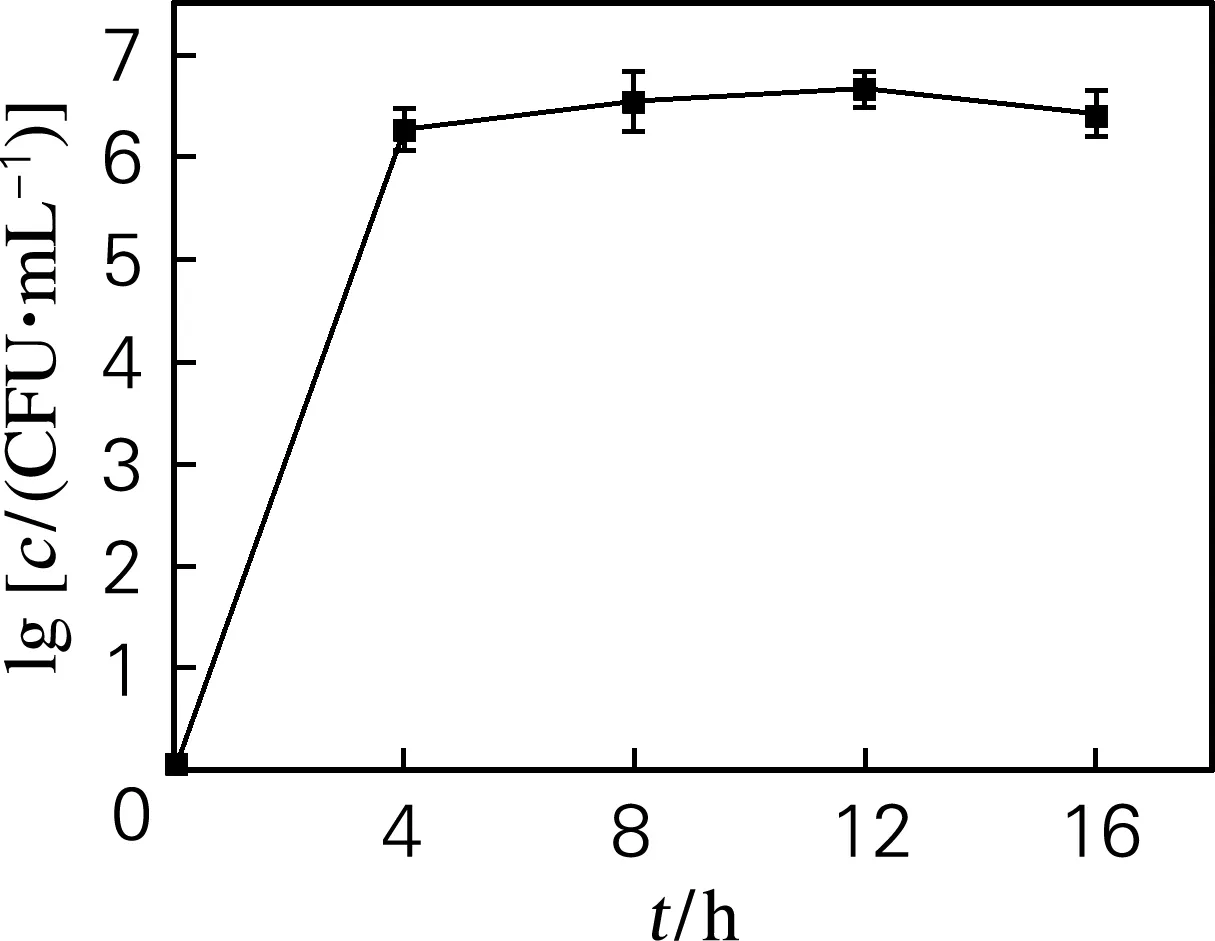
图1 海参基质培养基中菌落数的变化Fig.1 Changes of colony number in sea cucumber medium
2.2 TVB-N质量分数变化
TVB-N是评判水产品品质的重要指标,能在一定程度上说明水产品的腐败进程。图2是海参基质接种蜂房哈夫尼菌后,30 ℃培养条件下TVB-N质量分数的变化情况。由图2可知,TVB-N质量分数随时间延长而增加,在120 h的质量分数为(175.3±2.9) mg/kg,说明蜂房哈夫尼菌能够引起海参的腐败变质。

图2 30 ℃下挥发性盐基氮质量分数的变化Fig.2 Change of TVB-N content at 30 ℃
2.3 挥发性物质的电子鼻分析
2.3.1 PCA方法分析
主成分分析是将多个指标化为较少的几个综合指标的一种统计方法[10]。图3是采用PCA方法分析不同时间下海参块的电子鼻响应信息。由图3可知,第1主成分贡献率为96.25%,第2主成分贡献率为2.88%,总贡献率为99.13%。从图3中可以看出,海参产生的挥发气味随时间变化而变化,且没有重叠,区分度较好。1~2 d信号响应值比较接近,说明海参挥发气味较为接近,变化不明显;3~5 d较前两天信号响应值区分明显,说明挥发性气味变化较大。PCA结果说明菌能够在海参块上生长作用,并且其代谢活动能够引起海参品质变化,产生多种挥发性物质。
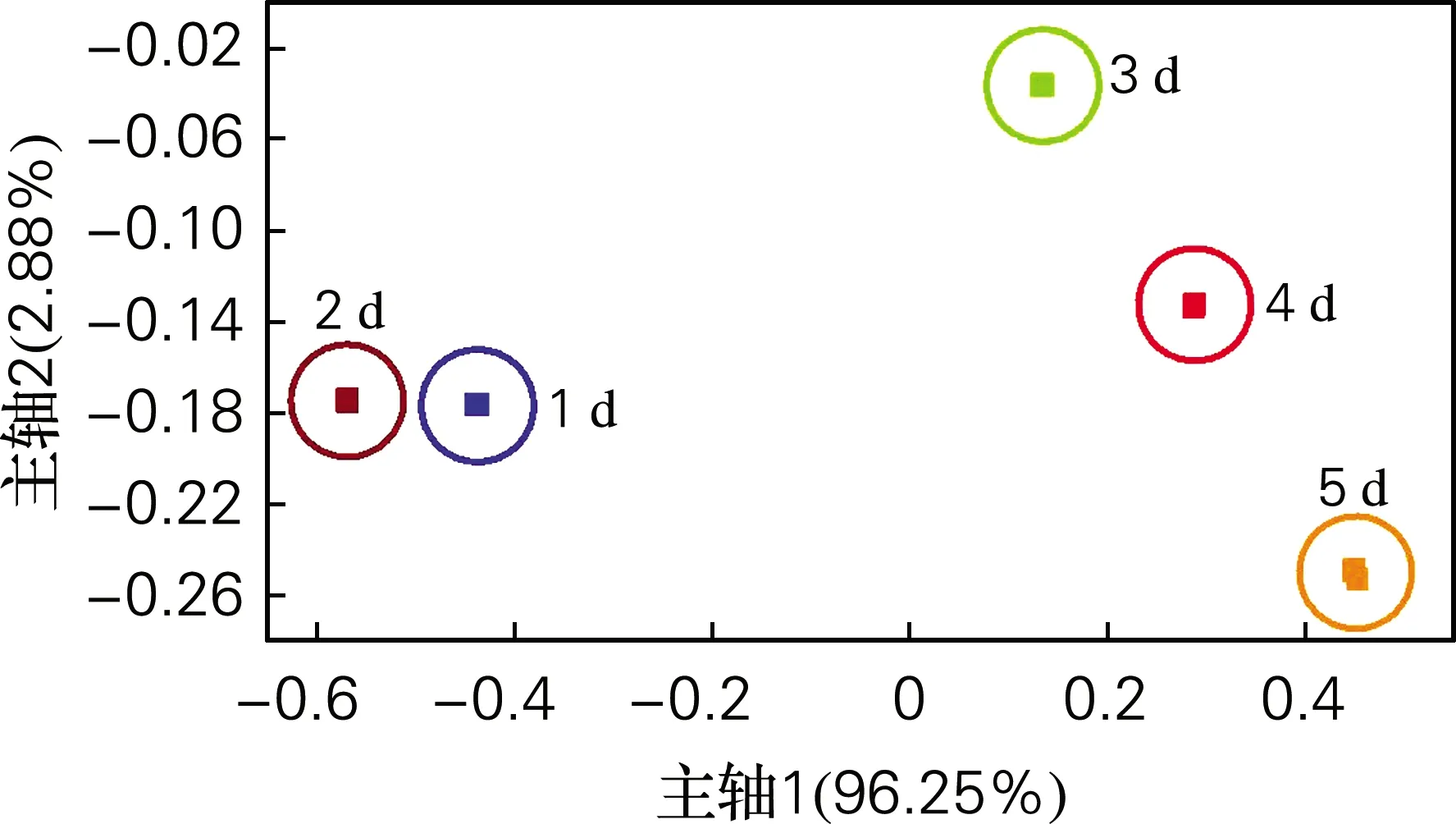
图3 不同时间下海参块的PCA分析Fig.3 PCA analysis of sea cucumber blocks at different time
2.3.2 LDA方法分析
线性判别式分析更加注重样品在空间中的分布状态及彼此之间的距离分析[9]。图4是不同时间下海参块电子鼻的LDA分析。图4中判别式1(横轴)贡献率为97.01%,判别式2(纵轴)贡献率为2.61%,两个判别式总贡献率为99.62%。从LDA分析看出,不同时间下海参块之间存在差异,可由此区分不同新鲜程度的海参。
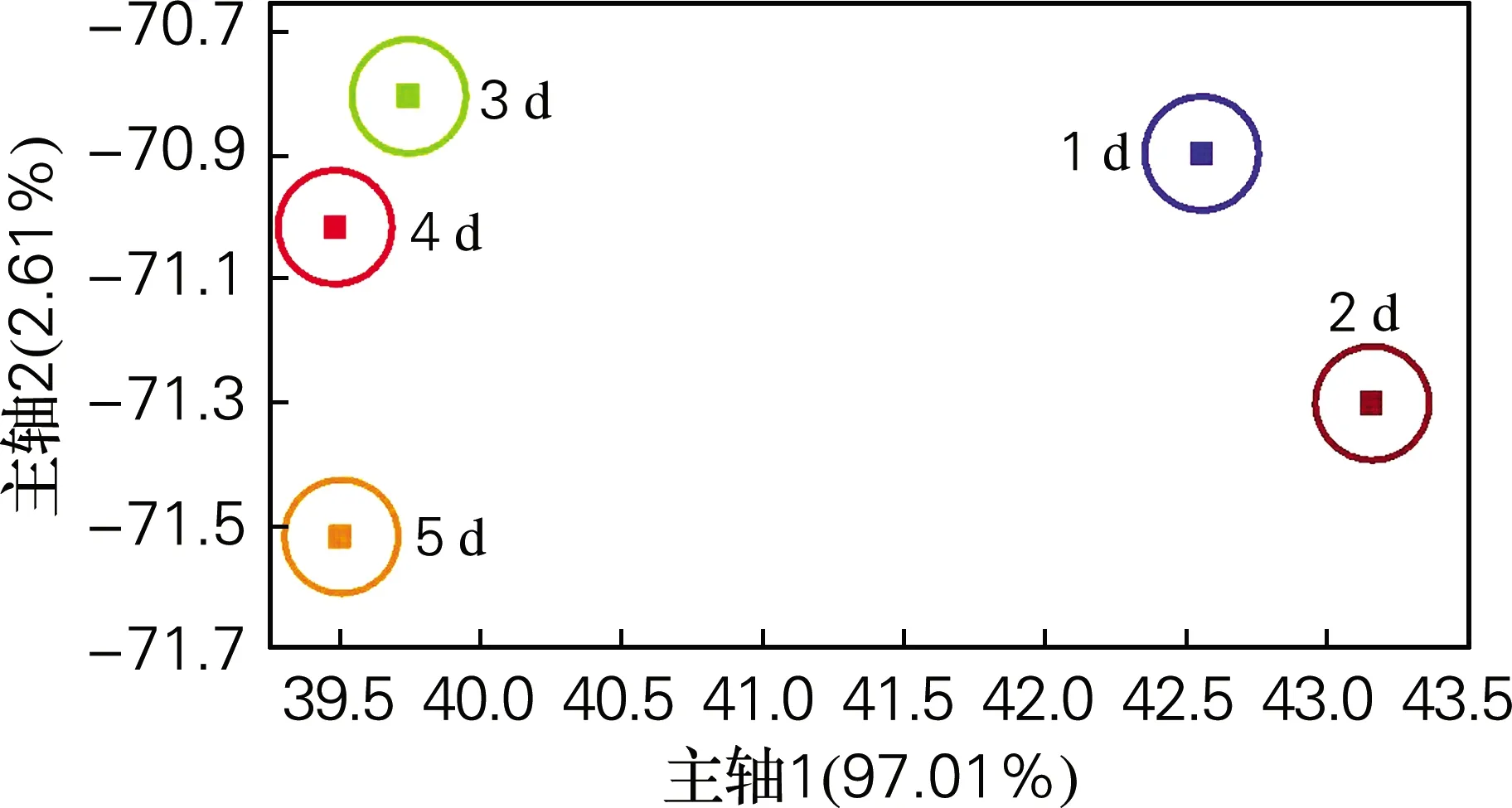
图4 不同时间下海参块的LDA分析Fig.4 LDA analysis of sea cucumber blocks at different time
2.3.3 Loadings方法分析
负荷加载分析表现的是10个传感器响应值的信息。若某一传感器的响应值接近于零(横、纵坐标对应值接近于零),则该传感器的识别作用可以忽略;若某一传感器的响应值越偏离于零,则说明该传感器的识别能力越强[15]。如图5所示,主轴1贡献率70.78%,主轴2贡献率18.41%。1~10号传感器分别代表10种挥发性物质,其中2、6、7、8和9号信号响应较强,分别对应氮氧化合物、甲烷、硫化氢、乙醇和有机硫化物,这几类物质是水产品腐败过程中的常见挥发性成分,由此可以说明蜂房哈夫尼菌能够引起海参的腐败变质,影响其新鲜程度。
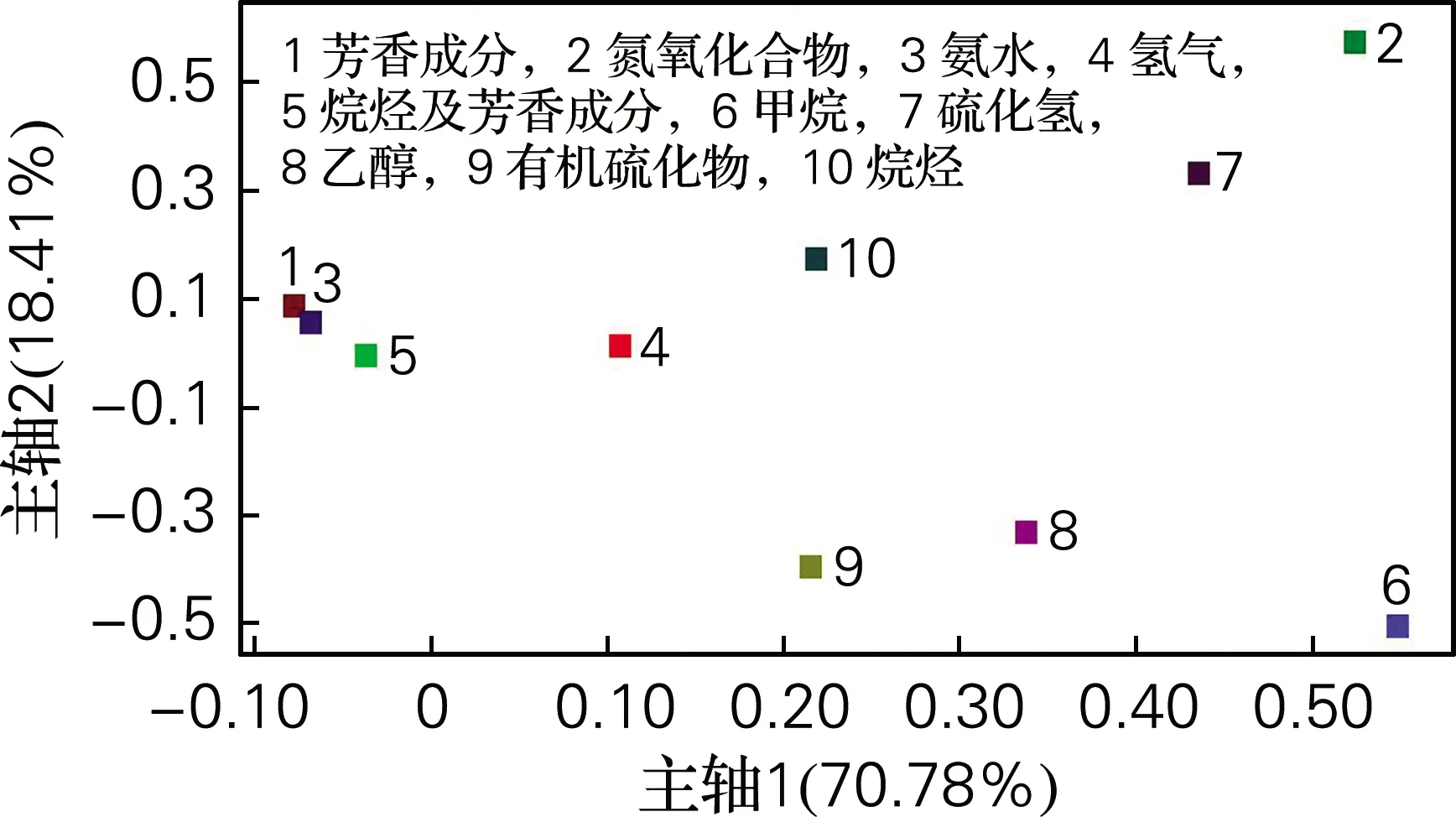
图5 不同时间下海参块的Loadings分析Fig.5 Loadings analysis of sea cucumber blocks at different time
2.4 生物胺的定性和定量分析
2.4.1 脱羧酶实验
由图6可知,添加了各氨基酸前体的培养基在接种蜂房哈夫尼菌种子液之后,腐胺和尸胺在24 h之内产生阳性反应(紫色),说明该菌具备代谢鸟氨酸和赖氨酸的能力;另外几种氨基酸在96 h内也相继产生阳性反应,但较腐胺和尸胺稍弱。

a,LB培养基;b,脱羧酶培养基对照;c,脱羧酶培养基图6 脱羧酶实验Fig.6 Experiments of decarboxylase
2.4.2 HPLC定量测定海参基质中的生物胺
表1为HPLC测定蜂房哈夫尼菌在海参基质中分别在培养温度10、15、20、25、30、35 ℃和培养时间24、48、72、96 h下产生生物胺的种类和质量分数。由表1可知,在24 h各个温度下和48 h的10、15和20 ℃下均未检出色胺,此后48 h在25、30和35 ℃,以及72和96 h的各个温度下均有色胺检出,且各温度下色胺质量分数随时间延长而增加。
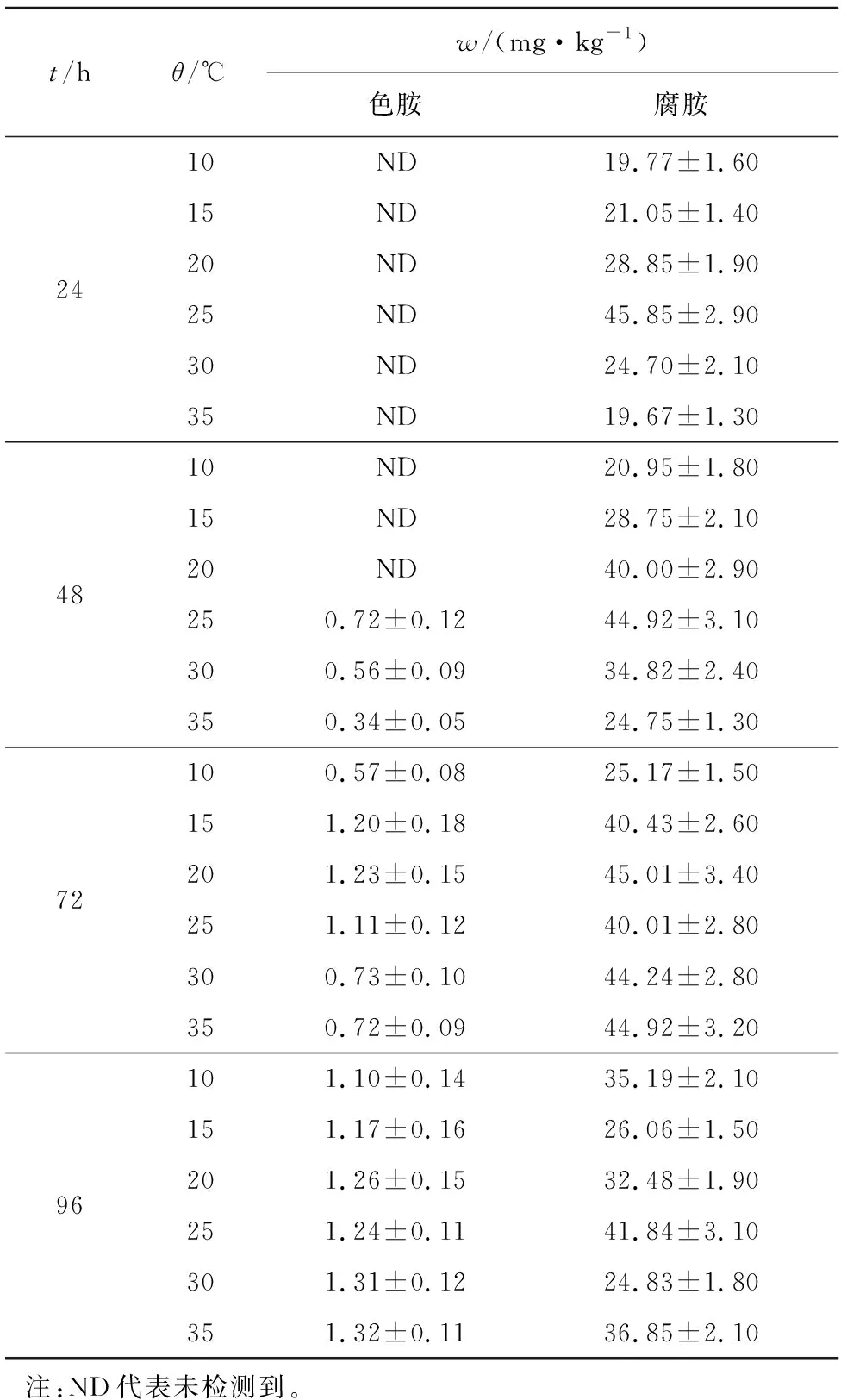
表1 HPLC分析海参基质中生物胺的质量分数Tab.1 Analysis of biogenic amines in sea cucumber medium by HPLC
10 ℃下腐胺产量随时间延长稍有增加,96 h产量最高;25 ℃下,24 h产生腐胺质量分数最高,随时间延长略有降低;其他各温度下,腐胺质量分数在72 h达到顶峰。低温下蜂房哈夫尼菌的生长速度受到影响,故在10 ℃下生物胺产量较少,仅为同时间内生物胺总量的13%左右;25 ℃下生物胺产量较高,占同时间内生物胺总量的23%左右。由此可初步认定25 ℃是蜂房哈夫尼菌在海参基质中产生物胺的最适温度。
3 结 论
蜂房哈夫尼菌在30 ℃下能够利用海参基质中的营养成分进行生长繁殖,12 h菌落总数最高可达6.67×106CFU/mL。在电子鼻分析中,接种该菌之后的5 d时间内,其生长代谢产生了硫化氢和氮氧化合物等挥发性物质,第5天TVB-N质量分数为(175.3±2.9) mg/kg,质量分数随时间延长而增加。脱羧酶实验表明,在添加各氨基酸前体物质的前提下,蜂房哈夫尼菌可代谢7种氨基酸,生成相应的胺类物质,其中以腐胺和尸胺最为显著。HPLC分析可知,该菌在海参基质中代谢可产生较多的腐胺。脱羧酶实验和HPLC定量实验中,由于培养基质不同,产生的生物胺种类略有不同,但两者都说明蜂房哈夫尼菌能够代谢鸟氨酸,生成腐胺。结果表明,蜂房哈夫尼菌具有一定的致腐作用,会造成水产品的营养流失和腐败变质,不利于人类健康和食用。
