基于TaqMan实时荧光PCR检测鲜肉及加工制品中的鸭源性成分
2020-10-20刘国强海小罗建兴
刘国强 海小 罗建兴

摘要:禽源性成分检测既可以预防禽流感又能分析肉类的掺假问题。本研究参考行业标准(SN/T 2727-2010),对鸭和其它12种不同源性动物DNA进行特异性检测;将鸭来源DNA模板原液进行梯度稀释确定其检出限,同时进行灵敏度实验和掺假实验;在加工制品中检测其适用性。结果表明:此引物和探针特异性强,只针对鸭有特异性扩增曲线,对其它12种动物源性无扩增曲线;当鸭模板DNA浓度为10fg·μL-1时,仍能检测到鸭源性,灵敏度可达到1%,同时可以很好地检测掺假;此引物和探针在加工制品中检测结果良好,适用于加工肉制品的检测。本实验通过所建立标准曲线y=-3.4554x+42.663,R2=0.9942,其PCR扩增效率为95%,可以有效地进行定量。同时利用灵敏度检测可以判断此方法的掺假检测能力较强。综上所述,本研究可以有效检测鸭源性的掺假问题,并能为标准提供一定的借鉴。
关键词:鸭源性成分;特异性;检出限;灵敏度;加工制品;定量检测
中图分类号:S-3
文献标识码:A
作者简介:刘国强(1994-),男,本科,研究实习员。研究方向:动物源性成分检测和转基因成分检测;通讯作者郭梁(1986-),男,博士,助理研究员。研究方向:动物源性成分检测和转基因成分检测以及微生物资源开发。
肉类是人们饮食中不可缺少的一部分,其含有多种营养物质(如蛋白质、脂肪以及微量元素等)[1,2]。目前在肉及肉制品的生产和运输中会时常发生一些掺假的问题[3-6],如将鸡、鸭肉(低价肉)掺杂到牛、羊肉(高价肉)中。动物源性检测技术针对上述问题,除了能保护消费者合法权益、维持市场公平交易机制,还能预防动物来源性疾病的传播(疯牛病、口蹄疫、牛海绵状脑病等)[7-10]。
目前,动物源性检测技术建立在对样品蛋白质、脂肪酸以及核酸等种属特异分子鉴别肉与肉制品的动物来源[11-15]。动物源性检测所涉及的技术手段包括电泳[16,17]、免疫组化[18,19]、质谱[20]、色谱[21]、聚合酶链式反应(Polymerase Chain Reaction, PCR)[22,23]。因为脱氧核糖核酸(DNA)的热稳定性[24],使得以DNA为基础的PCR技术成为了检测动物源性检测主流技术[25,26]。其中,荧光染料(SYBR Green 或Eva Green)[27,28]和TaqMan探针[29,30]成为了PCR检测的主要技术。探针技术因为其种属特异性探针提高了实时荧光PCR的扩增效率和特异性,从而快速并且准确地得到检测结果。
本文参考行业标准(SN/T 2727-2010)[31],建立肉与肉制品中鸭源性成分的TaqMan实时荧光PCR检测方法,保证鸭源性成分的快速检测,规范食品市场。
1材料与方法
1.1样品准备
鲜肉及加工肉制品均购买于本地农贸市场,鲜肉包括鸭肉、羊肉、牛肉、猪肉、马肉、鹿肉、驴肉、兔肉、狗肉、鹌鹑肉、鸡肉、火鸡肉和鸽子肉。加工肉制品包括口口丫鸭翅根、口口丫蜜汁烤腿、金锣火腿肠、肉粒多火腿肠、尚清斋烤肠、蒙羊羊肉干、呼纳斯牛肉干。样品采集处理去除脂肪,并用灭菌水清洗,置于-20℃保存。
1.2试剂
TransStart Probe qPCR SuperMix (北京全式金生物技术有限公司);实时荧光定量PCR引物和探针合成(北京睿博兴科公司);Takara MiniBEST Universal基因组提取试剂盒(宝生物工程(大连)有限公司)。
1.3仪器
Eppendorf 5418R Centrifuge高速台式离心机(德国Eppendorf AG公司);Nanodrop 2000c 核酸蛋白测定仪(美国Thermo Fisher公司);7300plus实时荧光PCR扩增仪(美国ABI公司)。
1.4方法
1.4.1引物和探针
引物和探针均由北京睿博兴科公司合成。引物与探针序列如下表1。
1.4.2DNA提取
取1.1準备好的鲜肉和肉制品样品,利用Takara MiniBEST Universal基因组提取试剂盒其DNA,利用Nanodrop 2000c核酸蛋白分析仪测量其浓度,将母液稀释至100ng·μL-1左右,保存于-20℃。
1.4.3反应体系与反应条件
反应体系(总体积20μL):TransStart Probe qPCR SuperMix 10μL,左右引物各1μL,探针1μL,模板2μL,补ddH2O至20μL。
反应条件:95℃5min,1个循环;95℃5s,60℃30s,45个循环,在每次循环退火时收集荧光信号。
1.4.4特异性实验
分别取鸭、羊、牛、猪、马、鹿、驴、兔、狗、鹌鹑、鸡、火鸡和鸽子13种不同源性动物DNA模板进行鸭源性特异性分析实验。
1.4.5检出限检测实验
从100ng·μL-1的鸭肉模板DNA稀释液加灭菌ddH2O开始稀释,每1/10稀释1次,共稀释7次。分别为100ng·μL-1、10ng·μL-1、1ng·μL-1、0.1ng·μL-1、0.01ng·μL-1、0.001ng·μL-1、0.0001ng·μL-1、0.00001ng·μL-1的鸭肉模板DNA稀释液进行检出限检测实验。
1.4.6灵敏度和模拟掺假实验
将鸭肉DNA与羊肉DNA以一定比例混合,制成鸭肉DNA含量分别为1%、5%、10%、30%、70%、90%、95%、99%的混合DNA样品,进行模拟掺假检测实验,同时依照1.4.3反应体系对该方法的灵敏度进行分析,每次实验设3个平行。
1.4.7数据处理
利用Real-Time PCR Software 对结果进行扩增曲线和循环(Cycle threshold,Ct)的分析。每次实验结果都是3个平行实验的平均值±标准差表示。
2结果与分析
2.1特异性实验
将鸭、羊、牛、猪、马、鹿、驴、兔、狗、鹌鹑、鸡、火鸡、鸽子的模板DNA(如图1、表2所示),分别利用鸭的引物和探针进行实时荧光定量PCR实验,特异性扩增结果如图2所示,PCR扩增产物经过琼脂糖凝胶电泳处理之后如图3所示,产物条带均为单一条带,无非特异性扩增,说明引物和探针组合具有较高的特异性。由图2和表2可以看出,仅鸭的样品出现典型扩增曲线,Ct值为14.01±0.18(鸭肉样品1),13.92±0.35(鸭肉样品2),13.86±0.12(鸭肉样品3),13.78±0.43(鸭肉样品4),13.74±0.07(鸭肉样品5),其它12种动物(其它肉样:羊、牛、猪、马、鹿、驴、兔、狗、鹌鹑、鸡、火鸡和鸽子)均未有出现典型扩增曲线且Ct值均为0。
2.2检出限检测实验
通过鸭引物和探针对100ng·μL-1、10ng·μL-1、1ng·μL-1、0.1ng·μL-1、0.01ng·μL-1、0.001ng·μL-1、0.0001ng·μL-1、0.00001ng·μL-18个不同质量浓度梯度的样品DNA进行荧光定量PCR扩增实验。结果如图4所示和表3所示。由图4和表3可知,稀释至0.00001ng(即10fg)的鸭基因组DNA模板(3个平行实验)出现典型扩增曲线,Ct值为38.37±0.19;以扩增结果Ct<40时判定为确认检出,上述结果表明此探针已达到检出限度,说明鸭特异性引物和探针的检测限度可达到10fg。
2.3定量检测
利用100ng·μL-1、10ng·μL-1、1ng·μL-1、0.1ng·μL-1、0.01ng·μL-1、0.001ng·μL-1、0.0001ng·μL-1、0.00001ng·μL-1的鸭肉模板DNA稀释液,进行引物和探针的检测,制作鸭源性定量检测标准曲线,如图5所示。所得鸭的特异性探针的標准曲线为y=-3.4554x+42.663,R2=0.9942。由于PCR扩增效率E(%)=[10(-1/slope)-1]×100,其PCR扩增效率为95%,PCR效率的接受范围在90%~110%[32,33],对应于回归斜率在-3.1~-3.6,R2值≥0.98。综上所述,此方法具有较好的定量检测能力。
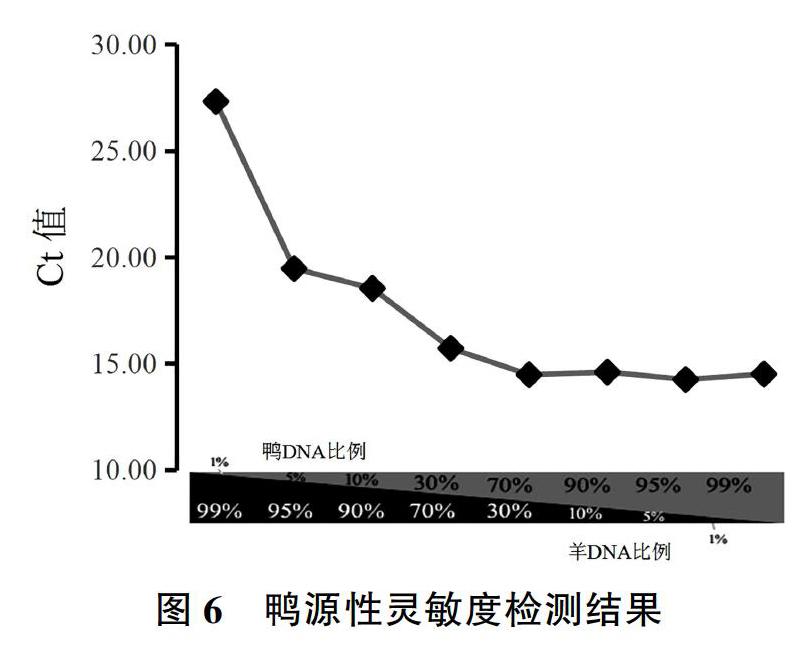
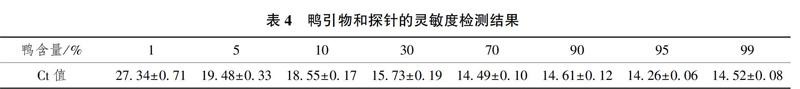
2.4灵敏度实验
因为鸭肉经常被掺杂到羊肉中,所以本实验通过鸭引物和探针对鸭组分DNA和羊组分DNA混合样(鸭组分含量分别为1%、5%、10%、30%、70%、90%、95%、99%)进行模拟掺假实验,结果如图6所示,具体数值如表4所示。由图6和表4可知,当混合DNA样品中鸭组分含量为1%时,出现典型的扩增曲线,Ct值为27.34±0.71。因为当混合DNA样品中鸭组分含量为1%时,3个平行中均出现典型的扩增曲线,所以可以证明此探针对鸭肉掺假羊肉检测效果明显,同时上述结果能充分证明此引物和探针具有较高的灵敏度。
2.5加工肉制品的检测
提取1.1中已处理好加工肉制品的DNA,进行实验。其扩增曲线结果和Ct值如表5和图7所示。
3讨论
与实时荧光PCR技术相比,普通PCR检测的普遍弱点就是耗时长[25-27],检测人员常常需要花费大量时间来对实验进行重复工作,而且一个实验结果通常都需要进行一系列实验才能得出。而实时荧光定量PCR由于添加了TaqMan探针和荧光信号,使得其灵敏度与特异性都高于普通PCR,特别是检测大批量样品时其优势尤为明显。实时荧光定量PCR不仅能够实时监测,同时得到检测的结果迅速,在1~2h就可以得到结果,而且结果简单直观,易于分析。
本研究通过出入境检验检疫行业标准(SN/T 2727-2010)合成检测鸭源性成分的引物和探针,通过实验探索了最佳的反应体系和反应条件。创新点在于基于行业标准,增加了特异性实验、检出限实验、模拟掺假实验和适用性实验,并且通过建立标准曲线来评价方法的定量检测能力。本研究对鸭、羊、牛、猪、马、鹿、驴、兔、狗、鹌鹑、鸡、火鸡和鸽子13种不同源性动物进行特异性实验。结果显示,只有鸭肉有特异性扩增,其它动物均没有;将鸭来源的DNA模板原液进行浓度梯度稀释,分别为100ng·μL-1、10ng·μL-1、1ng·μL-1、0.1ng·μL-1、0.01ng·μL-1、0.001ng·μL-1、0.0001ng·μL-1、0.00001ng·μL-1的鸭肉模板DNA稀释液进行检出限检测实验,检出限为10fg;建立标准曲线,其PCR扩增效率为95%,在90%~110%,标准曲线R2=0.9942≥0.98可以评价此引物和探针定量检测能力较好。同时还将鸭模板DNA与羊模板DNA按照1%、5%、10%、30%、70%、90%、95%、99%体积比例混合来模拟掺假实验。结果显示,鸭模板DNA体积比例为1%时仍可以检测到鸭源性,同时证明此引物和探针的灵敏度可达1%。通过实时荧光PCR在鸭翅根、蜜汁烤腿、金锣火腿肠、肉粒多火腿肠、尚清斋烤肠、蒙羊羊肉干、呼纳斯牛肉干进行适用性实验,只有在具有鸭源性的鸭翅根和蜜汁烤翅中才能检测到鸭源性,说明此引物和探针适用性较好。
本方法的检出限为10fg,在本研究中的引物和探针组合与已报道的研究相比具有较大的优势,同时检出限已超越了之前的研究[37-39]。林彦星等[40]建立了实时荧光定量PCR检测畜禽肉制品中的鸭源性成分,可检测到1.0pg鸭源DNA的存在;金萍等[41]基于鸭线粒体细胞色素Cytb基因建立了肉制品中鸭源性成分检测的Real-time PCR检测方法,检出限为8pg;史艳宇等[42]建立了一种快速、特异、灵敏的鸭源性成分检测方法,其检出限为1.0mg;张弛等[43]建立肉制品中鸭源性成分定性和定量检测的检出限达到1.78pg;张秀平等[44]设计可特异检测鸭肉成分的引物和探针,其检出限为1pg;程欣[45]建立了添加有扩增内标的用于检测食品中鸭肉成分的实时荧光PCR方法,可检出0.05ng的鸭DNA;董洋洋[46]建立了鉴别鸭肉单一成分的实时荧光PCR的方法检测快速准确,检出限可达0.2ng。上述研究的检出限均低于本研究。
綜上所述,此方法具有较强的特异性、较高的灵敏度和适用性广等特点。可以有效检测掺假,从而维护消费者权益和防止禽类疾病的传播,为推动肉类食品领域向透明化、标准化发展提供技术支持。
参考文献
[1]Fidel Toldrá.Lawrie′s Meat Science (Eighth Edition)[M]. Woodhead,2017.
[2] Young W. Park. Overview of Bioactive components in milk and dairy products[M]. John Wiley & Sons,Ltd,2009.
[3] Ballin N Z. Authentication of meat and meat products[J]. Meat Science, 2010, 86(3): 577-587.
[4] Rahmati S, Julkapli N M, Yehye W, et al. Identification of meat origin in food products-A review[J]. Food Control, 2016(68): 379-390.
[5] Agrimonti C, Pirondini A, Marmiroli M, et al. A quadruplex PCR (qxPCR) assay for adulteration in dairy products[J]. Food Chemistry, 2015(187): 58-64.
[6] Clark S, Mora García M B. A 100-Year review: advances in goat milk research[J]. Journal of Dairy Science, 2017, 100(12): 10026-10044.
[7] Momcilovic D, Rasooly A. Detection and analysis of animal materials in food and feed[J]. Journal of Food Protection, 2000, 63(11): 1602-1609.
[8] Wang R F, Myers M J, Campbell W, et al. A rapid method for PCR detection of bovine materials in animal feedstuffs[J]. Molecular and Cellular Probes, 2000, 14(1): 1-5.
[9] Lahiff S, Glennon M, O'Brien L, et al. Species-specific PCR for the identification of ovine, porcine and chicken species in meat and bone meal (MBM)[J]. Molecular and Cellular Probes, 2001, 15(1): 27-35.
[10] Natonek-Wis[DD(-1*8]′[DD)]niewska M, Krzys[DD(-1*8]′[DD)]cin P, Piestrzyńska-Kajtoch A. The species identification of bovine, porcine, ovine and chicken components in animal meals, feeds and their ingredients, based on COX I analysis and ribosomal DNA sequences[J]. Food Control, 2013, 34(1): 69-78.
[11] Franke B M, Haldimann M, Reimann J, et al. Indications for the applicability of element signature analysis for the determination of the geographic origin of dried beef and poultry meat[J]. European Food Research and Technology, 2007(225): 501-509.
[12] Kumar A, Kumar R R, Sharma B D, et al. Identification of species origin of meat and meat products on the DNA basis: a review[J]. Critical Reviews in Food Science and Nutrition, 2015, 55(10): 1340-1351.
[13] Lo Y T, Shaw P C. DNA-based techniques for authentication of processed food and food supplements[J]. Food Chemistry, 2018(240): 767-774.
[14] Di Pinto A, Terio V, Marchetti P, et al. DNA-based approach for species identification of goat-milk products[J]. Food Chemistry, 2017(229): 93-97.
[26] Zhang C L, Fowler M R, Scott N W, et al. A TaqMan real-time PCR system for the identification and quantification of bovine DNA in meats, milks and cheeses[J]. Food Control, 2007, 18(9): 1149-1158.
[27] Agrimonti C, Pirondini A, Marmiroli M, et al. A quadruplex PCR (qxPCR) assay for adulteration in dairy products[J]. Food Chemistry, 2015(187): 58-64.
[28] Sakalar E, Ergun S O, Akar E. A simultaneous analytical method for duplex identification of porcine and horse in the meat products by EvaGreen based real-time PCR[J]. Korean Journal for Food Science of Animal Resources, 2015, 35(3): 382-388.
[29] López-Calleja I, González I, Fajardo V, et al. Real-time TaqMan PCR for quantitative detection of cows'milk in ewes'milk mixtures[J]. International Dairy Journal, 2007, 17(7): 729-736.
[30] Kim M, Yoo I, Lee S Y, et al. Quantitative detection of pork in commercial meat products byTaqMan real-time PCR assay targeting the mitochondrial D-loop region[J]. Food Chemistry, 2016(210): 102-106.
[31] SN/T 2727-2010,饲料中禽源性成分检测方法 实时荧光PCR方法[S]. 北京: 中国标准出版社, 2010.
[32] Iwobi A, Sebah D, Kraemer I, et al. A multiplex real-time PCR method for the quantification of beef and pork fractions in minced meat[J]. Food Chemistry, 2015(169): 305-313.
[33] Bustin S A, Benes V, Garson J A, et al. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments[J]. Clinical Chemistry, 2009, 55(4): 611-622.
[34]于雷, 姜艳彬, 王海, 等. 荧光定量PCR法的优化及其在牛羊源性成分检测中的应用研究[J]. 中国畜牧杂志, 2009, 45(24): 51-54.
[35] Dietrich M. A strategy for molecular species detection in meat and meat products by PCR-RFLP and DNA sequencing using mitochondrial and chromosomal genetic sequences[J]. European Food Research & Technology, 2006, 224(2): 209-217.
[36] Irene M, Teresa G, Violeta F, et al. Detection of horse DNA in food and feedstuffs using a polymerase chain reaction assay[J]. Journal of the Science of Food & Agriculture, 2009, 89(7): 1202-1206.
[37] 海小, 刘国强, 罗建兴, 等. 基于TaqMan实时荧光PCR检测鲜肉及加工肉制品中的驴源性成分[J]. 肉类研究, 2018, 32(04): 62-66.
[38] 郭梁, 郭元晟, 钱俊平, 等. 基于TaqMan实时荧光PCR檢测肉制品中羊源性成分[J]. 江苏农业学报, 2018, 34(04): 938-942.
[39] 郭梁, 徐伟良, 钱俊平, 等. 牛源性成分鉴定的引物和探针[J]. 食品研究与开发, 2018, 39(16): 153-157.
[40] 林彦星, 张彩虹, 阮周曦, 等. 实时荧光定量PCR检测畜禽肉制品中鸭源性成分[J]. 动物医学进展, 2016, 37(11): 48-53.
[41] 金萍, 丁洪流, 李培, 等. 实时荧光PCR快速筛选食品中鸭源性成分[J]. 食品工业科技, 2013, 34(18): 61-63.
[42] 史艳宇, 刘金华, 吴月丹, 等. 荧光定量PCR方法检测畜肉食品中鸭源性成分[J]. 食品安全质量检测学报, 2013(06): 1859-1864.
[43] 张驰, 邱皓璞, 张筠. 荧光定量PCR检测肉制品中鸭源性成分[J]. 食品科学, 2013, 34(18): 154-157.
[44] 张秀平, 苗丽. 实时荧光聚合酶链式反应检测肉制品中的鸭源性成分[J]. 肉类研究, 2018(07): 37-41.
[45] 程欣. 应用实时荧光PCR方法鉴别食品中的鸭源性成分[D]. 南京:南京农业大学, 2015.
[46] 董洋洋. 实时荧光PCR对牛肉中掺入鸭肉和猪肉的定量检测研究[D]. 大庆:黑龙江八一农垦大学, 2016.
(责任编辑 李媛媛)
