西伯利亚百合遗传转化高频直接分化受体体系的建立
2020-10-19冯慧敏
冯慧敏 郑 野 张 伟
(1.大兴安岭职业学院 黑龙江大兴安岭 165000;2.国家林业和草原局大兴安岭调查规划设计院 黑龙江大兴安岭165000;3.张家口市城市管理综合行政执法局 河北张家口 075000)
西伯利亚百合型美味浓,是重要的鲜切花。通过基因工程技术导入干扰花粉发育基因、抗病基因、抗衰老基因等外源基因,可以改良品质,提高百合的观赏价值[1~2]。同时,建立高效稳定的转化受体体系是西伯利亚百合转基因育种的基础。本研究意在探索适合西伯利亚百合遗传转化的受体体系[3]。
1 材料与方法
1.1 植物材料
西伯利亚百合(Lilium×siberia)无菌苗的叶片、小鳞茎的鳞片和愈伤组织。
1.2 建立西伯利亚百合的高频再生体系
实验材料处理:①幼嫩叶片,切成约0.5 cm2的小块,四周形成伤口;②直径约1.5 cm 的小鳞茎的鳞片,切掉基部可能存在潜伏芽的部位,再分成约0.5 cm2的小块,四周形成伤口;③鳞片愈伤组织,切取0.8 cm2的愈伤块。所有试材接种在分化培养基中诱导培养,每次处理 30 个样本。分化培养基为MS + NAA 0.2(单位符号为mg/L,以下均省略),添加不同浓度的BA,接种叶片和愈伤组织培养基的BA 浓度分别为0.5、1.0、1.5、2.0、2.5,接种鳞片培养基的BA 浓度分别为0.0、0.5、1.0、1.5、2.0。30 d 后统计分化情况。
再生苗高2~3cm 时转入添NAA(0.2 和0.5)的1/2MS培养基中诱导生根,45 d 后统计生根结果。当组培苗高5~6cm、根长3~5cm 时移栽到灭菌基质(蛭石∶草炭土=1∶1)中培养。
1.3 潮霉素敏感性实验
在诱导培养基中添加不同浓度的潮霉素(Hy,以下均使用简写符号)进行筛选试验,浓度梯度分别为0、30、50、60、70、80(单位符号为mg/L,以下均省略),每处理接种鳞片样本40 个(经试验确定鳞片为转化材料),培养30 d 统计分化再生情况。
2 结果与分析
2.1 西伯利亚百合高频再生体系的建立
2.1.1 不同浓度BA 对西伯利亚百合叶片再生芽诱导的影响
西伯利亚百合叶片诱导5 d 后叶色加深呈酥脆状,切口出现褐化,并随着培养时间的延长而加重。培养10 d 时多数叶块膨大变厚,褐化严重的外植体开始死亡。培养12 d接种,在高浓度BA 培养基中叶块的边缘开始分化出芽。培养20 d 时1/4 叶块分化出芽,其余外植体褐化严重失去再生能力或者已经死亡。培养30 d 时统计结果,如图1 所示,共47 个叶块分化出芽,BA 各浓度培养基(从低到高)中获得再生芽数目依次为4、5、8、17 和13,占比不到总数的1/3(共接种150 个叶块),且BA 浓度越低叶片褐化死亡率越高。较适合的叶片诱导分化培养基配方为MS +BA2.0+ NAA0.2,平均增殖系数0.67。
2.1.2 不同浓度BA 对西伯利亚百合鳞片再生芽诱导的影响
鳞片诱导5 d 后体积开始膨大,培养10 d 时低浓度BA培养基中鳞片的切口开始分化出芽或生根,17 d 时所有外植体都分化出芽或生根,并开始形成小植株。诱导30 d 鳞片丛芽分化率为100%,如表1 所示,在MS +NAA 0.2 + BA0.0(即不添加BA)的培养基中鳞片的增殖系数为1.76,再生芽的根较长,叶片的生长状态良好,是较适宜鳞片诱导分化的培养基。
2.1.3 不同浓度BA 对西伯利亚百合愈伤组织再生芽诱导的影响
愈伤组织诱导5 d 后开始增殖,至10 d 时低浓度BA 培养基中的愈伤团体积增大一倍以上;15 d 时部分愈伤开始分化出芽;20 d 时半数愈伤块分化出芽,部分愈伤团表面细胞开始皱缩老化;至30 d 时共有112 块愈伤分化出芽(共150个),生长迅速,高达3 cm,并分化生根,如表2 所示。在MS +NAA 0.2 + BA0.5 培养基中愈伤组织分化率100%,增值系数1.23,适于愈伤组织的诱导分化。
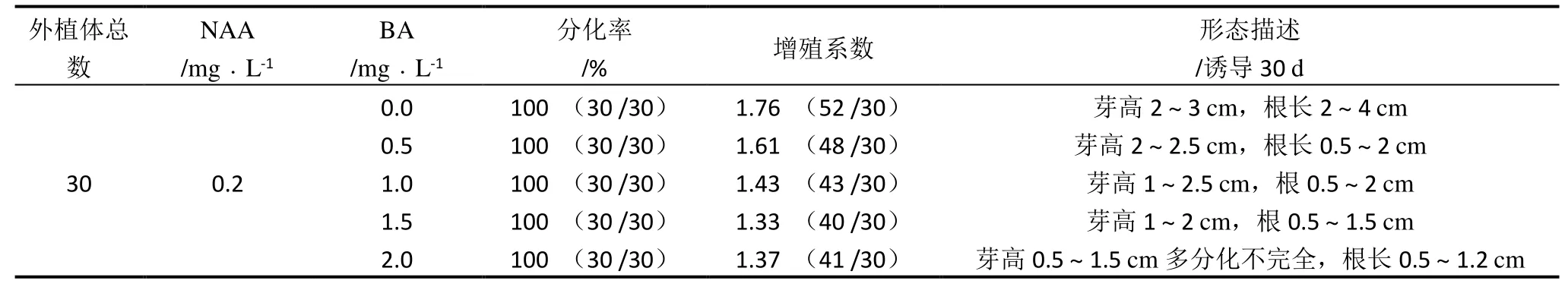
表1 不同浓度BA 对鳞片不定芽诱导分化的影响

表2 不同浓度BA 对愈伤组织再生芽诱导分化的影响
2.1.4 不同浓度NAA 对西伯利亚百合再生苗生根培养的影响
高2~3 cm 无根组培苗生根培养7 d 后开始分化生根,黄绿色,根毛呈白色。培养45 d 统计结果如表3 所示,1/2MS+NAA0.5 更适合西伯利亚百合的诱导生根,平均每株生根9个,虽然平均生根数量不是最多的,但根的质量较好,也易产生下级根,增大吸收面积,移栽成活率高达100 %。

表3 不同浓度NAA 再生苗生根(诱导45 d)和移栽的影响
2.2 潮霉素对西伯利亚百合鳞片外植体再生的影响
鳞片接种到含Hy 的培养基10 d 后开始出现褐化现象,Hy 浓度越高褐化越严重。培养30 d 后Hy 80 中的鳞片全部死亡,因此鳞片Hy 抗性选择压以80 mg/L 为宜。实验中发现Hy 不但抑制鳞片外植体的分化出芽,还强烈抑制分化生根和根的生长,培养30 d 平均根长0.6 cm,与对照平均根长2.9 cm 差异明显。
3 讨论
建立百合高频再生体系可用的外植体材料很多[4],本实验采用无菌苗的鳞片为转化材料,有以下优点:(1)有效避免材料污染和表面消毒引起的外植体褐变;(2)转化材料不受季节限制;(3)通过直接分化途径获得再生,避免愈伤组织再生发生变异[5-6];(4)再生芽多分化在切口处,利于农杆菌转染以此多获得转化植株。最后,实验发现再生芽分布在鳞片下部的居多,上部次之,两侧最少,这可能和鳞片内部的激素分布有关。
