美国FDA MAUDE数据库导尿管不良事件监测分析
2020-10-15*
*
1 河南省食品药品评价中心 (河南 郑州 450000)
2 郑州大学药学院 (河南 郑州 450000)
内容提要: 目的:对MAUDE数据库中导尿管不良事件报告数据进行研究,分析导尿管不良事件发生的风险因素,包括器械故障和患者伤害,旨在为我国导尿管风险监测提供参考。方法:通过对2015年~2018年美国FDA导尿管不良事件被动监测的数据库中5645份导尿管不良事件报告进行统计分析。结果:导尿管不良事件器械故障主要为球囊问题、漏尿、漏液和导尿管脱落;患者伤害主要为感染和损伤。结论:建议相关部门完善指导原则;增强企业责任意识;促进导尿管不良事件报告信息有效性和完整化;健全不良事件发生后,后续结果处理反馈机制,保障患者权益。
我国自1988年由卫生部启动不良反应试点工作,至今在药品和医疗器械上市后不良反应监测取得了一定的成绩[1]。根据原国家食品药品监督管理局现国家药品监督管理局发布的《国家医疗器械不良事件监测年度报告》,由2012年收到的23548份不良事件报告到2018年收到的406974份不良事件报告,反映出我国医疗器械不良事件报告意识不断增强,报告收集能力有效提升[2]。但相较于美国,我国医疗器械风险上市后不良事件监测起步较晚,在不良事件收集反馈方面的信息化和专业化相对于美国还有一定的差距。FDA建立了较为完备的药物警戒和医疗器械风险管理体系,设立药品评价和研究中心(CDER)、生物制品评价和研究中心(CBER)、医疗器械和辐射健康中心(CDRH),并分别负责药品、生物制品和医疗器械的评价和风险管理,还下设国家毒理学研究中心,承担FDA安排的上市前、后的药品、生物制品和医疗器械产品的安全性评价研究工作[3]。本文拟在通过对美国不良事件数据库中导尿管的不良事件监测数据进行研究,为我国医疗器械有关于导尿管不良事件的评价分析提供参考。
1.数据收集
从美国FDA数据库MAUDE中导出2015年01月01日~2018年12月31日导尿管不良事件5645例。将导出的CSV文件用Excel进行汇总,做为数据源进行分析。

表1. 2015年~2018年美国FDA数据库导尿管不良事件情况表(n)

图1. 2015年~2018年美国导尿管不良事件报告数量
2.数据分析
2015年~2018年美国FDA不良事件数据库共收集了5645份,器械故障和患者伤害情况如下表所示。
表1和图1可以看出美国不良事件趋势变化,相较于2016年,2017年和2018年导尿管不良事件收集数大幅度增加,导尿管不良事件主要为器械故障,患者伤害发生率相对于器械故障发生率较低;同时可以看出美国不良事件报告主要由生产企业报告,2018年为97.81%。这可能是由于2017年美国FDA要求医疗器械生厂商和进口商,通过FDA电子提交网关,提交电子版强制性原始和补充不良事件报告。导尿管作为临床常见医疗器械品种,在适应症范围内使用一般情况下不会出现重大并发症,如出血导致死亡等。一旦发生此种情况应是患者疾病本身或手术所致,导尿管不是主要原因。
2.1 根据生产企业分类
表2中列举了2015年~2018年美国FDA数据库中导尿管不良事件发生数排名前8的生产企业,其中巴德公司占比79.54%,其余7家公司占比17.41%,表明美国导尿管不良事件主要集中在巴德公司,可能与巴德公司在美国导尿管使用量巨大有关。
2.2 根据材质分类
一次性导尿管主要部件一般采用天然乳胶、橡胶、硅胶或聚氯乙烯(PVC)等制成。聚氯乙烯导尿管价格便宜,但对尿道和黏膜刺激性大,目前临床上应用较少[4]。
由表3可知,2015年~2018年美国FDA导尿管不良数据中主要包含四种材质导尿管:硅胶、乳胶、橡胶和银离子涂层导尿管,分别为2140、1141、300、202例,分别占导尿管不良事件数量的37.91%、20.21%、5.31%、3.58%;以及材质不详的导尿管,1862例,占比32.98%。主要是美国FDA数据库对事件描述信息太少,因此材质不详比例占比较大。其中,硅胶导尿管在导尿管不良事件中所占比例最高,乳胶导尿管在导尿管不良事件中占比第二,橡胶和银离子涂层导尿管所占比例较小,可能是因为橡胶和银离子涂层导尿管在临床中较少使用。有文献表明硅胶导尿管相较于乳胶导尿管材质柔软,生物相容性好,对尿道和黏膜刺激性小,且不易形成生物膜,发生患者伤害的风险较低,因此推测美国导尿管不良事件2017年~2018年乳胶导尿管不良事件报告数突然降低,可能是因为硅胶导尿管使用量增多,导致相应不良事件报告数增多[5,6]。

表2. 导尿管不良事件涉及生产企业情况表

表3. 美国FDA不良事件数据库 5645例不良事件导尿管材质分析(n)

图2. 导尿管不良事件报告涉及各风险表现
2.3 导尿管不良事件器械故障和患者伤害分析
由图2可知,2015年~2018年美国FDA导尿管不良事件主要为球囊问题,有1487例,占比26.30%;漏尿、漏液和导尿管脱落分别为577、499例,占10.21%、8.83%。患者伤害主要为感染和损伤,分别为371和285例,占比6.56%、5.04%。器械故障相较于患者伤害发生率较高。对导尿管不良事件进行分析研究,总结出导尿管不良事件发生的具体类型与原因主要如表3所示。
由图2和表3可知,美国导尿管不良事件,球囊问题、漏尿或漏液、导尿管脱落、排尿管道堵塞、拔出困难、插入困难、包装问题、质量问题、注入失败、设备在使用前损坏等属于器械故障,共4975例;感染和损伤属于患者伤害共656例。MAUDE数据库中对事件原因的分析较少,所以导尿管不良事件原因分析时,其他类不良事件原因不明,有978例,占比17.33%。单纯基于一份给定报告提供的信息来确定某器械和某特定不良事件之间的因果关系是很困难的,尤其当不确定事件发生时的具体情形或可疑器械尚未经过直接评估时[7]。
3.讨论
美国的FDA数据库不良事件被动监测模式对我国有一定的借鉴意义,FDA尽量做到及时更新但不能保证所有报告都不会出现延迟,建议我国完善线上数据库的建立工作[7]。
导尿管尿路感染风险主要在于使用风险,而球囊破裂、导尿管脱落、尿道损伤、插入困难和拨出困难的风险既有使用风险也有产品质量问题。建议国家局进一步完善导尿管检查和使用指导原则。
生产企业应加强质量控制,保障产品质量。美国不良事件报告主要由生产企业报告,2018年美国导尿管不良事件报告数为97.81%,我国2018年医疗器械总体生产企业报告数占比2.66%,相对于美国我国的医疗器械报告机制还需改善。因此应加强生产企业质量控制,做好风险检查评估工作,增强企业的产品保障和责任意识,强化企业上报不良事件报告机制。
美国FDA MAUDE数据库中对事件原因的分析较少,所以导尿管不良事件原因分析时不好根据给定报告提供的信息来确定某器械和某特定不良事件之间的因果关系。建议我国在收集不良事件报告中,根据导尿管风险点,促进填报信息有效性,完善导尿管不良事件填报和收集工作。
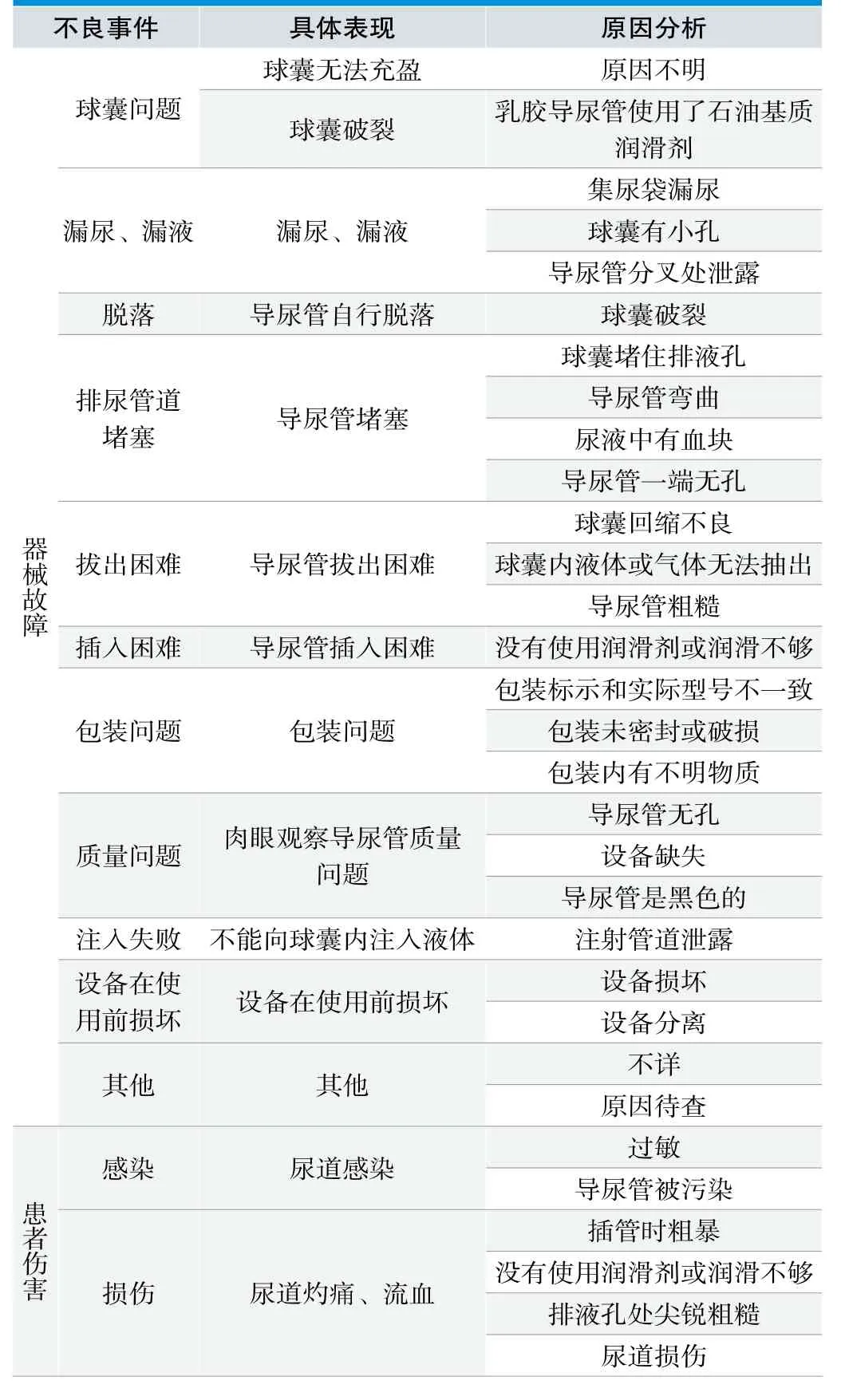
表3. FDA数据库导尿管不良事件总结
美国FDA事件后续分析调查反馈缺失,事件分析原因后没有后续处理和结果反馈。我国应建立事件分析和处理结果反馈机制,确保不良事件发生后,后续的处理结果能够得到反馈,保证患者的健康和经济权益。
