抗突变型瓜氨酸波形蛋白抗体在类风湿关节炎诊断中的应用
2020-10-12杨莉娟陈楚涛张学培马剑达李红瑰郑东辉戴冽
杨莉娟 陈楚涛 张学培 马剑达 李红瑰 郑东辉 戴冽

【关键词】抗突变型瓜氨酸波形蛋白抗体;类风湿因子;抗环瓜氨酸肽抗体;类风湿关节炎
类风湿关节炎(RA)是一种常见的慢性炎症性自身免疫性疾病,以滑膜炎和受累关节进行性、不可逆性破坏为特征,目前临床尚不能根治,因此早期诊断与早期治疗对避免RA患者病情加重、出现不可逆的关节损害尤为重要[1]。血清自身抗体是诊断RA的重要实验室指标。从最早的RF到目前临床广泛使用的抗环瓜氨酸肽(CCP)抗体都是纳入RA诊断标准的自身抗体,对RA的诊断有重要价值[2]。然而,目前即使通过联合检测RF和抗CCP抗体提高RA诊断的灵敏度,仍有10%~20%的RA患者血清中检测不到相应的自身抗体,导致这部分血清阴性的RA患者可能被漏诊[3]。因此寻找新的RA相关甚至特异的自身抗体是目前风湿性疾病领域实验室诊断的研究热点。有研究显示,瓜氨酸化波形蛋白为抗Sa抗体的靶抗原,抗突变型瓜氨酸波形蛋白(MCV)抗体属于抗环瓜氨酸抗体谱的成员之一,是一种较新的诊断RA灵敏度与特异度均较高的血清学指标[4-5]。本研究拟利用前瞻性队列中RA患者的基线血清,探讨抗MCV抗体在RA诊断中的应用。
对象与方法
一、研究对象
前瞻性队列为2014年11月至2018年7月就诊于中山大学孙逸仙纪念医院门诊及住院的RA患者,诊断符合1987年美国风湿病学会(ACR)修订的RA分类标准或2010年ACR与欧洲风湿病学会(EULAR)联合修订的早期RA分类标准[6-7]。排除合并其他风湿性疾病(如SLE、系统性硬化病、皮肌炎等)、合并严重感染、器官功能衰竭或恶性肿瘤的患者以及不愿意配合的患者。本研究获得中山大学孙逸仙纪念医院伦理委员会批准,所有参与本研究的受试者均签署知情同意书。
二、临床资料收集
收集所有患者基线的临床资料,包括年龄、性别、病程、疼痛视觉模拟评分(VAS,0~10cm)、28个压痛关节数(28TJC)、28个肿胀关节数(28SJC)、患者总体病情活动度评估(PtGA,0~10cm)、医生总体病情活动度评估(PrGA,0~10cm)、ESR(魏氏法,女性0~20mm/h,男性0~15mm/h)、CRP(散射比浊法,0~5mg/L)等,并计算病情活动度,包括28个关节疾病活动度评分(DAS28-CRP)、简化的疾病活动指数(SDAI)和临床疾病活动指数(CDAI)。根据DAS28-CRP,将RA病情活动度分为4个等级:DAS28-CRP<2.6为缓解期,DAS28-CRP2.6~3.1为低度活动期,DAS28-CRP3.2~5.1为中度活动期,DAS28-CRP>5.1为高度活动期。
三、RF、抗CCP抗体和抗MCV抗体的检测及分组
在收集所有患者临床资料的同时采集其外周静脉血5ml,分离血清、冻存。自身抗体的检测:RF采用散射比浊法检测(德国西门子公司),正常值范围为0~20U/ml。抗CCP抗体采用ELISA检测(德国AESKU公司),正常值范围为0~18RU/ml,检测浓度上限为300RU/ml。抗MCV抗体采用ELISA定量检测(德国ORGENTEC公司),正常值范围为0~20U/ml,检测浓度上限为1000U/ml。
根据2010年早期RA分类标准中的血清学评分标准,抗体水平升高但不超过3倍正常上限定义为抗体低滴度阳性,若超过3倍正常上限定义为抗体高滴度阳性[7]。因此,RF20~60U/ml定义为RF低滴度阳性,RF>60U/ml定义为RF高滴度阳性;抗CCP抗体18~54RU/ml定义为抗CCP抗体低滴度阳性,抗CCP抗体>54RU/ml定义为抗CCP抗体高滴度阳性。同时,我们将抗MCV抗体20~60U/ml定义为抗MCV抗体低滴度阳性,抗MCV抗体>60U/ml定義为抗MCV抗体高滴度阳性。
四、统计学处理
采用SPSS25.0进行统计学处理。服从正态分布的连续变量以表示。不服从正态分布的连续变量以中位数(下四分位数,上四分位数)表示。分类变量以例(%)表示,不同抗体阳性率的比较采用配对χ2检验。P<0.05为差异有统计学意义。
结果
一、RA患者的一般特征
共纳入148例RA患者,其中116例(78.4%)为女性,年龄为(46.3±12.5)岁,病程为48(12,96)月,26例(17.6%)为DAS28-CRP缓解期,122例(82.4%)为DAS28-CRP活动期,其中20例(13.5%)为轻度活动、72例(48.6%)为中度活动、30例(20.3%)为高度活动,见表1。
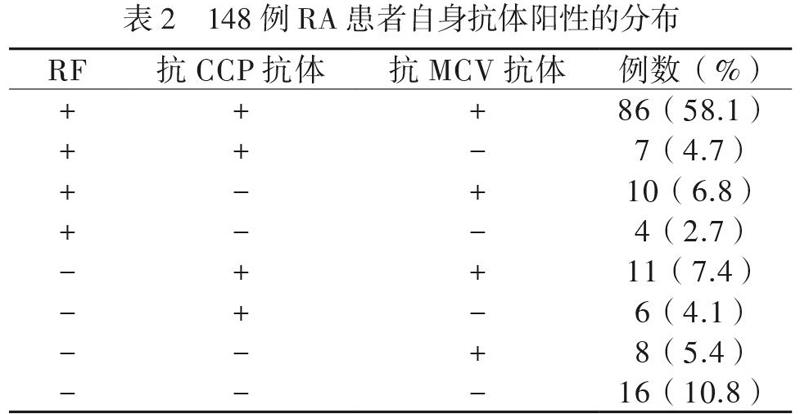
二、RA患者自身抗体阳性的分布及阳性率的比较
148例RA患者RF、抗CCP抗体和抗MCV抗体阳性的分布情况见表2,不同的RA患者3种自身抗体的阳性分布不完全一致。RF阳性率为72.3%(107/148),抗CCP抗体阳性率为74.3%(110/148),抗MCV抗体阳性率为77.7%(115/148),3组不同自身抗体阳性率组间比较差异无统计学意义(RF与抗CCP抗体阳性率比较χ2=0.129,P=0.720;RF与抗MCV抗体阳性率比较χ2=1.633,P=0.200;抗CCP抗体与抗MCV抗体阳性率比较χ2=0.516,P=0.473)。
三、抗MCV抗体对1987年RA分类标准的补充价值
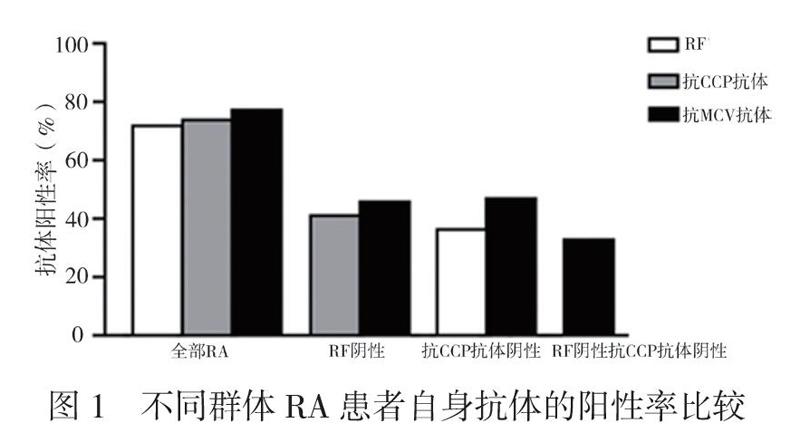
148例RA患者中,RF阴性的患者41例。在41例RF阴性的RA患者中,抗CCP抗体的阳性率为41.5%(17/41),抗MCV抗体的阳性率为46.3%(19/41),两者比较差异无统计学意义(P=0.791)。在RF阴性且再次检测抗CCP抗体仍为阴性的血清学阴性的24例RA患者中,抗MCV抗体的阳性率为33.3%(8/24),见图1。
四、RA患者自身抗体滴度的比较
148例RA患者中,RF、抗CCP抗体和抗MCV抗体的低滴度阳性率分别为19.6%(29/148)、19.6%(29/148)和12.2%(18/148)。3组不同自身抗体低滴度阳性率比较差异无统计学意义(RF与抗CCP抗体低滴度阳性率比较χ2=0.000,P=1.000;RF与抗MCV抗体低滴度阳性率比较χ2=2.564,P=0.108;抗CCP抗体与抗MCV抗体低滴度阳性率比较χ2=2.951,P=0.117)。RF、抗CCP抗体和抗MCV抗体的高滴度阳性率分别为52.7%(78/148)、54.7%(81/148)和65.5%(97/148),其中抗MCV抗体的高滴度阳性率高于RF高滴度阳性率(χ2=6.811,P=0.013)和抗CCP抗体的高滴度阳性率(χ2=4.923,P=0.036),见图2。
五、抗MCV抗体对2010年早期RA分类标准的补充价值
24例RF和抗CCP抗体均阴性的血清学阴性RA患者中,抗MCV抗体低滴度阳性和高滴度阳性的患者分别占8.3%(2/24)和25.0%(6/24)。22例RF或抗CCP抗体至少1个低滴度阳性且均无高滴度阳性的患者中,抗MCV抗体低滴度阳性和高滴度阳性的患者分别占9.1%(2/22)和59.1%(13/22),见图3。
讨论
RA是以外周关节受累为主的慢性自身免疫性疾病,发病2年即可造成关节软骨和骨质破坏,最终导致关节畸形,因此对RA进行早期诊断并采取有效治疗措施对延缓疾病进展、改善预后具有重要意义。目前诊断RA主要依靠临床表现、血清学指标及X线。然而,RA患者关节出现X线改变往往需要几个月甚至更长时间,关节软骨通常已达到不可逆损害,而在RA早期甚至在出现临床症状前血清学即可检出RA特征性或相关性的自身抗体,且血清学检测经济方便,因此血清学指标的检测对RA的早期诊断具有重要意义[2,8]。
波形蛋白是一种主要在中胚层起源的细胞中表达的细胞骨架蛋白,其在凋亡的巨噬细胞内由肽酰精氨酸脱亚氨酶的作用下发生瓜氨酸化,这个过程改变了蛋白结构并增加了其潜在的抗原决定簇瓜氨酸。波形蛋白在凋亡细胞内分解后成为核周聚集物,若不能及时清除而持续存在,则启动自身免疫应答,促使抗MCV抗体的生成。突变型的波形蛋白有额外精氨酸残基插入,增加了被瓜氨酸化的潜在位点。目前已发现有多达45个可被瓜氨酸化的位点,可以更有效地与其特异性抗体结合,提高了检测的灵敏度和特异度,因此抗MCV抗体逐渐成为一种新兴的辅助诊断RA的血清学指标[5,9-10]。
RF是最早用于诊断RA的自身抗体,RF阳性是1987年ACR修订的RA分类标准中的重要诊断指标之一,然而约25%的RA患者血清RF阴性。本研究中有27.7%的RA患者RF阴性,与既往研究相似[4,6]。RF因在其他自身免疫性疾病(如SLE、干燥综合征等)、肿瘤、结核病甚至正常的老年人群中也会出现阳性,对RA诊断的特异度较差,限制了其在临床诊断中的价值,临床需要不断开发新的特异度更高的诊断RA的自身抗体[11]。
抗CCP抗体是存在于RA患者血清中的另一类自身抗体,在RA诊断中具有与RF相似的灵敏度,但特异度更高[12]。抗CCP抗体最早可以在RA患者出现临床症状前14年的血清中出现阳性,平均在RA患者出现临床症状前4.5(0.1~13.8)年可检测到阳性,因此是RA早期诊断理想的检测指标[13]。1987年ACR分类标准主要适用于长病程的RA患者,对早期RA患者的诊断有明显的局限性。2010年的RA分类标准将抗CCP抗体和RF共同作为RA血清学诊断依据,适合于早期RA的诊断[7,14]。虽然血清RF和抗CCP抗体联合检测大大提高了RA诊断的灵敏度和特异度,仍有10%~20%的患者血清RF和抗CCP抗体均阴性,即血清学阴性RA[3]。我们的研究中有25.7%的RA患者RF阴性,16.2%的RA患者RF和抗CCP抗体均阴性,这些患者的诊断是临床的难点。
抗MCV抗体和抗CCP抗体虽然都是抗瓜氨酸蛋白抗體家族的成员,均具有抗原决定簇瓜氨酸。然而,抗CCP的抗原决定簇是人工合成的,分子量仅为波形蛋白的1/20,可被瓜氨酸化的位点少,而抗MCV抗体的靶抗原是具有多个可被瓜氨酸化的天然波形蛋白,从理论上讲较抗CCP抗体具有更高的灵敏度和特异度[15]。一项纳入了12个中心研究的Meta分析显示,抗MCV抗体对RA诊断的灵敏度为68.6%,高于抗CCP抗体的灵敏度(61.7%,P<0.001)[16]。本研究显示,抗MCV抗体在RA患者中的阳性率为77.7%,这与国外Mansour等[17]报道的抗MCV抗体对RA诊断的灵敏度79.6%的结果一致。本研究还显示,抗MCV抗体在RF阴性的RA患者中的阳性率可达46.3%,而在RF和抗CCP抗体均为阴性的血清学阴性RA患者中的阳性率也有33.3%,提示对于临床上疑似RA但目前诊断标准中推荐的血清自身抗体均阴性情况下,可进一步检测抗MCV抗体,提高RA患者的检出率,减少临床漏诊。
RF和抗CCP抗体的水平越高,与RA的相关性越大,因此2010年的RA分类标准进一步将RF和抗CCP抗体分为高、低滴度,并赋予不同的诊断分值[7,18]。在芬兰人群中进行的一项大样本队列研究中,发现抗MCV抗体在早于诊断RA前11年就可在患者血清中检测到,并且高滴度的抗MCV抗体增加了后期发展为RA的风险[19]。本研究显示,本组RA患者抗MCV抗体的高滴度阳性率可达65.5%,高于RF和抗CCP抗体的高滴度阳性率,并且在RF和抗CCP抗体均阴性(血清学评分0分)的RA患者中,抗MCV抗体低滴度阳性和高低度阳性的患者分别占8.3%和25.0%,而在RF或抗CCP抗体至少1个阳性且均无高滴度阳性(血清学评分2分)的RA患者中,抗MCV抗体低滴度阳性和高低度阳性的患者分别占9.1%和59.1%,提示进一步定量检测抗MCV抗体水平可提高对RA患者的检出率。但本研究为单中心研究,样本量偏少,结果可能存在一定的偏倚,我们拟继续扩大样本量,进一步验证抗MCV抗体对目前RA诊断的补充价值。
总之,抗MCV抗体对目前RA的诊断有一定的补充价值,尤其是对血清学阴性的患者,有望成为新的RA血清学辅助诊断指标,在临床推广应用。
