花生突变体创制与品质性状分析
2020-10-10迟晓元潘丽娟陈明娜梁成伟禹山林
迟晓元,徐 赫,许 静,王 通,陈 娜,潘丽娟,陈明娜,王 冕,孙 杰,袁 美,梁成伟*,禹山林*
(1.山东省花生研究所,山东 青岛266100;2.青岛科技大学海洋科学与生物工程学院,山东 青岛266042)
花生是我国重要的油料作物、经济作物和出口创汇作物[1]。我国花生种植面积在世界上排名第二位,产量排名第一位[2]。但是目前我国的花生品种面临着遗传基础日趋狭窄、品种过于单一化的问题,尤其是优异种质资源匮乏和过分依赖少数骨干亲本资源的问题[2-3]。变异丰富的种质资源是对农作物进行持续改良、拓宽现有品种遗传背景、避免毁灭性病虫害的物质基础[4]。因此,实现花生种质突破,培育高产优质花生新品种是花生育种工作的重要目标。
利用诱变手段创制突变种质是作物种质改良和理论研究的重要途径[5]。近几年来,一些国内学者开展了花生突变体的相关研究,主要采用的诱变方法有60Co-γ射线、快中子、离子束、激光、高能混合粒子场、EMS、硫酸二乙酯(DES)、平阳霉素等。构建了多个花生突变体库,获得了农艺性状、品质性状发生改变的花生突变体材料,包括高赖氨酸含量、高油、高油酸、耐盐性强、耐旱性强等材料,并选育了鲁花6号、花育32号、花育40号、宇花5号、宇花7号、宇花9号等花生品种[2,5-14]。
诱变具有操作简单、变异率高等特点,突变性状通常稳定较快,可缩短育种周期,加快育种进程,提高育种效率,缩短花生品种的改良进程[5]。本研究诱导产生花生突变体,研究花生的突变特性和品质性状变异情况,并对不同诱变方式的诱变效应进行分析,采用KASP方法对突变体高油酸基因型进行鉴定。本研究丰富了花生的种质资源,为培育花生优异新品种打下了坚实的基础,具有较高的应用价值。
1 材料与方法
1.1 材 料
选用花生8个品种(种质)鲁花6号(LH6)、花育19号(HY19)、花育20号(HY20)、花育23号(HY23)、花育32号(HY32)、花育33号(HY33)、四粒红(SLH)、龙花生(DP)用于突变体的创制,材料由山东省花生研究所遗传育种课题组提供。对照与处理后的花生种子在莱西花生试验基地单粒播种。
1.2 诱变方法
根据前人研究方法并进行改良,采用EMS溶液处理、60Co-γ射线和快中子辐照三种方法[5-6,13]。每种诱变方式分别处理每个花生品种(种质)900粒,以未诱变亲本作为对照。将诱变处理后的M0代种子种植于大田,对M1代进行单株收获。经过M2~M7代多年筛选后获得了一个含有1623份种质的花生突变体库。各品种(种质)突变体数目见表1。

表1花生突变体数目统计Table 1 Number of peanut mutants
1.3 品质性状检测方法
采用近红外光谱仪测定花生种子含油量、蛋白质含量、油酸含量、亚油酸含量等品质性状。以未诱变材料为对照,对照品种(种质)的品质检测结果如表2。
1.4 KASP技术SNP检测
高油酸突变体的单株叶片采用天根®高效植物基因组DNA提取试剂盒提取DNA。使用Pultton超微量紫外分光光度计、260nm波长下测定DNA样品浓度,分析质量[15]。选取合格的样品送往金玉中标记有限公司进行SNP检测。引物序列如下。
FAD2A引物:A003151-FAM:GTTTTGGGACAAACACTTCGTT;A003151-VIC:GTTTTGGGACAAACACTTCGTC;A003151-Com:CGCCACCACTCCAACACC
FAD2B引物:A003153-FAM:CAAACACTTCGTCGCGGTCT;A003153-VIC:AAACACTTCGTCGCGGTCG;A003153-Com:CCGCCACCACTCCAACACA
1.5 统计与绘图方法
利用SPSS 24软件[16]对各品质性状进行统计分析,采用Excel 2010和Adobe Illustrator CS5对其进行制表和绘图。

表2 对照花生品种(种质)的品质性状Table 2 Quality traits of the control peanut varieties (germplasms)

表3 各花生品种(种质)品质性状变异系数Table 3 Coefficient of variation of peanut quality traits/%

表4 花生品质性状的相关性分析Table 4 Correlation analysis of peanut quality traits
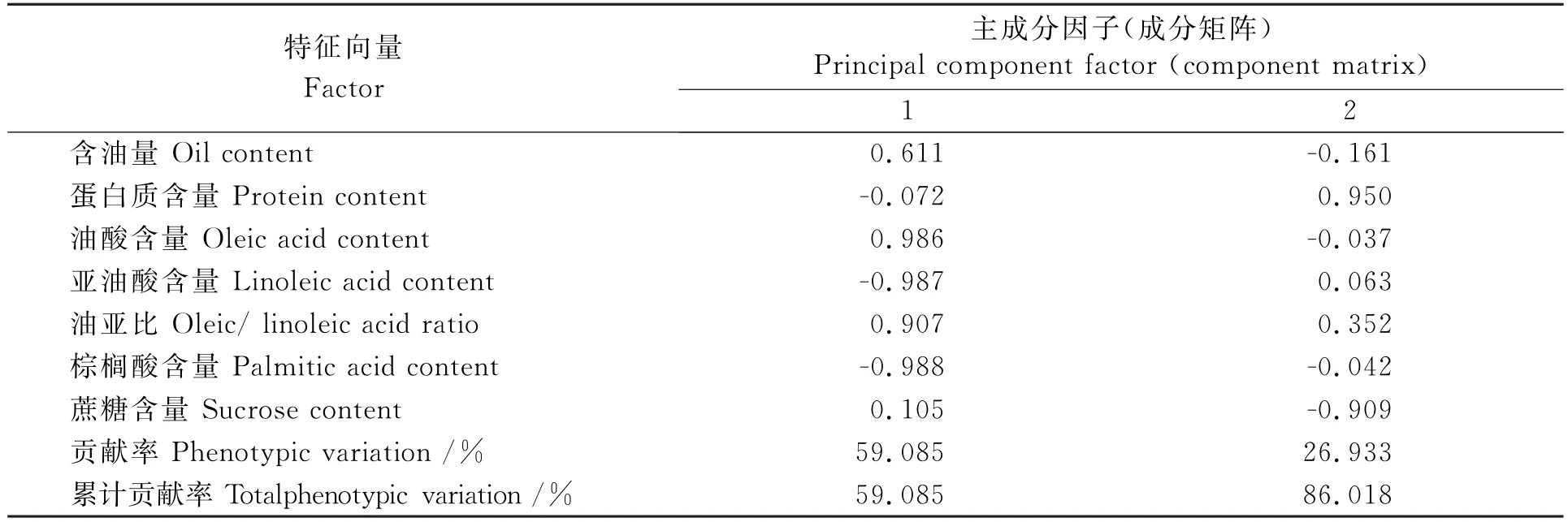
表5 花生品质性状的主成分分析Table 5 Principal component analysis of peanut quality traits
2 结果与分析
2.1 花生突变体的创制及性状变异分析
由表3可看出,鲁花6号、花育20号、花育23号、花育33号和四粒红的油亚比变异系数较大,花育19号和花育32号的亚油酸含量变异系数较大,龙花生的蔗糖含量变异系数较大。8个品种(种质)的含油量变异系数最小,蛋白质含量、棕榈酸含量次之。
以上结果表明,花育19号有4个品质性状变异系数最高,鲁花6号有3个品质性状变异系数最高。因此它们诱变产生的材料种类更全面,有利于优良品种的选择。油酸变异系数最高的为花育19号,可作为高油酸花生培育与发展的优质资源。
2.2 花生品质性状的相关性分析
由表4可看出,亚油酸含量与油酸含量、油亚比间均呈极显著负相关,相关系数分别为-0.987和-0.802;亚油酸含量与棕榈酸含量间呈极显著正相关,相关系数为0.960。油酸含量与棕榈酸含量呈极显著负相关,相关系数为-0.961,与油亚比呈显著正相关,相关系数为0.775。棕榈酸含量与油亚比呈显著负相关,相关系数为-0.745。
2.3 花生品质性状的主成分分析
对7个品质性状进行主成分分析(表5),依据特征根大于1的原则,选取了两个主成分因子,这两个主成分的累计贡献率为86.018%,因此这两大成分包括了这7个品质性状的大部分信息。第1主成分贡献率为59.085%,亚油酸、油酸、棕榈酸拥有较高的载荷数,分别为0.987、0.986、0.988。 这三种品质性状对于花生品质的分析占据主导地位,花生油品质的改良也应从此入手。其中亚油酸、棕榈酸为负效应因子,油酸为正效应因子。第2主成分贡献率为26.933%,载荷数最高的是正效应因子蛋白质为0.950,负效应因子蔗糖次之,为0.909。

图1 花生品质性状的主成分组件图Fig.1 Principal component diagram of peanut quality traits
从品质性状的主成分分析图中可看出(图1),亚油酸与棕榈酸距离很近,因此它们之间的相关性很强。油酸与亚油酸和棕榈酸距离较远且位于坐标轴的两侧,可推测出亚油酸和棕榈酸的含量会随着油酸含量的提高而降低。此外蛋白质与蔗糖距离较远且方向相反,因此可预测出蛋白质含量越高,蔗糖含量会有所下降。
2.4 花生品质性状的多元线性回归分析
以油亚比为因变量,其余6个品质性状为自变量,进行多元线性回归分析,自动剔除统计性不显著的变量,筛选出与油亚比关系密切的重要性状。得到回归方程:Y2=79.87+0.84a1-1.32a2+1.64a3-1.10a4-9.32a5(其中Y2:油亚比;a1:油酸含量;a2:含油量;a3:棕榈酸含量;a4:蛋白质含量;a5:蔗糖含量)。
2.5 花生品质性状的通径分析
油亚比是筛选高油酸花生品种的重要指标。对油亚比与5个品质性状进行通径分析,根据正负效应相互抵消的原则,品质性状对油亚比的影响:油酸含量(1.522)>棕榈酸含量(0.387)>含油量(-0.271)>蛋白质含量(-0.273)>蔗糖含量(-0.698)。
2.6 不同诱变方法对8个花生品种(种质)的影响
与对照相比,花育19号的含油量经过EMS和60Co-γ诱变后均下降。花育33号和四粒红的含油量经过快中子辐照后有所下降。其余品种(种质)含油量经过诱变后都有所升高。诱变后,含油量提高到56%以上的材料总共有337份,其中鲁花6号9份,花育19号46份,花育20号239份,花育23号26份,花育32号4份,花育33号13份。含油量提高到58%以上的材料总共有27份,其中鲁花6号1份,花育19号2份,花育20号22份,花育23号1份,花育33号1份。其中突变体T26(FSHY20-9)的含油量最高,达到59.2%(表6)。
鲁花6号的蛋白质含量经过EMS诱变后有所下降,其余品种(种质)蛋白质含量经过诱变后都有所升高。诱变后,蛋白质含量提高到28%以上的材料共192份,其中鲁花6号21份,花育19号4份,花育20号34份,花育23号2份,花育32号2份,龙花生7份,四粒红122份。蛋白质含量提高到30%以上的材料共41份,其中花育20号2份,龙花生39份。其中突变体T1622(FSSLH-53)的蛋白质含量最高,达到32.49%(表6)。
鲁花6号的油酸含量经EMS诱变和60Co-γ诱变后保持稳定,其余品种(种质)油酸含量经诱变后都有所提高。诱变后,油酸含量提高到70%以上的材料总共有161份,其中鲁花6号1份,花育19号154份,花育20号2份,花育33号3份,四粒红1份。龙花生的亚油酸含量经快中子辐照后略有升高,其余品种(种质)亚油酸含量经过诱变后都有所降低。花育32号的油亚比经过EMS诱变后有所降低。龙花生和四粒红的油亚比经快中子辐照后表现稳定。其余品种(种质)的油亚比经诱变后都有所提高。诱变后,油亚比提高到10以上的材料总共有93份,其中鲁花6号1份,花育19号86份,花育20号2份,花育33号3份,四粒红1份。
鲁花6号的棕榈酸含量经EMS诱变和60Co-γ诱变后都有所提升。其余品种(种质)的棕榈酸含量诱变后有所下降。诱变后,棕榈酸含量降到8%以下的材料有170份,其中鲁花6号2份,花育19号154份,花育20号3份,花育32号8份(≤5%),花育33号3份。T64(EMSHY32-1)和T65(EMSHY32-2)棕榈酸含量最低,为4.45%(表6)。

图2 不同诱变方法对不同品种(种质)品质性状的影响Fig.2 Mutagenic effects of quality traits of peanut varieties(germplasms)

表6 筛选出的部分花生突变体的品质性状Table 6 Quality traits of part of peanut mutants
花育19号的蔗糖含量经EMS诱变后有所升高。其余品种(种质)的蔗糖含量经过诱变后都有所下降。诱变后,蔗糖含量提高到5%以上的材料共222份,其中鲁花6号38份,花育19号152份,花育20号12份,花育23号4份,花育33号7份,龙花生8份,四粒红1份。蔗糖含量提高到6%以上的仅有15份花育19号突变体。T662(EMSHY19-60)的蔗糖含量最高,为6.61%(表6)。
2.7 Ah FAD 2等位基因的检测(KASP法)
应用竞争性等位基因特异性PCR(Kompetitive
Allele-Specific PCR,KASP)技术对花育19号的油酸含量提高突变体进行SNP的等位差异检测。发现花育19号的Ah FAD2A基因本身已发生突变,第448bp位点发生由“G”到“A”的转换,是并没有引起油酸性状的显著变化(表7)。经检测,154份花育19号的油酸含量提高突变体Ah FAD2B基因的442bp位点插入一个“A”。突变体油酸变幅66.46%~80.30%,亚油酸变幅1.29%~13.34%,油亚比变幅4.98~62.31。说明两个等位基因均突变的个体比一个基因突变的个体更能显著增加花生中的油酸含量和油亚比。
此外,根据高油酸评判标准(油酸含量≥75%和O/L比值≥10),其中有64个突变体符合高油酸花生标准。花育19号经过EMS诱变处理获得突变体8个,60Co-γ射线辐照处理获得突变体146个,说明60Co-γ射线辐照处理效果更显著。此外,与Ah FAD2A基因相比,Ah FAD2B基因活性对O/L比值的影响更大(表7)。
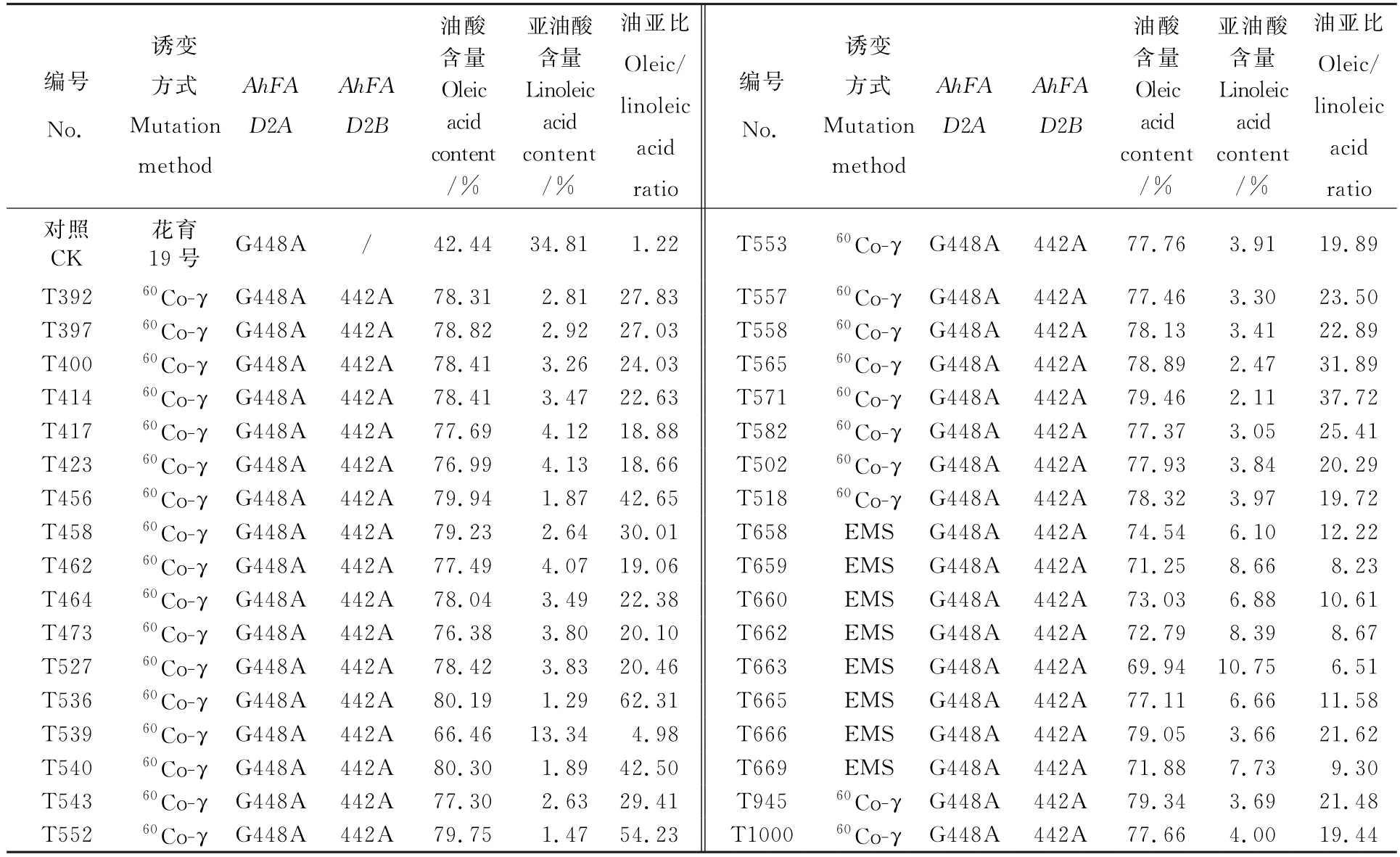
表7 部分突变体Ah FAD 2等位基因与油酸和亚油酸含量的关系Table 7 Relationship between AhFAD 2 alleles and contents of oleic acid and linoleic acid in part of peanut mutants
3 结论与讨论
种质资源的创制与开拓一直是生物育种的关键点[17]。有研究表明,群体性状的变异程度对于种质变异和创新贡献率起到显著的推动作用[18]。本研究采用三种诱变方法对8个花生品种(质)分别进行处理,诱变产生了一个含有1600余份种质的突变体库,其中花生主要品质性状表现了不同程度的变异,极大地丰富了花生的种质资源。利用SPSS软件进行数据处理,根据相关性分析、主成分分析、通径分析等一系列方法来探寻突变体的总体特性,发现了品质性状主要受两个主成分的影响,累计贡献率达到86.018%。油酸含量为品质性状最重要的直接影响因素。
根据各诱变方法对不同品质指标的影响,研究各诱变方法对不同品质性状的诱变效果,以此寻找最佳的诱变手段。本研究发现诱变能使油亚比显著提高,极大地改善花生油的品质。高油酸含量是与人类健康相关的理想特征[19],普通花生油酸含量通常约为50%左右,高油酸花生品种的油酸含量高达70%以上。据报道,花生基因组中含有两个AhFAD2基因,分别是Ah FAD2A和Ah-FAD2B,分别来自A和B基因组[20]。高油酸是AhFAD2A基因中448bp G→A碱基取代和Ah-FAD2B基因功能丧失的共同作用结果[21]。利用KASP技术对突变体进行SNP位点检测,分析Ah FAD2基因的突变位点与高油酸性状的相关性,对前人的研究结果进行验证和补充。该研究为探索今后花生育种研究提供了优质的种质材料与重要的理论参考。
