产IAA菌株的UV和DES诱变筛选及培养条件优化
2020-10-09李雅华张启航
李雅华 张启航 王 姣 安 东 刘 新
(青岛农业大学生命科学学院/山东省高校植物生物技术重点实验室/山东省重点应用真菌学实验室,山东青岛 266109)
吲哚-3-乙酸(indole-3-acetic acid,IAA)作为一种植物生长调节剂被广泛使用在农业生产上[1-2]。研究表明,许多微生物能够产生IAA[3-5],这些菌株及其产生的代谢产物对植物具有促生性[6-8]。将IAA 菌株制成菌剂施用在不同作物上,表现出多种促生性状,如增加根系总长度、根表面积、根体积和根尖数[9-11]、提高种子发芽率[12-14]和缓解盐或低氮胁迫[15-16]等。使用菌株的含IAA 代谢产物,也具有促生作用,如葛春辉等[17]用1%产IAA 菌株发酵液处理黄瓜种子,根长显著增加。因此,产IAA 菌株及代谢产物在农业生产上具有潜在的应用前景。
土壤中存在诸多产IAA 的菌株,但这些野生菌株的产量不高[18-19],仅通过分离筛选难以得到高产IAA菌株,如连翠飞等[20]通过分离筛选得到1 株产IAA 的菌株,发酵120 h 时产量仅为1.19 mg·L-1。这些菌株直接应用经济效益不佳,需对菌株进行定向选育,以获得高产IAA 的菌株。而诱变是一种有效的微生物菌种选育方法[21-23],也是选育高产IAA 菌株的有效技术手段。如李剑峰等[24]对产IAA 菌株进行微波诱变,获得突变株RSW-96,培养4 d 和24 d 后产IAA 量分别为8.38 mg·L-1和50.75 mg·L-1,较原始菌株分别提高了66.93%和50.15%。紫外(ultraviolet,UV) 诱变和硫酸二乙酯(diethyl sulfate,DES)诱变是比较常见的诱变方法,可有效提高突变株目标代谢产物的产量[25-27]。其中,UV 辐射能引起碱基转换、颠换、移码突变或缺失,DES 处理可以进行烷基置换,从而达到诱变目的。但目前将其应用到提高菌株IAA 产量的研究鲜见报道。本研究拟从烟草根际土壤分离得到的一株产IAA 并具有溶有机磷性状的根际促生菌PGPR菌株为出发菌株,采用不同剂量的UV 和DES 进行诱变选育,探索这2 种方法的诱变效果,选育遗传稳定、高产IAA,并保持溶有机磷功能的菌株。菌株分泌代谢产物除受内部遗传因子的影响外,还受外界环境因素的影响,适宜的培养条件可以显著提高目标产物产量[28-30]。因此,本研究对选育出的高产IAA 菌株进行了发酵培养条件优化,旨在进一步提高突变菌株的IAA 产量,了解菌株特性,为今后的研究应用提供基础材料及试验方法。
1 材料与方法
1.1 试验材料
编号F23 的产IAA 菌株,由青岛农业大学微生物实验室保藏。
发酵培养基:酵母粉5 g、胰蛋白胨10 g、水解酪蛋白1 g、L-色氨酸100 mg、水1 000 mL。
有机磷筛选培养基,购自海博生物技术有限公司;IAA 标准品(97%),购自国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 发酵液中IAA 含量检测 标准曲线的制作:参照张东艳等[9]的方法,以反应体系中标准品IAA 浓度为横坐标,以OD530为纵坐标制作标准曲线。
IAA 产量检测:将待测菌株按2%的接种量接种于发酵培养基,28℃摇床培养(150 r·min-1)24 h 后,测定发酵液的OD600值,并将发酵液于10 000 r·min-1条件下离心10 min,取上清液加入等体积Salkowski 比色液,避光静置30 min,测定其OD530值。根据标准曲线计算发酵液中IAA 含量,并根据OD600值,按照公式计算单位IAA 产量[9]:
单位IAA 产量=发酵液中IAA 含量/发酵液OD600值。
1.2.2 溶有机磷性能检测 将待测菌株点接在有机磷筛选培养基平板上,28℃恒温培养24 h 后开始观察,培养48 h 待溶P 圈清晰,能够准确测量时结束观察并进行测量,计算D/d 值(溶P 圈直径与菌落直径比值,D 为溶P 圈直径,d 为菌落直径)[31]。
1.2.3 菌株的诱变选育 出发菌株F23 在28℃下发酵培养15 h 左右,10 000 r·min-1离心5 min 收集菌株,用生理盐水冲洗3 次后制备菌悬液(OD600=1.0),然后进行以下诱变处理。UV 诱变:紫外灯(15 W)预热20 min,取2 mL 菌悬液放在无菌的培养皿中(内有无菌磁子),置于距紫外灯30 cm 处的磁力搅拌器上,诱变时间分别为0、1、3、5、7、9、11 min。DES 诱变[26]:不同时间的诱变处理(A):取5 mL 菌悬液加入5 mL磷酸盐缓冲液(phosphate buffer saline,PBS,pH 值7.0),然后加入10%DES(终浓度为2 mg·mL-1),28℃恒温振荡分别处理0、30、60、90、120 min,再加入2.5倍DES 体积的25%硫代硫酸钠终止反应;不同浓度的处理(B):DES 浓度分别为1、2、3、4 mg·mL-1,处理时间为30 min,其他操作同处理A。
各处理用生理盐水进行系列稀释,取0.1 mL 涂布于Luria-Bertani(LB)平板,于28℃避光培养,每个稀释度3 次重复,对照为0 min 的处理。36 h 后观察菌落生长情况并计数,计算致死率。选取致死率在85%~95%的处理,挑出单菌落,发酵24 h 后检测单位产IAA 能力。致死率和正突变率计算公式如下:
致死率=(对照菌落数-处理菌落数)/对照菌落数×100%
正突变率=性状提高的菌落数/挑取菌落数×100%。
复合诱变试验:将化学诱变筛选出的1 株菌进行紫外诱变(最佳诱变条件)。其他操作与检测方法同上。
1.2.4 诱变菌株的遗传稳定性 出发菌株具有产IAA 和溶有机磷两种促生性状,为了提高IAA 产量且不失去溶有机磷性状,制定了高产IAA 且溶有机磷性不低于出发菌株的选育目标。将诱变后所有高产IAA 菌株点接在有机磷平板上,检测溶磷性D/d值。将不低于出发菌株D/d 值的诱变菌株,继代培养3 代,每代分别发酵24 h 后10 000 r·min-1离心5 min,上清液进行产IAA 性检测,筛选高产IAA 和溶有机磷性能均遗传稳定的目标菌株;将得到的目标菌株从第4 代继代培养至第10 代,每代发酵72 h 后检测单位IAA 产量;将继代培养的第1 代和第10 代菌体点接于有机磷平板上,检测溶有机磷性能的遗传稳定性。
1.2.5 诱变菌株的发酵培养条件优化 以IAA 产量为筛选指标,对不同装瓶量(10%、15%、20%、25%、30%和35%)、初始pH 值(4、5、6、7、8 和9)、培养温度(15、20、25、30 和35℃)、接种量(1%、2%、3%、5%、10%、15%和20%)、培养时间(每隔12 h 取样一次)、色氨酸含量(0、100、200、300、400、500、600 mg·L-1) 5个因素的发酵条件进行优化。单因素优化试验基础培养条件:接种量2%、培养温度28℃、150 r·min-1振荡培养72 h。每处理3 次重复,检测发酵液中IAA 含量,前一步优化的结果用于后续试验,并对产量影响较大的4 个因子进行四因素三水平正交试验,以发酵液中IAA 产量指标OD530值为考察指标,最终确定诱变菌株的最佳发酵工艺。
1.3 数据处理
采用DPS 6.0 软件对试验数据进行统计分析。
2 结果与分析
2.1 诱变选育
经检测IAA 含量标准曲线回归方程为:y=0.032 5x+0.013 1,相关系数R2=0.997 5。
2.1.1 UV 诱变选育 UV 处理1 min 后菌株的致死率为95.3%,表明1 min 为菌株UV 诱变的最佳处理时间。挑取所有单菌落,共74 株,其中8 株产IAA 能力高于出发菌株F23(CK),正突变率为10.8%;表现优良的菌株有3 株,编号分别为UV5、UV70 和UV19,其中,UV5 的IAA 产量最高,单位产量高达26.71 mg·L-1,较出发菌株F23 提高了345.91%(表1)。
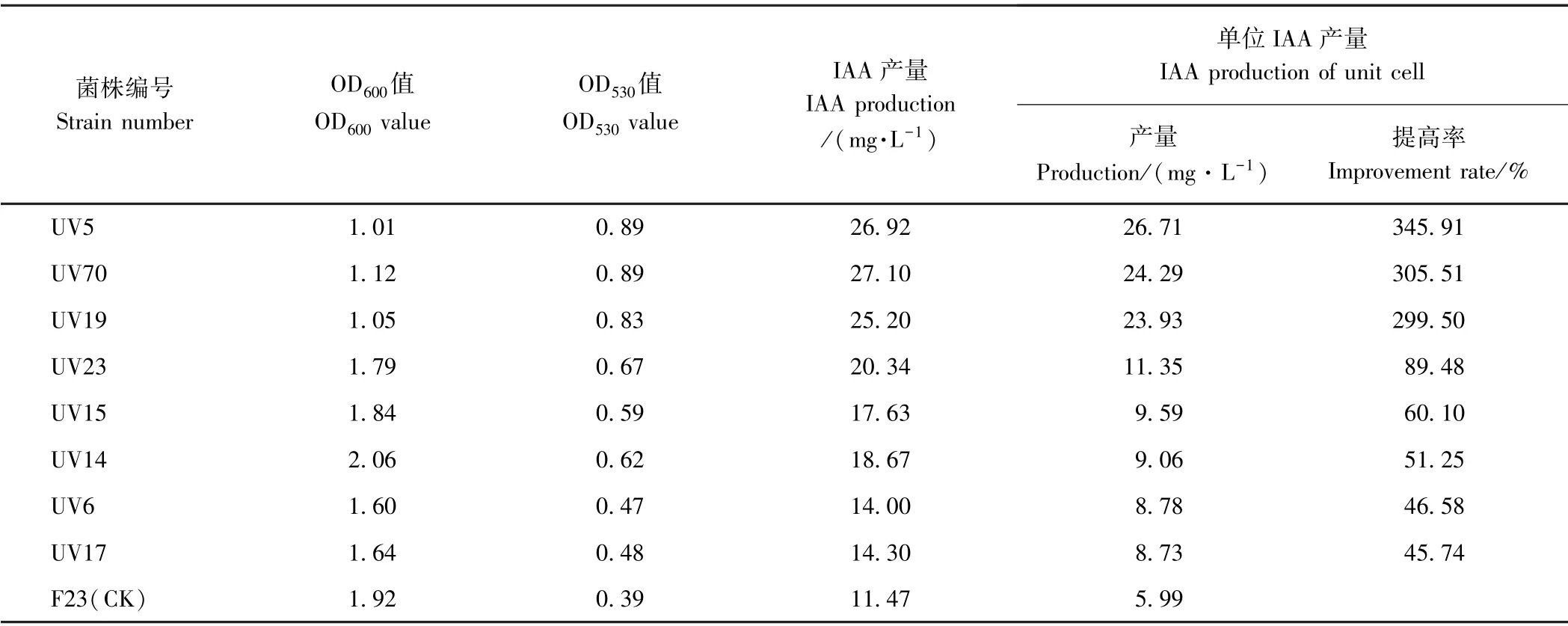
表1 UV 诱变选育的菌株产IAA 性能Table1 IAA-producing performance of strains selected by UV mutagenesis
2.1.2 DES 诱变选育 处理组A(10%DES 诱变处理不同时间)结果显示,10%DES 最适诱变处理时间为30 min,此时菌株致死率为85.6%。挑取该处理单菌落共42 株,发酵检测产IAA 能力,发现其产IAA 能力均未超过出发菌株F23(CK),正突变率为0。
处理组B(不同浓度DES 诱变处理30 min)结果显示,菌株的DES 最适诱变浓度为2 mg·mL-1,此时菌株致死率为94.1%。挑取该处理单菌落共54 株,其中3 株产IAA 能力高于出发菌株F23(CK)。正突变率为5.56%,表现优良的菌株有2 株,编号分别为H15和H42,其中,H42 的单位IAA 产量最高,达11.59 mg·L-1,较出发菌株提高了86.63%(表2)。
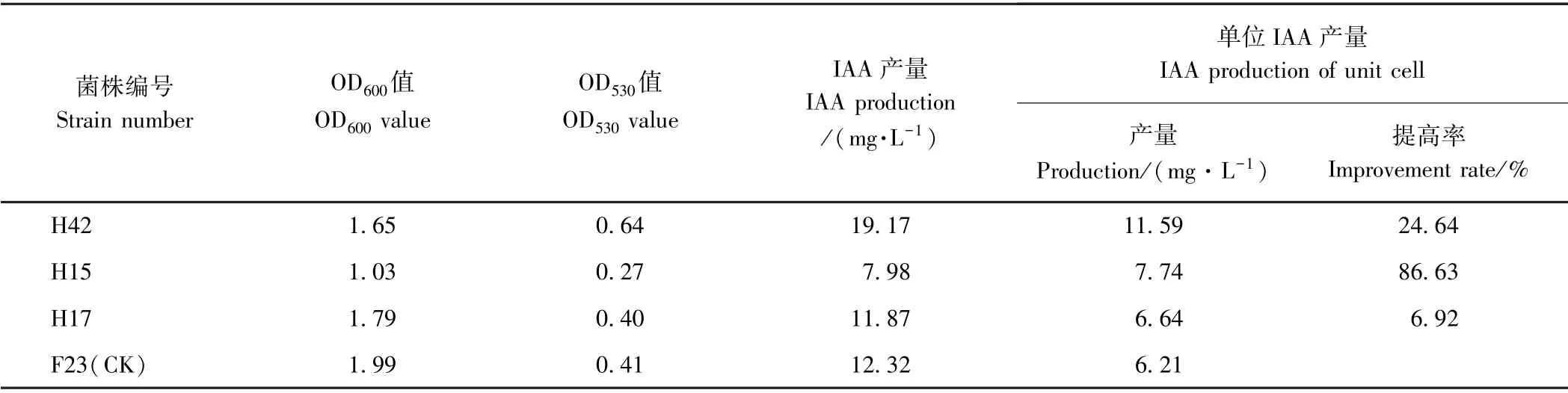
表2 DES 诱变选育的菌株产IAA 性能Table2 IAA-producing performance of strains selected by chemical mutagenesis
2.1.3 复合诱变选育 将DES 诱变得到的菌株H42进行UV 处理1 min,涂布分离得到96 株,发酵检测菌株产IAA 的能力,均未超过出发菌株F23,正突变率为0。复合诱变往往能得到更好的突变株,如薛应钰等[32]对一株溶磷菌进行复合诱变得到了溶磷性更强的突变株,而本研究没有得到溶磷性更强的突变体,其原因可能与菌株遗传背景和诱变条件有关。
2.2 诱变菌株的遗传稳定性
将UV 诱变得到的8 个菌株和DES 诱变得到的3个菌株接种到有机磷平板上,培养48 h 后D/d 值≥出发菌株D/d 值的有3 株,编号分别是H42、UV19 和UV70。将此3 株菌继代培养2 次(培养48 h),检测结果表明,H42 和UV70 产IAA 性能逐代下降,且UV70的溶磷性能也逐代降低,而UV19 的产IAA 性能和溶磷性能均比较稳定(表3)。因此,筛选UV19 为目标菌株继续进行遗传稳定性检测。
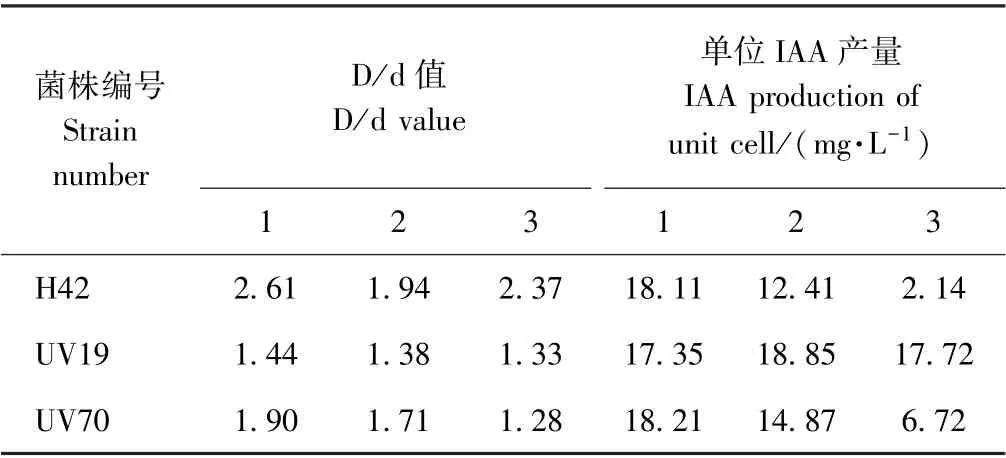
表3 诱变菌株不同代数的功能性状表现Table3 Functional traits of genetic algebra of mutagenized strains
UV19 经10 代继代培养,发酵培养72 h 后,将每代进行IAA 产量检测,结果显示,UV19 从第4 代到第10 代IAA 产量在32.34 ~33.77 mg·L-1之间。方差分析表明,各继代之间无显著性差异(图1)。将第1 代和第10 代分别点接到有机磷平板上,其D/d 值分别为1.42 和1.32,无显著性差异。综上表明,UV19 遗传性状稳定。
2.3 菌株UV19 的培养优化
2.3.1 单因素试验结果
2.3.1.1 装瓶量对菌株UV19 IAA 产量的影响 由图2-A 可知,不同装瓶量对菌株UV19 IAA 产量有极显著影响,随着装瓶量的增加,菌株单位IAA 产量逐渐减少。当装瓶量为10%时,单位IAA 产量最高,为34.1 mg·L-1,故后续试验采用10%的装瓶量。在转速一定的条件下,装瓶量是影响发酵体系供氧的重要因素,各处理每降低5%的装瓶量,菌株UV19 的生物量及单位IAA 产量显著提高,说明该菌株对氧需求较高。
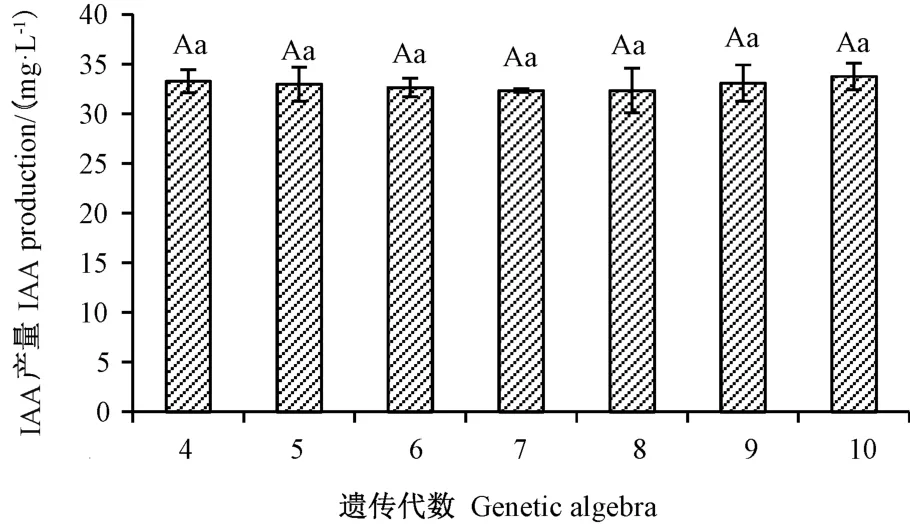
图1 菌株UV19 不同继代的IAA 产量分析Fig.1 IAA production analysis of different generations of strain UV19
2.3.1.2 培养基初始pH 值对菌株UV19 IAA 产量的影响 由图2-B 可知,培养基不同初始pH 值对菌株UV19 IAA 产量有不同影响,培养基初始pH 值为4、5的酸性条件下菌株几乎不生长,单位IAA 产量极低;初始pH 值为8 时,菌株单位IAA 产量最高,为37.15 mg·L-1,高于初始pH 值为6、7 和9 时的IAA 产量,但与初始pH 值为7 和9 时无显著差异。可见,酸性、强碱条件不利于菌株UV19 生产IAA,而弱碱性条件有利于菌株生产IAA。因此,后续试验培养基的初始pH值为8。
2.3.1.3 培养温度对菌株UV19 IAA 产量的影响由图2-C 可知,不同培养温度对菌株UV19 IAA 产量影响不同,高温不利于生产IAA。培养温度为20 ~30℃时,各温度下菌株IAA 产量无极显著差异;培养温度大于30℃,IAA 产量显著下降,培养温度为35 和40℃时菌株的生长及IAA 产量均极显著低于其他处理;培养温度为20℃时,菌株UV19 的IAA 产量最高,为43.63 mg·L-1,说明菌株在温度较低时可以高效分泌IAA,这将有利于菌剂在生产上的应用。但因其与培养温度为25、28℃时无显著差异,因此,综合考虑,后续试验采用25℃作为菌株的培养温度。
2.3.1.4 接种量对菌株UV19 IAA 产量的影响 由图2-D 可知,接种量为1%~10%时,菌株单位IAA 产量无显著差异;接种量为15%时,菌株单位IAA 产量显著减少;接种量为3%时,菌株单位IAA 产量最高,为44.57 mg·L-1。因此,后续试验采用的菌株接种量为3%。
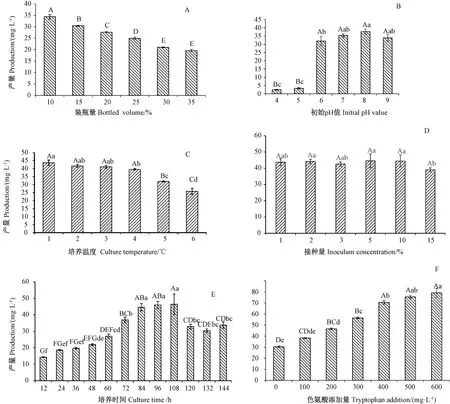
图2 各单因素对菌株UV19 IAA 产量的影响Fig.2 Effect of single factor on IAA production of strain UV19
2.3.1.5 培养时间对菌株UV19 IAA 产量的影响由2-E 可知,随着培养时间的延长,菌株UV19 的IAA产量呈现先上升后平稳再下降的趋势。培养时间小于108 h 时,随着培养时间的延长,菌株UV19 IAA 产量逐步增加,但培养时间为84、96、108 h 时菌株IAA 产量无显著差异,分别为44.61、45.99 和46.42 mg·L-1;继续延长培养时间,菌株的IAA 产量显著下降。因此,后续试验采用84 h 作为菌株UV19 的培养时间。
2.3.1.6 色氨酸添加量对菌株UV19 IAA 产量的影响 由图2-F 可知,随着色氨酸添加量的增加,菌株IAA 产量逐渐增加。方差分析表明,色氨酸添加量分别为0、100、200、300 与400 mg·L-1处理组IAA 产量有极显著差异;色氨酸添加量为500 mg·L-1时,IAA 产量与色氨酸添加量为400 mg·L-1有显著差异,与色氨酸添加量为600 mg·L-1无显著差异,分别为70.46、75.48和79.13 mg·L-1;未添加色氨酸时,菌株UV19 也能够产生一定量的IAA,但显著低于添加200 mg·L-1以上色氨酸的处理组。因此,适量添加发酵底物色氨酸可以提高菌株IAA 产量。
2.3.2 正交试验结果 根据单因素试验结果,选出4个对菌株UV19 IAA 产量影响较大的因素,即培养基初始pH 值、色氨酸添加量、培养温度和培养时间。按10%装瓶量、3%接种量设计四因素三水平L9(34)正交试验(表4)。正交试验的设计及结果见表5,正交试验极差分析见图3。
正交试验结果表明,4 个因素对IAA 产量的影响大小依次为色氨酸添加量>培养时间>初始pH 值>培养温度。极差分析表明,最佳组合为A2B3C2D2,即初始pH 值8、培养温度25℃、培养时间96 h、含600 mg·L-1色氨酸的LB 培养基。而单因素试验表明,培养基中色氨酸添加量为500~600 mg·L-1时,菌株单位IAA 产量无显著差异,因正交试验组合中没有A2B2C2D2组合,因此,将最佳A2B3C2D2、A2B2C2D2及A1B1C1D1组合进行验证,结果显示,组合A2B3C2D2和A2B2C2D2的OD530值分别为0.561 和0.489,差异不显著,说明色氨酸添加量为500 或600 mg·L-1对菌株的IAA 产量无显著影响。这与单因素试验结果相符。此外,A2B3C2D2与A1B1C1D1的OD530值(OD530=0.151)有显著差异,说明正交试验结果正确。
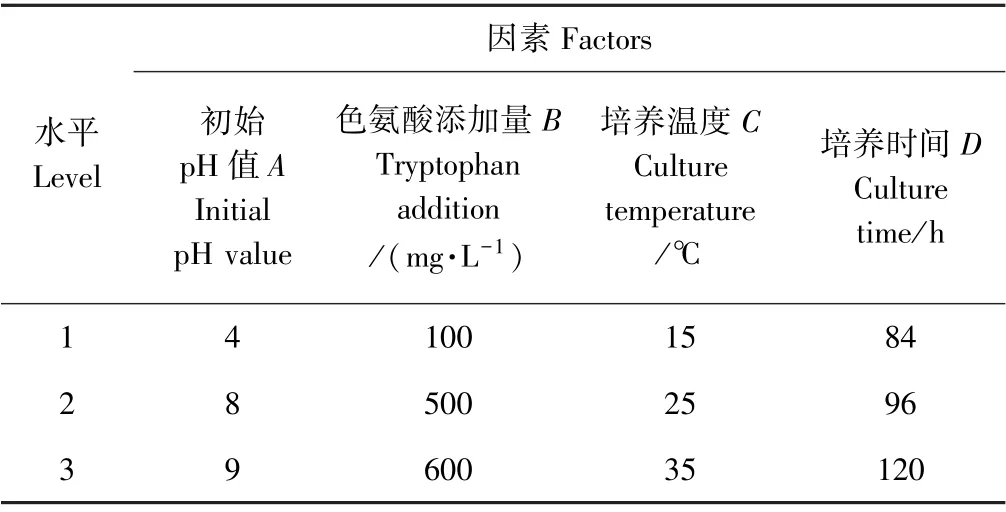
表4 L9(34)正交试验设计与水平Table4 Design and level of L9(34) orthogonal test
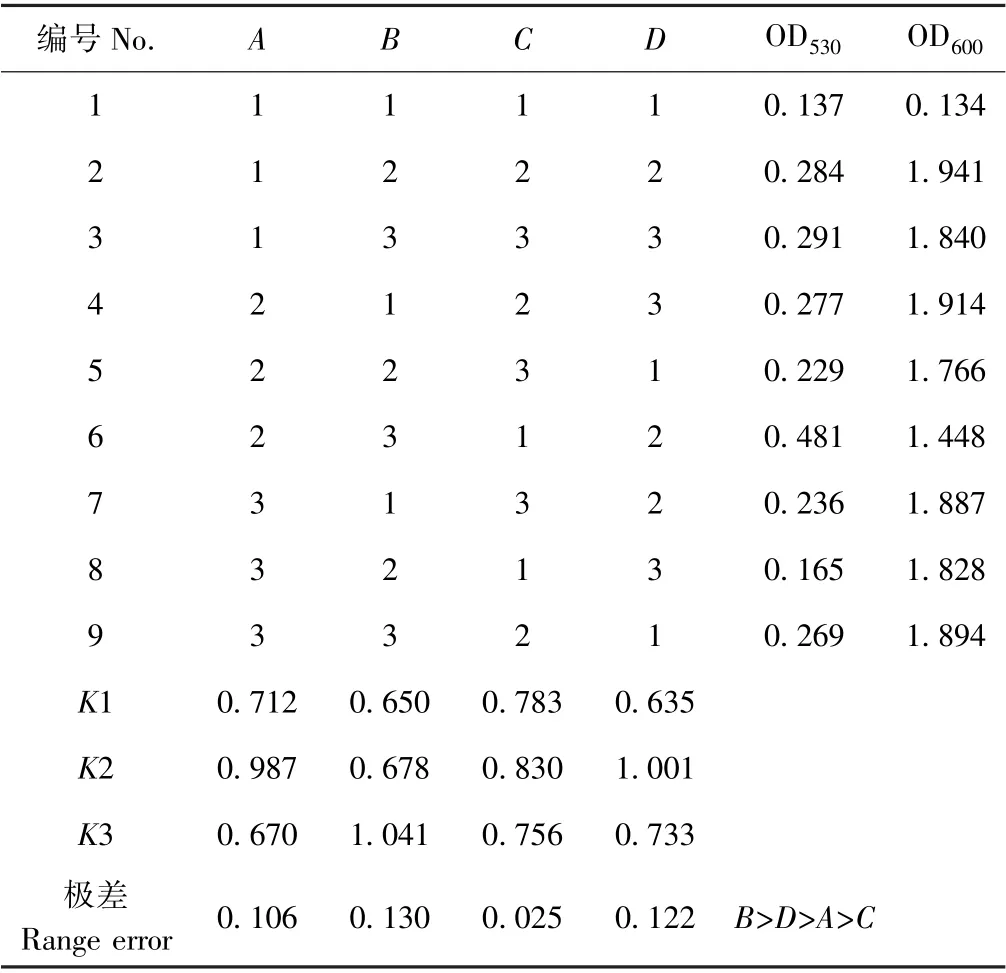
表5 正交试验结果Table5 The result oforthogonal experimental
综上,单因素试验及正交优化试验结果表明,菌株UV19 产IAA 的最适培养条件:装瓶量10%、接种量3%、初始pH 值8、培养温度25℃、培养时间96 h、色氨酸添加量500 mg·L-1,此条件下,菌株IAA 产量为75.47 mg·L-1,为优化前菌株IAA 产量的2.23 倍,为出发菌株F23 IAA 产量的12.6 倍(图4)。
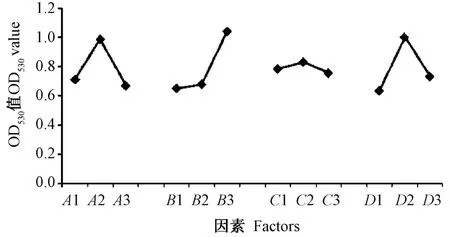
图3 菌种UV19 在各因素各水平处理下相对IAA 产量的极差图Fig.3 Range diagram of relative IAA production of strain UV19 under different factors and levels
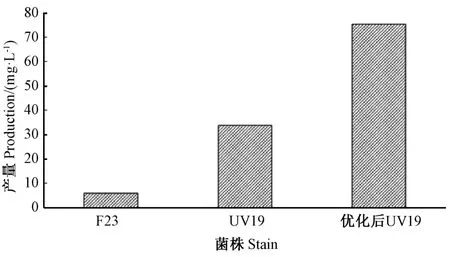
图4 出发菌株F23、突变株UV19 及优化后UV19 的IAA 产量Fig.4 IAA production of starting strain F23,mutant strain UV19 and optimized strain UV19
3 讨论
根际产IAA 菌株作为根际促生菌的一类,近年来有关该类菌株的研究报道较多,但大多集中在通过分离筛选来获得高产IAA 菌株方面,有关通过诱变选育来提高其IAA 产量的研究较少[24]。本研究用UV 和DES 诱变方法对菌株F23 进行选育,发现这2 种方法均能够得到高产IAA 的菌株。其中,UV 诱变得到的突变株UV19 IAA 产量较出发菌株提高了299.48%;DES 诱变得到的突变株H42 IAA 产量较出发菌株提高了86.63%。就菌株F23 而言,UV 诱变比DES 诱变更容易得到目标菌株。在诱变选育中,通过复合诱变往往能获得更好的诱变效果[27]。而本试验在DES 诱变后尝试用UV 诱变1 min 进行复合诱变,但未得到目标菌株,其诱变条件有待进一步研究。
对菌株进行发酵条件优化,在得到最适培养条件的同时,也能了解菌株的生物特性。本研究在优化时发现培养基中色氨酸添加量是影响菌株UV19 IAA 产量的最重要因素。菌株UV19 在没有色氨酸存在时也能产生IAA,但添加色氨酸后其IAA 产量显著提高。生物合成生长素有依赖色氨酸途径和非依赖色氨酸途径[33-34],微生物可以利用色氨酸产生IAA[35-36],推测菌株UV19 可能存在多种合成途径。初始pH 值对菌株IAA 产量也有较大的影响[37],酸性和强碱环境均不利于菌株UV19 产生IAA,因此UV19 作为菌剂可能较适宜应用于中性或偏碱性土壤;在培养温度为20 ~30℃时,菌株UV19 的IAA 产量无显著差异,说明其培养温度范围较宽,这对今后农业生产应用及工业生产极为有利。目前,IAA 生产主要采用化学方法,由吲哚、甲醛与氰化钾在150℃、0.9~1.0 MPa 下反应生成3-吲哚乙腈,再在氢氧化钾作用下水解生成,或由吲哚与羟基乙酸反应而得[38-39],需要高温高压的生产条件,且会产生大量有害废液。如能采用生物发酵法生产,不仅可以降低成本,而且不会对环境造成污染。
4 结论
UV 诱变和DES 诱变均能有效提高菌株F23 的IAA 产量,且UV 诱变比DES 诱变更为有效。UV 诱变获得1 株高产IAA 并遗传稳定的菌株UV19,其IAA产量为出发菌株F23 的299.48%;发酵优化可显著提高其IAA 产量,在最适条件下菌株UV19 单位IAA 产量达75.47 mg·L-1,为优化前的2.23 倍。本研究结果表明,发酵法生产IAA 在理论上是可行的,这为菌肥及生物发酵法生产IAA 提供了基础材料,下一步将对菌株发酵液中的IAA 进行提取、纯化技术研究。
