响应面法优化土茯苓多糖除蛋白工艺
2020-09-28邱昆成谢致宽谢裕彬
李 聪,邱昆成,谢致宽,谢裕彬,朱 伟*
(1.广州中医药大学第二临床医学院,广东 广州 510120;2.广州中医药大学中药学院,广东 广州 510006)
土茯苓是百合科光叶菝葜(Smilax glabraRoxb.)植物干燥根茎,具有解毒、除湿、通利关节的功效[1]。土茯苓含有生物碱、黄酮类、糖类等多种成分,具有抗炎、镇痛、抑菌等药理活性[2]。其中,具有免疫调节[3]、抗炎[4]等活性的多糖类成分逐渐被人们重视。然而,多糖的提取纯化过程繁琐,除蛋白是多糖纯化过程中的重要步骤,土茯苓多糖提取工艺、脱色纯化已有报道[5—6],但是土茯苓多糖除蛋白工艺未见报道。
Sevage法条件温和,具有适用性广、经济和快速等优点,是多糖溶液去除游离蛋白质的经典方法。Sevage法利用蛋白质与有机试剂接触后变性从而形成胶状杂质的原理,通过离心将其分离除去,但是一般需要反复处理样品多次,每次除去变性的蛋白胶状物时,多糖可能随着蛋白一起沉淀而损失;此外,有机溶剂在溶解杂质后变得黏稠,同样会在分离时造成部分多糖损失[7—8]。因此,优化多糖除蛋白工艺,对减少多糖纯化过程中的损失,提高多糖纯度具有重要意义。目前多糖除蛋白研究大多仅以蛋白清除率为指标进行优化[9—10],而忽略了除蛋白过程中多糖的损失。本实验以蛋白清除率和多糖保留率为指标,通过Sevage试剂法去除土茯苓粗多糖溶液的游离蛋白,在单因素实验的基础上运用响应面分析法对土茯苓多糖除蛋白工艺进一步优化,以期为土茯苓多糖的深入研究和开发提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 药材
土茯苓中药饮片购自康美药业股份有限公司(批号:160505781),经广州中医药大学第二临床医学院袁小红主任中药师鉴定为百合科光叶菝葜(Smilax glabraRoxb.)干燥根茎,符合2015版《中国药典》的规定。
1.1.2 主要试剂与仪器
考马斯亮蓝 G250购自源叶生物科技有限公司(批号:L10A10G85391)。葡萄糖标准品购自大连美仑生物技术有限公司(批号:M0509AS)。牛血清白蛋白标准品购自美国 MP Biomedicals 公司(批号:0218054991)。正丁醇、三氯甲烷、硫酸、重蒸苯酚均为分析纯,购自广州化学试剂厂。
电子调温电热套(天津市泰斯特仪器有限公司);离心机(北京京立);全波长酶标仪(EonC);涡旋振荡器(Vortex genie2 scientific industries);万分之一分析天平(德国Sartorius)。
1.2 方法
1.2.1 土茯苓多糖提取
称取土茯苓药材1 kg,加入 6 L纯水回流提取3次,每次2 h,将提取液合并,用纱布过滤并浓缩至1 L,然后加入95%乙醇至含醇量80%于4 ℃静置过夜,离心,将沉淀用水复溶再次醇沉,一共醇沉3次,然后离心并将沉淀用超纯水定容至300 mL,用时稀释 10倍作为土茯苓多糖供试液。
1.2.2 多糖及蛋白质含量测定
精密称取葡萄糖标准品5.05 mg以及牛血清白蛋白标准品 10.03 mg,分别用超纯水定容至5 mL和 50 mL,分别得到1.01 mg·mL-1葡萄糖标准品溶液和200.6 μg·mL-1牛血清白蛋白对照品溶液。将两种标准品溶液逐级稀释配制成系列对照品溶液,葡萄糖对照品的质量浓度依次为10.1、20.2、30.3、40.4、50.5、60.6、80.8 μg·mL-1,牛血清白蛋白对照品的质量浓度依次为1.003、5.015、20.06、50.15、60.18、70.21 μg·mL-1,然后以苯酚硫酸法检测葡萄糖[11],考马斯亮蓝法检测蛋白质[12]。分别以葡萄糖和牛血清白蛋白浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,计算多糖保留率和蛋白清除率。

1.2.3 单因素实验
以蛋白清除率和多糖保留率为指标,确定Sevage试剂:供试液(V/V)、振摇强度、振摇时间和除蛋白次数的最优参数。振摇强度由斡旋振荡器不同挡位控制(可控挡位1~10挡),基本的除蛋白工艺为:Sevage试剂:供试液1:5,振摇挡数6挡,振摇时间 10 min,除蛋白次数 5次,除蛋白后以3000 r·min-1离心10 min取上清液,测定土茯苓多糖和蛋白浓度,计算蛋白清除率和多糖保留率。
单因素实验中,Sevage试剂与供试液的比例设1:5、1:4、1:3、1:2,以斡旋振荡器设4挡、6挡、8挡、10挡振摇,振摇时间设为5、10、15、20 min,除蛋白次数设3、5、7、9次,分析其对多糖保留率以及蛋白清除率的影响。
1.2.4 响应面实验设计
通过单因素的实验,以 Sevage试剂:供试液、振摇强度、振摇时间、除蛋白次数为设计因素,采用Design Expert 8.0.5b分析软件中Box-Behnken方案,设计出4因素3水平实验。设计因素水平及编码见表1。
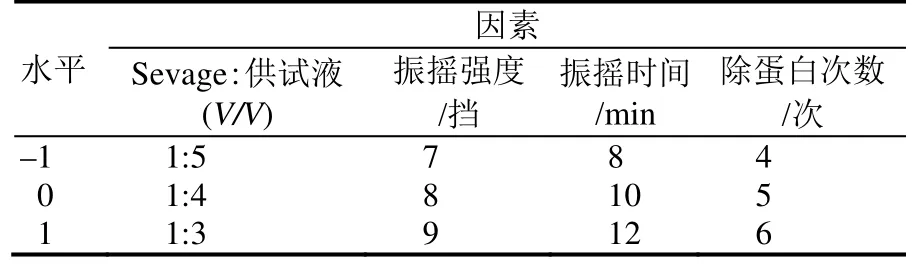
表1 Box-Behnken试验设计因素与水平编码Table 1 Coding of Box-Behnken test design factors and levels
2 结果与分析
2.1 多糖含量及蛋白质含量标准曲线
按照1.2.2项绘制标准曲线,得到葡萄糖标准曲线Y=0.0067X+0.0086(R2=0.9996)、蛋白标准曲线Y=0.0042X+0.23(R2=0.9991)。
2.2 单因素对多糖保留率及蛋白清除率的影响
2.2.1 Sevage试剂与供试液比例
从图 1: A中可以看出,随着多糖供试液中Sevage试剂的增加,多糖保留率先上升后下降,在Sevage试剂:供试液为1:4处有最大值;蛋白清除率则先保持平稳然后升高。这可能是增加Sevage试剂,除蛋白的效率增加,故多糖保留率增加,当Sevage试剂达到一定比例后,植物蛋白呈凝胶样大量析出,同时也导致部分多糖被包裹除去,Sevage试剂:供试液为1:3、1:2时多糖保留率显著降低。因此,Sevage试剂与多糖供试液的最佳比例为1:4。
2.2.2 振摇强度
由图1: B可知,随着振摇强度增加,土茯苓多糖保留率先上升,在8挡处有最大值,然后显著下降;蛋白清除率从4挡到10挡均无明显变化。故振摇强度为斡旋振荡器8挡最佳。
2.2.3 振摇时间
由图1: C可知,随着振摇时间延长,土茯苓多糖保留率先升高后下降,然后再上升,因为振摇时间增加,Sevage试剂与供试液接触更加充分,植物蛋白凝胶初步形成时包裹的多糖被释放,故多糖保留率增加。继续振摇,植物蛋白凝胶均匀分布,类似于形成乳剂对多糖重新包裹,导致多糖保留率降低。而振摇时间达到一定程度,乳剂被破坏,多糖保留率再次上升。当振摇10 min和20 min时,多糖保留率最高,而蛋白清除率从5 min到20 min一直呈降低的趋势,虽然振摇20 min时多糖保留率比振摇10 min略高,但是蛋白清除率亦明显下降,所以最佳振摇时间为10 min。
2.2.4 除蛋白次数
由图1: D可知,当除蛋白次数逐渐增加,多糖保留率先逐渐降低然后保持平稳,蛋白清除率逐渐增加然后保持平稳。因此,除蛋白次数过多并不能增加蛋白清除率,而多糖保留率降低到一定程度便不再受除蛋白次数的影响。当除蛋白次数为5次时,多糖保留率较高,而蛋白清除率达到最高水平,故5次为除蛋白最佳次数。
2.3 响应面法优化土茯苓除蛋白工艺结果
2.3.1 Box-Behnken实验设计与回归模型建立
在单因素实验的基础上,以Sevage试剂与供试液比(A)、振摇强度(B)、振摇时间(C)、除蛋白次数(D)四个因素进行响应面分析。根据Box-Behnken实验设计原理,设计四因素三水平共计27组实验,其中24个析因实验,3个中心实验,实验设计及结果如表2所示。
利用Design-Expert8.0.5b实验软件对表2实验数据进行回归方程拟合分析,得到以多糖保留率(Y1)和蛋白清除率(Y2)为响应值的二次多项回归方程为:

分别对多糖保留率和蛋白清除率的回归模型及各参数的显著性进行验证。在多糖保留率为响应值的模型分析里,模型的P值为0.9819>0.05,模型不显著;多糖保留率的回归方程系数为A=0.6838、B=0.9263、C=0.8690、D=0.6383,均大于0.05表明Sevage试剂与供试液比、振摇强度、振摇时间、除蛋白次数四个因素对多糖保留率的影响不明显。在蛋白清除率为响应值的模型分析里,模型的P值为0.0033<0.05,R2=0.8600,失拟项P=0.0671>0.05,表明模型显著,拟合程度较好,模拟的失拟程度不显著。蛋白清除率的回归方程系数D=0.0233<0.05,除蛋白次数D对响应值影响显著(表3)。
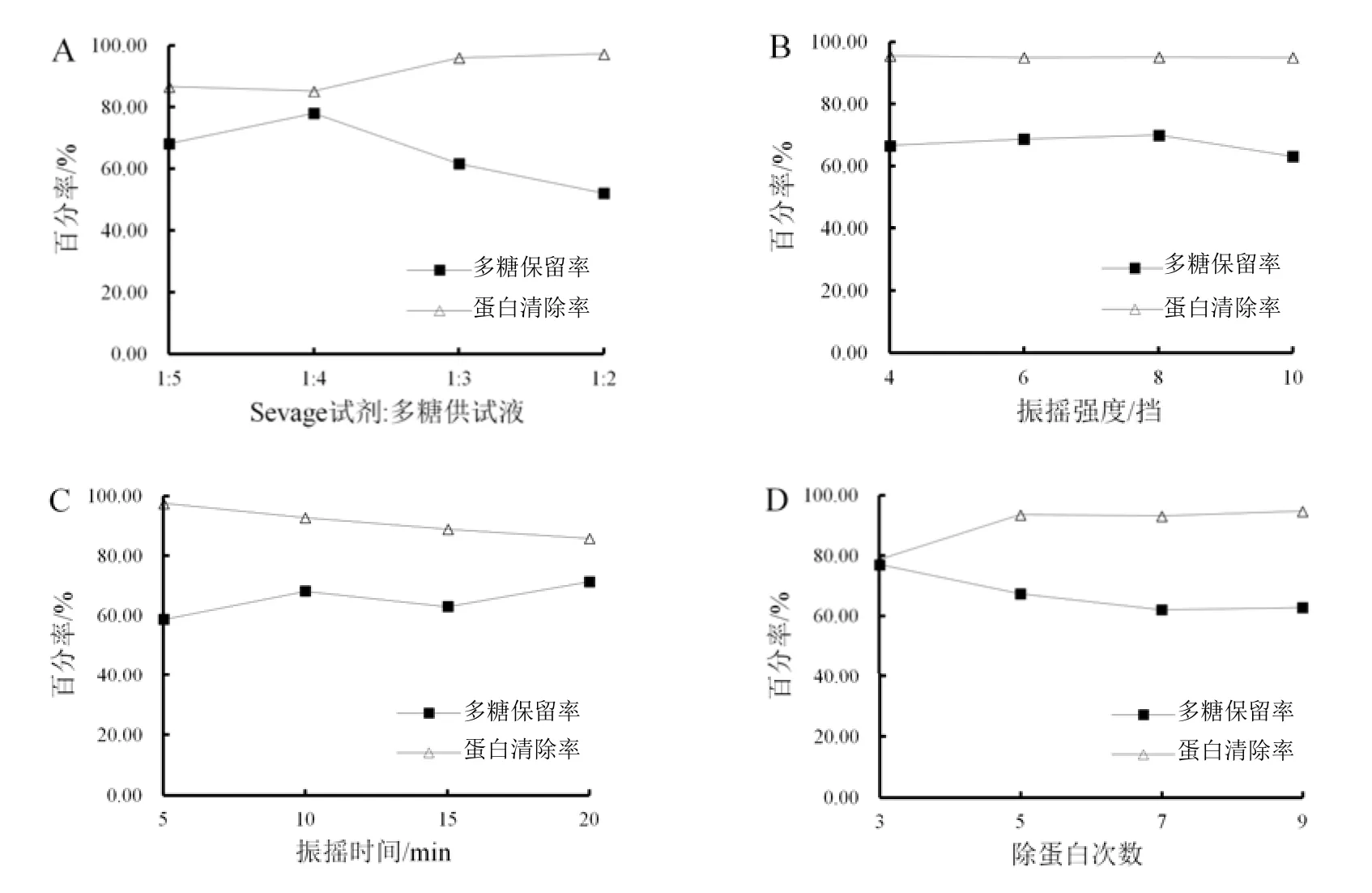
图1 不同因素对土茯苓多糖保留率及蛋白清除率的影响Fig. 1 Effects of various factors on the deproteinization efficiency and retention rate of polysaccharides extracted from Smilax glabra Roxb.
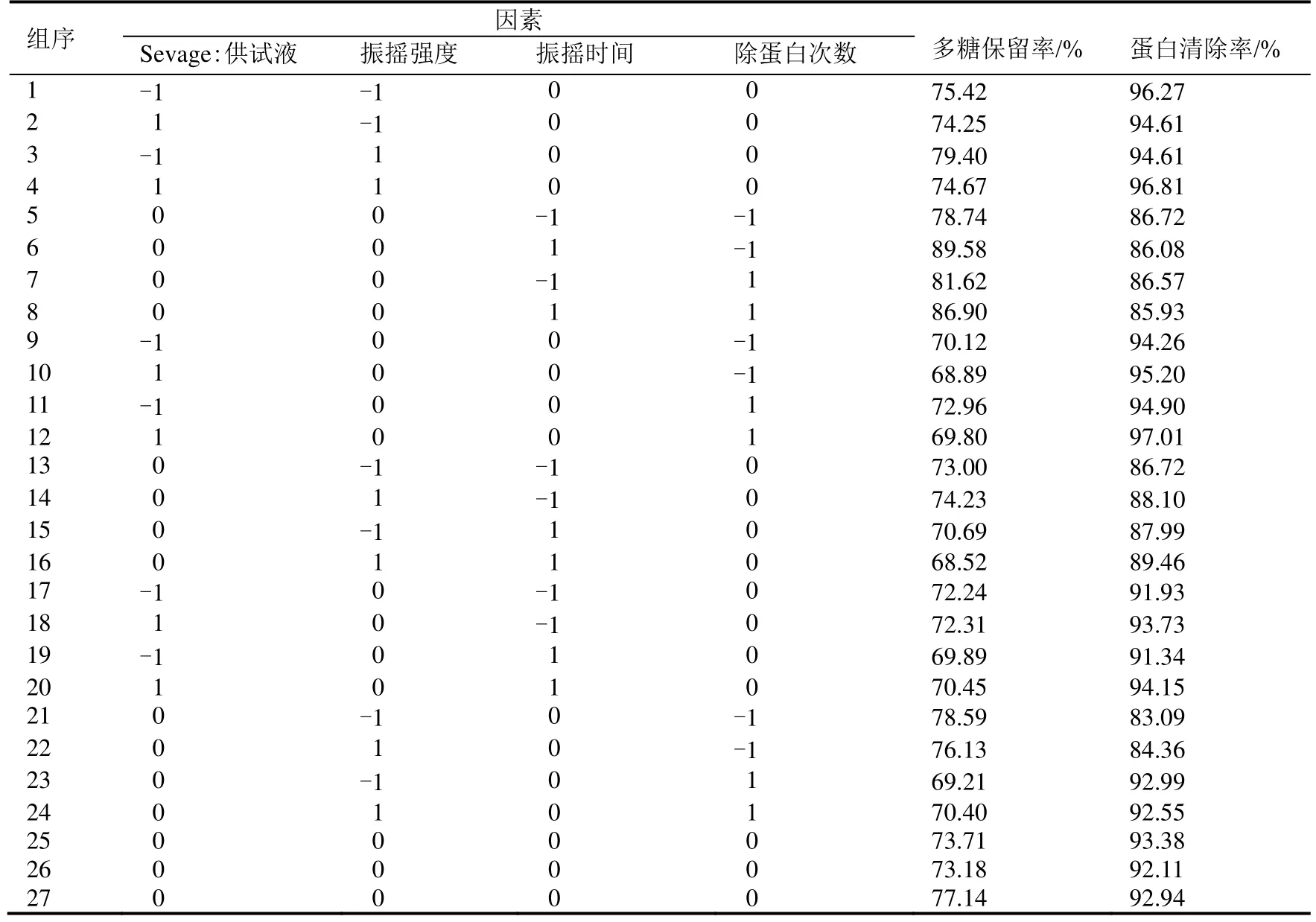
表2 响应面实验设计及结果Table 2 The response surface experiment design and results
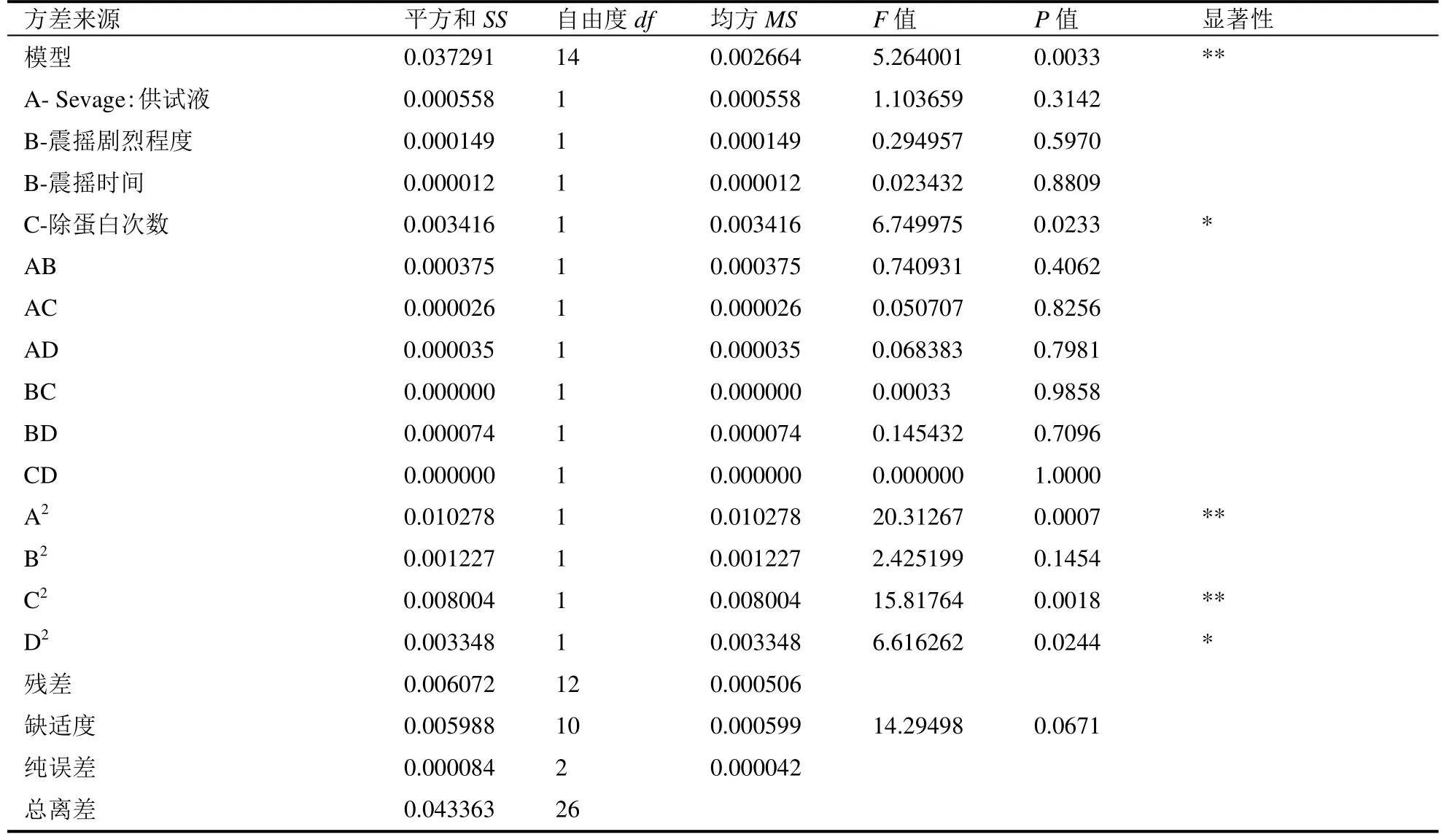
表3 蛋白清除率为响应值的回归模型方差分析Table 3 The ANOVA of regression model with deproteinization efficiency as response value
2.3.2 响应面优化工艺分析
利用 Design-Expert 软件绘制出交互项的响应值的三维表观图(图2)。由图可知,曲面陡峭程度较大,振摇强度和振摇时间以及除蛋白次数两两间交互作用显著。图2: a和图2: c表明蛋白清除率随着振摇时间、振摇强度、振摇次数的增大,呈先增大后减小的趋势,曲面陡峭程度较大,在优化区域内存在最大值。由图2: b可知,蛋白清除率随着振摇次数的增加,振摇次数越多,振摇强度对蛋白清除率的影响越明显。优化的最佳除蛋白工艺条件为Sevage试剂:供试液=1:3、振摇强度 8.38挡、振摇时间10.09 min、除蛋白次数5.37次,最终蛋白清除率为98.50%。
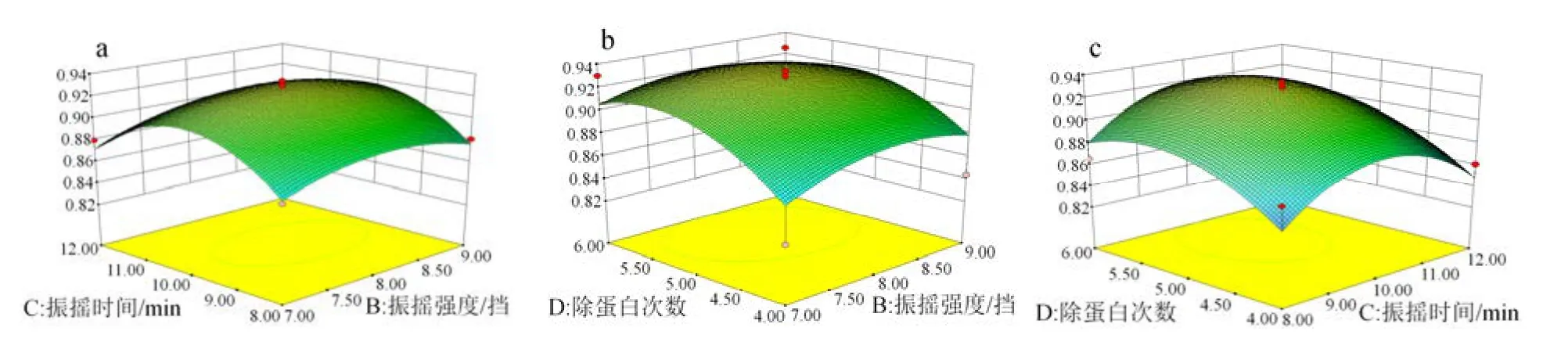
图2 各因素交互作用对土茯苓多糖溶液蛋白清除率的响应面图Fig. 2 The response surface map of the interaction of various factors on the deproteinization efficiency of Smilax glabra Roxb.polysaccharide
2.4 验证实验
为验证实验的准确性和回归模型的可靠性,参考模型得出的最佳除蛋白工艺,实际操作中,采用Sevage试剂:供试液=1:3、振摇强度8挡、振摇时间10 min、除蛋白次数5次。平行3组实验,取平均值,蛋白清除率为97.39%,与理论值相差1.11%,相差较小,重复性好,说明该回归模型稳定可靠,可用于指导土茯苓多糖除蛋白,此条件下多糖保留率为74.13%。
3 讨论
中药多糖是当前研究热点,其提取方法虽然较多,但是在提取过程中都会将植物蛋白一并提取,而除蛋白的过程十分繁琐,添加的试剂比例和除蛋白次数等因素,不仅会影响除蛋白效率,同时会对多糖含量造成损失,降低多糖纯化效率,增加纯化成本,不利于多糖的大规模开发应用。优化除蛋白的工艺对于提高多糖纯度、增加多糖药理活性、提高多糖纯化效率、节省试剂降低成本具有重要意义。
本实验中多糖保留率的响应面模型不够显著,说明除蛋白过程中的步骤对多糖造成的损失有限。然而单因素实验表明,Sevage试剂与供试液比、振摇强度、振摇时间和除蛋白次数对多糖保留率确有一定的影响,优化后的土茯苓多糖除蛋白工艺,振摇强度8挡、振摇时间10 min、除蛋白次数5次与单因素实验结果相符,蛋白清除率和多糖保留率均处于较高水平。在单因素实验中,Sevage试剂:供试液为1:4时,多糖保留率最高为78.02%、蛋白清除率仅85.16%;Sevage试剂:供试液为1:3时,蛋白清除率高达96.03%,但多糖保留率只有61.58%。当除蛋白工艺优化之后,Sevage试剂与供试液的最优比例为1:3,与Sevage试剂:供试液为1:3的单因素实验相比,蛋白清除率提高1.36%,达97.39%,土茯苓多糖保留率达74.13%,提高12.55%;和Sevage试剂:供试液为1:4的单因素实验相比,多糖保留率只降低3.89%,但是蛋白清除率提高12.2%。由此可见,优化土茯苓多糖除蛋白工艺,对于提高蛋白清除率,增加多糖保留率效果显著,为土茯苓多糖的深入研究和开发奠定了基础。
