沟叶结缕草遗传转化体系的建立
2020-09-26王凯汪毅曲爱爱王蕊郭海林李晓慧佘建明宗俊勤李建建刘建秀
王凯 汪毅 曲爱爱 王蕊 郭海林 李晓慧 佘建明 宗俊勤 李建建 刘建秀


摘 要:为构建有效的沟叶结缕草遗传转化体系,以沟叶结缕草愈伤组织为受体材料,通过农杆菌介导法将笔者单位克隆的耐盐相关基因ZmPDI基因转入野生型植株中,研究共培养时间、侵染液浓度、侵染时间和抗生素浓度等因子对转化效率的影响。结果表明:最佳遗传转化体系为菌株OD600值为0.4,侵染30 min,共培养3 d后进行选择培养。特美汀在选择培养阶段最适抑菌浓度为250 mg/L,潮霉素愈伤组织筛选的最适选择压力为40 mg/L,苗筛的最适浓度为15 mg/L。通过GUS活性的组织化学分析和PCR鉴定,显示目的基因已成功转入沟叶结缕草基因组中。
关键词:沟叶结缕草;蛋白二硫键异构酶(PDI);根癌农杆菌;遗传转化
中图分类号:S688.4 文献标识码:A
Abstract: Zoysia matrella is a perennial warm-season turfgrass, one of halophytes with the salt-tolerantce, and is widely used in temperate zone and subtropical regions. However, its complete genetic transformation system have not been reported. In this study, the callus from Z. matrella was used as receptor material and the genetic transformation of the salt-tolerant gene ZmPDI was carried out by Agrobacterium-mediated method to study a series of conditions for transformation efficiency including the co-culture time, concentration of the infection, and infection time. The results showed that the optimal genetic transformation was supposed to be: agrobacterium concentration OD600 = 0.4, infected for 30 minutes, co-cultured for 3 days and then followed by selective culture. During the whole process, the optimum concentration of timentin in the postponed culture medium was 250 mg/L. As for hygromycin, the optimal selection pressure for callus was 40 mg/L, while the best concentration for rooting screening was 15 mg/L. The histochemical analysis of β-glucuronidase (GUS) activities and PCR identification indicated that the ZmPDI gene was transferred into the genome by hygromycin resistance selection.
Keywords: Zoysia matrella; PDI; Agrobacterium tumefaciens; genetic transformation
DOI: 10.3969/j.issn.1000-2561.2020.08.009
溝叶结缕草(Zoysia matrella)是禾本科(Gramineae)画眉草亚科(Choridoideae)结缕草属的多年生暖季型草坪草,同时也是盐生植物,广泛分布于温带亚热带。随着生物技术的飞速发展,转基因技术已经成熟,可以对特定的靶基因进行遗传转化以缩短育种周期。在植物转基因方法中,农杆菌介导的方法因其高转化效率,易于使用和低成本而成为优选的方法。迄今为止,这种方法在结缕草属中也已经成功。据报道,Kang等[1]将Zjchi2基因导入结缕草胚性愈伤组织中,得到了转基因植株;马彩云[2]利用农杆菌介导法将DREB基因转入青岛结缕草;代小梅[3]将ZjGA20ox基因转入日本结缕草;Li等[4]将CBF1基因转入中华结缕草。然而,目前,有关沟叶结缕草遗传转化的研究报道极少,仅见于沟叶结缕草抗草甘膦遗传转化初步研究中,以沟叶结缕草愈伤组织为试验材料,经农杆菌侵染后,在含有2、3、5 mmol/L草甘膦的筛选培养基上各4周,再生16周,共得到54粒愈伤组织出现绿色小苗,但其再生苗尚未鉴定,所以遗传转化体系并不完整[5]。
蛋白二硫键异构酶(protein disufide isomerase,PDI)属硫氧还蛋白亚家族成员,是内质网中一种重要的折叠催化剂,能通过氧化活性(催化蛋白形成二硫键)和异构酶活性(催化错误配对二硫键的重排)来改变蛋白内部结构进而促进蛋白的正确折叠[6]。研究发现水稻中PDI基因的功能缺失表现出粉状胚乳的特征[7-8];在拟南芥中PDI家族一个成员AtPDI6突变能够诱导叶绿体中D1蛋白的合成,从而缓解了强光胁迫下的光抑制现象[9]。然而,在结缕草中关于PDI的研究很少。仅在本单位的前期工作中,使用盐胁迫处理下的沟叶结缕草作为材料构建了全长cDNA表达文库,转化酵母细胞后经耐盐筛选获得了一个编码蛋白二硫键异构酶基因ZmPDI(NCBI登录号:KM265179)。盐胁迫下沟叶结缕草中ZmPDI的表达显著上调[10]。ZmPDI基因如何调控沟叶结缕草耐盐性,其机制尚不清楚。
为了阐明ZmPDI基因对沟叶结缕草耐盐性的分子调控机制,本研究以沟叶结缕草愈伤组织为外植体材料,利用农杆菌介导法将ZmPDI基因导入沟叶结缕草基因组中,探究菌株浓度、侵染时间和共培养时间等因素对农杆菌介导的沟叶结缕草转基因效率的影响,以期建立农杆菌介导的沟叶结缕草遗传转化体系,为沟叶结缕草的包括ZmPDI基因在内的基因功能和分子育种研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料与载体菌株 植物材料为沟叶结缕草匍匐茎诱导的愈伤组织,根癌农杆菌为EHA105(Agrobacterium tumefaciens),载体质粒为pCAMBIA1305.2(含GUS报告基因及潮霉素Hyg筛选标记)。
1.1.2 生化试剂及酶 预混型DNA聚合酶Premix Taq? Version 2.0(TaKaRa公司);DNA分子量标准DNA adder Marker(TaKaRa公司);质粒提取试剂盒AxyPrepTM Pasmid Miniprep Kit(天根生化科技有限公司);新型广谱植物基因组DNA快速提取试剂盒(北京原平皓生物技术有限公司);特美汀Timentin、卡那霉素Kan、利福平Rif、潮霉素Hyg、乙酰丁香酮(AS)(北京索莱宝科技有限公司);GUS染色试剂盒(北京华越洋生物科技有限公司);引物合成及测序均由通用生物系统(安徽)有限公司完成;常规化学药品及试剂均为国产AR级分析纯。
1.1.3 培养基的配制 试验用基本培养基成分见表1。
1.2 方法
1.2.1 试验材料诱导、继代和预培养 由沟叶结缕草匍匐茎诱导产生愈伤组织,其诱导和继代培养参照Chai等[11]的方法进行。转化前,材料在继代培养基上培养1周。
1.2.2 抑菌剂浓度和抗生素筛选压的确定 抑菌剂特美汀(Timentin)浓度确定:参照Zhang等[12]的方法并加以调整,将经农杆菌菌株侵染30 min的愈伤组织,分别放置于含Timentin的愈伤组织继代培养基上,设6个试验梯度,分别为0、100、150、200、250、300 mg/L,每梯度设3个重复,30 d后记录数据,确定最佳抑菌剂浓度。
潮霉素(Hyg)筛选浓度的确定:参照Wu等[13]的方法并加以调整,首先进行预试验,将沟叶结缕草愈伤组织放置于继代培养基(含Hyg)上生长,设5个试验梯度0、20、30、40、50 mg/L,处理25 d后移至分化培养基,30 d后记录数据,确定愈伤组织初筛浓度。将分化苗放置于生根培养基(含Hyg),设5个试验梯度0、5、10、15、20 mg/L,20 d后记录数据,确定分化苗初筛浓度。接下来对经农杆菌侵染后的沟叶结缕草愈伤组织进行上述操作(培养基均含有Timentin),确定潮霉素最佳筛选浓度。
统计外植体分化率和成苗率,以上每梯度重复3次。
分化率=完成分化愈伤组织数/总愈伤组织数× 100%;成苗率=分化苗数/总苗数×100%。
1.2.3 转化条件的探索 探索最优的转化条件时,参照代小梅[3]的方法并加以调整。
菌株浓度的确定:浸染外植体时,菌株浓度(OD600)分别是0.2、0.4、0.6、0.8。
菌株侵染时间的选择:浸染外植体时,侵染时间为10、20、30、40 min。
共培养时间的确定:浸染外植体时,共培养时间设为1、2、3、4 d。
根据GUS活性的组织化学分析结果记录蓝色愈伤组织数,每梯度重复3次。
转化率=GUS染色蓝色愈伤组织数/愈伤组织总数×100%
1.2.4 农杆菌介导的沟叶结缕草愈伤组织遗传转化 将放置于80 ℃的菌株(含有50%甘油)在室温下解冻后[14],在YEP固体培养基(含50 mg/L Kana和50 mg/L Rif)划板培养,培养条件为28 ℃,48 h,挑取单克隆接种于5 mL YEP+ 50 mg/L Kana+50 mg/L Rif液体培养基震荡培养,培养温度为28 ℃,200~220 r/min震荡20~24 h,取上述培养的菌株800~1000 μL,加入到25 mL含YEP+50 mg/L Kana+50 mg/L Rif液体培养基中,28 ℃,220 r/min培养5~6 h,待菌株OD600为0.5左右时,取25 mL放入50 mL管中,室温下4000 r/min,离心10 min。弃上清,再向离心管加入侵染液将菌株调至OD600为0.4(约109个/ mL),加入100 μmol/mL AS用于侵染。
参考张丽[5]、张芳等[15]的方法,对转化过程加以改进。将预培养的愈伤组织放置于菌液(菌株OD600为0.4)浸染30 min,(25±2)℃,暗处理3 d。共培养后先转入含250 mg/L Timentin和40 mg/L Hyg筛选培养基培养20 d。之后在光照条件下轉入含250 mg/L Timentin分化培养基上生长。切取长至3 cm左右的幼苗,转入含250 mg/L Timentin和15 mg/L Hyg苗筛选培养基培养20 d,将得到抗性苗经炼苗栽入花盆移至户外生长(以上培养基见表1)。
1.2.5 抗性植株的PCR检测和GUS活性分析 取抗性苗及未转化再生苗的叶片,使用DNA快速提取试剂盒提取植株叶片DNA。通过PCR扩增HPT基因,序列为:HPT-F:5-GAAAAAGCCT GAACTCACCGC-3;HPT-R:5-TGCTCCATAC AAGCCAACCAC-3;预期片段大小为729 bp。模板是转化苗叶片DNA,阳性对照是质粒PcamBIA1305.2,阴性对照是正常再生苗叶片DNA。扩增体系为:12.5 μL Premix Taq,1 μL DNA模板,HPT-F和HPT-R(20 μmol/L)各1 μL,去离子水补足25 μL。扩增条件为:98 ℃预变性3 min;98 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。
取侵染后的愈伤组织放入配好的GUS染色工作液中,用锡箔纸包裹,在37 ℃孵育24 h,用70%乙醇脱色6 h,在显微镜下观察愈伤组织着色情况。
1.3 数据处理
所有数据均用Microsoft Office Excel 2016进行处理,采用SPSS软件(v22.0)进行方差分析。
2 结果与分析
2.1 转化条件对转化效率的影响
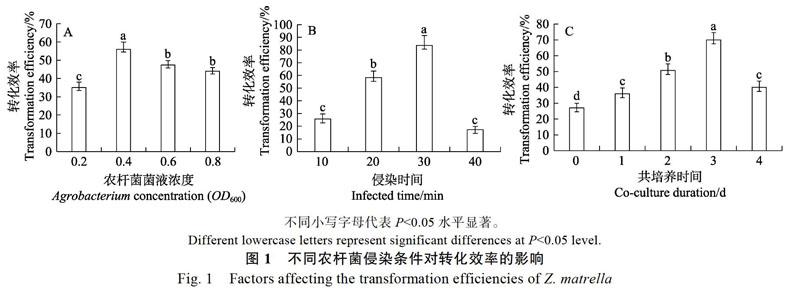
从图1A可以看出,外植体的转化效率随着农杆菌株浓度的增加表现出先升后降的情况。当OD600为0.4时,转化效率达到顶峰,为56%;当OD600为0.6~0.8时,转化效率均低于50%,这是因为农杆菌过度生长导致愈伤组织出现大量褐化死亡,进而导致转化效率降低。所以,选用OD600为0.4作为侵染液菌株最适浓度。
从图1B可以看出,转化效率随着菌株浸染时间的增加表现出先升后降的现象。当浸染时间为30 min时,转化效率达到峰值,为83.7%,是浸染10 min时的3.3倍;而浸染40 min时的转化效率不及30 min时的四分之一,这可能是菌株过多包裹于材料上,导致愈伤组织不能生长,进而转化率下降。所以,最佳的农杆菌浸染时间选择为30 min。
的增加表现出先升后降的趋势,当共培养时间为3 d时,转化效率为70%,达到最高;而4 d时的转化效率仅为3 d时的一半,这可能是菌株量过多,对受体材料存在严重损害,从而影响后期愈伤组织生长。所以,最佳的共培养时间选择为3 d。
2.2 特美汀抑菌浓度的确定
如图2所示,随着抑菌剂Timentin浓度的增加,其抑菌表现力变得越来越明显。尽管300 mg/L Timentin能抑制全部菌株生长,但此时的愈伤分化率还没有250 mg/L Timentin的一半;而200 mg/L Timentin虽有59.7%的愈伤分化率,但其抑菌效果不佳。为了达到既有效控制菌株的快速增殖又不降低愈伤分化率,因此选用250 mg/L Timentin抑制菌株大规模繁殖。
2.3 潮霉素筛选浓度的确定
由图3可见,无论转化材料是否经过农杆菌侵染,随着潮霉素浓度的升高,其成苗率及分化苗的存活率均逐步下降。当浓度分别为50 mg/L(图3A、图3C)和20 mg/L(图3B、图3D)时,观察到经过农杆菌侵染的材料出现大面积褐化及其分化苗枯死情况,这说明它的分化过程与幼苗生长过程均受到严重抑制。而浓度分别为40 mg/L和15 mg/L时,其成苗率为6.3%,幼苗存活率为6.3%。这既能筛选掉绝大部分假阳性材料,又保证有一定的存活率。因此在愈伤阶段选择40 mg/L Hyg,在苗筛阶段选择15 mg/L Hyg。
2.4 转基因植株的鉴定
2.4.1 转化材料GUS检测 根据上述转化方法,经历从最开始预处理的外植体到最终出现阳性苗的过程,获得可能的转基因植株(图4)。对不同过程的材料使用GUS活性的组织化学分析,发现经菌株侵染的愈伤组织和两次筛选得到的阳性苗在GUS染色后呈蓝色(图5),说明GUS基因已成功在愈伤组织、植株和叶片中稳定表达。
2.4.2 转化材料PCR检测 对转化后的再生苗进行分子水平上的PCR检测。从18株再生苗中随机选择5株,提取其叶片DNA,并进行PCR反应看是否可以扩增出HPT基因。结果表明,5株均能扩增出729 bp的目的片段(图6),而野生型对照组(-)则未能扩增出目的条带。这结果进一步说明目的基因已成功地整合到沟叶结缕草的基因组中。
3 讨论与结论
当前,利用农杆菌作为媒介进行转基因是构建草坪草转化体系的常用手段,并已在海滨雀稗(Paspalum vaginatum)[13]、黑麦草(Lolium perenne)[14]、假俭草(Eremochloa ophiuroides)[15]、匍匐剪股颖(Agrostis stolonifera)[16]、早熟禾(Poa annua)[17]、日本结缕草(Zoysia japonica)[18]、中华结缕草(Zoysia sinica Hance)[19]和细叶结缕草(Zoysia tenuifolia Willd. ex Trin.)[20]等草坪植物中获得成功。沟叶结缕草(Zoysia matrella)是盐生植物,广泛分布于温带亚热带。然而,其遗传转化体系鲜见研究,严重影响了其优异基因发掘和分子育种研究,因此建立其遗传转化体系已经迫在眉睫。本试验以沟叶结缕草匍匐茎诱导产生的愈伤组织作为试验材料,报告基因为GUS基因,第一次利用农杆菌介导法将本单位克隆的耐盐相关基因ZmPDI基因转入野生型植株中,探索适合沟叶结缕草转化的条件,经潮霉素筛选后得到的抗性苗,通過PCR检测和GUS活性的组织化学分析表明其为阳性。这为沟叶结缕草的基因转化奠定了坚实基础,同时也为其在分子育种方面提供了新思路。
3.1 转化条件的选择
农杆菌介导的转化过程是极为精密而繁琐的,多种因素决定其转化能否成功,包括菌株浓度的高低、侵染时间和共培养时间的长短等,从而导致在转化率上存在很大差异。在草坪草的遗传转化中菌株浓度选择范围、侵染时间段和共培养用时范围均有所区别,其中结缕草中为OD600= 0.4~0.6,15~30 min,2~4 d[18, 21];黑麦草中为OD650= 0.8,20 min,3 d[13, 22];早熟禾中为OD650=0.6,9 min,2~4 d[12],本实验结果发现,工作菌浓度OD600为0.4,菌株侵染30 min,3 d共培养是最适合沟叶结缕草的。菌液工作浓度过高过低都导致侵染失效,侵染时间和共培养时间过长会对愈伤组织形成永久性损伤引发褐化现象,也会增加抑菌的难度。过短导致侵染效果不佳,出现大量假阳性再生苗进而延长试验周期。
3.2 抑菌剂(Timentin)浓度的确定
为了达到既保证菌株可以有效侵染转化材料,又要防止菌株过快增殖导致转化失败的目的,因此抑菌剂的种类也是决定转化能否成功的重要因素之一。在农杆菌介导的草坪草植物转基因过程中,抑菌剂选择范围包括头孢霉素、羧苄青霉素和特美汀三类,在结缕草和匍匐剪股颖遗传转化研究中头孢霉素选择300~500 mg/L[1-3, 23];在假俭草中头孢霉素选择200~400 mg/L[15, 24];在结缕草中羧苄青霉素选择250~1000 mg/L[18];在结缕草和黑麦草中特美汀选择200 mg/L[5, 12],本试验对比抑制农杆菌生长的结果发现特美汀比头孢霉素效果明显,虽然使用500 mg/L Cef在愈伤组织筛选阶段能有效抑制菌株繁殖,但再生阶段时常发现菌株出现爆发式生长。而250 mg/L Timentin即能控制其快速生长,同时也能保证转化材料的正常分化。因此选用250 mg/L Timentin抑制菌株过度增殖。
3.3 筛选剂潮霉素浓度的确定
潮霉素是禾本科植物中以农杆菌作为媒介进行遗传转化常用的筛选剂之一,潮霉素浓度过高或过低均不利于遗传转化试验的顺利实施,在已报道的多年生黑麦草遗传转化研究中,采用潮霉素浓度选择25~80 mg/L[12, 14];在农杆菌介导的结缕草遗传转化研究中,筛选浓度在愈伤组织生长期间多选择45~75 mg/L,在再生苗生长阶段选择20 mg/L[18, 21]。本试验分别在愈伤分化期和再生苗生长期进行潮霉素梯度试验(用量范围为0~50 mg/L),发现不管转化材料是否经过农杆菌侵染,随着浓度用量不断加大,其分化率及分化苗的存活率均逐步下降。在预试验中随着用量不断加大,愈伤分化率从73%下降至3.6%;再生苗的成苗率从81.7%降至5.3%;而经农杆菌侵染过的愈伤组织的分化率及其再生苗的成苗率下降更加明显,分别从57%降至0%和从66.7%降至0.3%。这其中当浓度分别为50 mg/L和20 mg/L时,观察到经过农杆菌侵染的愈伤组织出现大面积褐化情况及其分化苗因超负荷筛选而枯死,这说明它的分化过程与幼苗生长过程均受到严重抑制。而浓度选择40 mg/L和15 mg/L时,其成苗率为6.3%,幼苗存活率为6.3%。这既能筛选掉绝大部分假阳性材料,又保证有一定的存活率。因此对于潮霉素采用间隔性二筛法,其中在愈伤阶段选择40 mg/L Hyg,在苗筛阶段选择15 mg/L Hyg。
参考文献
Kang J N, Park M Y, Kim W N, et al. Resistance of transgenic zoysiagrass overexpressing the zoysiagrass class II chitinase gene Zjchi2 against Rhizoctonia solani AG2-2 (IV) [J]. Plant Biotechnology Reports, 2017, 11(4): 229-238.
马彩云. 结缕草组织培养再生体系建立及转BdDREB2基因的研究[D]. 阿拉尔: 塔里木大学, 2010.
代小梅. 日本结缕草(Zoysia japonica Steud.)ZjGA20ox基因表达模式及RNA干扰载体遗传转化体系研究[D]. 北京: 北京林业大学, 2013.
Li R F, Wei J H, Wang H Z, et al. Development of highly regenerable callus lines and Agrobacterium-mediated transformation of Chinese lawn grass (Zoysia sinica Hance) with a cold inducible transcription factor, CBF1[J]. Plant Cell Tissue and Organ Culture, 2006, 85(3): 297-305.
張 丽. 沟叶结缕草抗稀禾定体细胞无性系变异筛选和抗草甘膦遗传转化初步研究[D]. 杭州: 浙江大学, 2013.
刘光快, 曹珍珍, 韦克苏, 等. 水稻蛋白二硫键异构酶基因沉默载体构建及其转基因后代的高温结实特性分析[J]. 作物学报, 2013, 39(5): 816-826.
Han X H, Wang Y H, Liu X, et al. The failure to express a protein disulphide isomerase-like protein results in a floury endosperm and an endoplasmic reticulum stress response in rice[J]. Journal of Experimental Botany, 2012, 63(1): 121-130.
Zhu C, Luo N, He M, et al. Molecular characterization and expression profiling of the protein disulfide isomerase gene family in Brachypodium distachyon L.[J]. PLoS One, 2014, 9(4): e94704.
Wittenberg G, Levitan A, Klein T, et al. Knockdown of the Arabidopsis thaliana chloroplast protein disulfide isomerase 6 results in reduced levels of photoinhibition and increased D1 synthesis in high light[J]. The Plant Journal, 2014, 78(6): 1003-1013.
Chen Y, Zong J Q, Tan Z Q, et al. Systematic mining of salt-tolerant genes in halophyte-Zoysia matrella through cDNA expression library screening[J]. Plant Physiology and Biochemistry, 2015, 89: 44-52.
Chai M L, Jia Y F, Chen S, et al. Callus induction plant regeneration and long-term maintenance of embryogenic cultures in Zoysia matrella (L.) Merr[J]. Plant Cell Tissue and Organ Culture, 2011, 104(2): 187-192.
Zhang K W, Wang J, Hu X R, et al. Agrobacterium- mediated transformation of shoot apices of Kentucky bluegrass (Poa pratensis L.) and production of transgenic plants carrying abetA gene[J]. Plant Cell Tissue and Organ Culture, 2010, 102(2): 135-143.
Wu X L, Shi H F, Chen X W, et al. Establishment of Agrobacterium-mediated transformation of seashore paspalum (Paspalum vaginatum O. Swartz)[J]. In Vitro Cellular & Developmental Biology Plant, 2018, 54(5): 545-552.
Esmaeili S, Salehi H, Khosh K M, et al. Isopentenyl transferase (IPT) gene transfer to perennial ryegrass through sonication-assisted Agrobacterium-mediated transformation (SAAT), vacuum and heat treatment[J]. Molecular Biotechnology, 2019, 61(5): 332-344.
張 芳, 王 舟, 宗俊勤, 等. 农杆菌介导的假俭草遗传转化体系的建立[J]. 草业学报, 2011, 20(2): 184-192.
安惠惠, 马晖玲, 李 坚, 等. 农杆菌介导的Lyz-GFP基因对匍匐翦股颖Penn A-1转化和表达的研究[J]. 草业学报, 2012, 21(2): 141-148.
任玉静, 甘 露, 苏浩天, 等. 农杆菌介导的草地早熟禾转基因的研究[C]//2018中国草学会年会论文集, 2018: 470-474.
刘 莉. 日本结缕草IPT基因遗传转化及野牛草实生群体内遗传多样性研究[D]. 武汉: 华中农业大学, 2010.
Lei J L, Wang D, Wu Y M, et al. Establishment of genetic transformation system of Chinese zoysia (Zoysia sinica) mediated by Agrobacterium tumefaciens soaked seeds[J]. Journal of Agricultural Biotechnology, 2009(5): 865-871.
Li M R, Li H Q, Hu X Y, et al. An Agrobacterium tumefaciens-mediated transformation system using callus of Zoysia tenuifolia Willd. ex Trin [J]. Plant Cell Tissue and Organ Culture, 2010, 102(3): 321-327.
Ge Y X, Norton T, Wang Z Y, Transgenic zoysiagrass (Zoysia japonica) plants obtained by Agrobacterium- medi ated transformation[J]. Plant Cell Reports, 2006, 25(8): 792-798.
Bales, Carmille J C. Agrobacterium-mediated transformation of perennial ryegrass (Lolium perenne L.) for cold tolerance[J]. Masters Abstracts International, 2010(49): 67.
Han Y J, Kim Y M, Lee J Y, et al. Production of purple-colored creeping bentgrass using maize transcription factor genes Pl and Lc through Agrobacterium-mediated transformation[J]. Plant Cell Reports, 2009, 28(3): 397-406.
Liu M X, Lu S Y, Liu L, et al. Agrobacterium-mediated transformation of centipede grass (Eremochloa ophiuroides [Munro] Hack.)[J]. Plant Cell, Tissue and Organ Culture, 2012, 109(3): 557-563.
