多囊蛋白在成釉细胞瘤的表达及分布研究
2020-09-25侯亚丽李向军
侯亚丽,杨 丽,刘 冰,张 昊,李向军*
(1.河北医科大学口腔医学院,口腔医院病理科,河北省口腔医学重点实验室,河北 石家庄 050017;2.河北医科大学口腔医学院,口腔医院口腔颌面外科,河北省口腔医学重点实验室,河北 石家庄 050017;3.河北医科大学口腔医学院,口腔医院牙周一科,河北省口腔医学重点实验室,河北 石家庄 050017)
多囊蛋白(polycystin,PC)作为一个细胞表面的膜受体,最早在常染色体显性多囊性肾病(autosomal dominant polycystic kidney disease,ADPKD)的研究中被发现,其家族共有五个成员[1]。研究表明由PKD1基因(polycystic kidney disease 1,PKD1)和PKD2基因分别编码的多囊蛋白1(polycystin-1,PC-1)和多囊蛋白2(polycystin-2,PC-2)与囊肿的形成有关[2-5]。而且PC-1和PC-2还与多个细胞信号存在相互作用,对肿瘤的发生发展产生一定影响[6]。成釉细胞瘤是一种良性牙源性上皮性肿瘤,具有局部侵袭性和易复发的生物学特性。组织病理学分为实性/多囊型、单囊型、促结缔组织增生型及骨外/周围型成釉细胞瘤。PC-1和PC-2在成釉细胞瘤中的表达和分布如何?目前国内外尚未见报道。本研究采用免疫组织化学方法检测PC-1和PC-2在成釉细胞瘤中的表达及分布,并与牙源性角化囊肿(odontogenic keratocyst,OKC)相比较,为研究成釉细胞瘤的发生发展机制,寻找新的早期诊断和治疗方法提供线索。
1 资料与方法
1.1一般资料 收集2015年2月—2019年6月河北医科大学口腔医院口腔颌面外科手术切除的成釉细胞瘤标本30例(成釉细胞瘤组);牙源性角化囊肿标本15例(牙源性角化囊肿组)。成釉细胞瘤组男性19例,女性11例,年龄17~38岁,平均(26.6±6.9)岁;牙源性角化囊肿组,男性10例,女性5例,年龄16~47岁,平均(30.0±10.4)岁。标本制作及切片染色在河北医科大学口腔医(学)院口腔医学重点实验室及河北医科大学第二医院口腔科实验室完成。所有病例均由两位高年资病理医生进行病理诊断并分型。成釉细胞瘤组中实性/多囊型成釉细胞瘤22例:其中滤泡型13例,丛状型9例;单囊型成釉细胞瘤8例。以上所有病例术前均未进行放疗、化疗或生物治疗并且均有完整的临床病例资料并随访。
1.2实验试剂 PC-1和PC-2多克隆抗体购自英国 Abcam 公司,PV-9000免疫组化试剂盒、二氨基联苯胺(3,3′-Diaminobenzidine,DAB)显色试剂盒均购自北京中杉金桥公司。
1.3实验方法 分别将成釉细胞瘤组和牙源性角化囊肿组标本分切、固定,石蜡包埋,切成3~4 μm切片,常规脱蜡至水。磷酸盐缓冲溶液(phosphate buffer saline,PBS)冲洗3 min×3次,放入枸橼酸缓冲液进行热修复15~17 min,一抗PC-1和PC-2浓度分别为1∶75和1∶100。以后按PV9000试剂盒说明书操作,DAB染色,苏木素复染,酸酒精分化,无水乙醇脱水,二甲苯透明,中性树胶封片。阳性对照采用已知的阳性组织切片,阴性对照用PBS代替一抗。
1.4结果判定 PC-1和PC-2阳性为细胞浆或细胞膜有淡黄色或棕色颗粒沉积。根据染色强度和肿瘤细胞阳性率评估免疫组织化学得分。选取肿瘤细胞染色阳性密集区域,在高倍镜下计数100个肿瘤细胞的染色情况。染色强度评分如下:无着色=0分、淡黄色=1分、黄褐色=2分、棕褐色=3分。平均阳性细胞百分率为:<5%为0分、5%~25%为1分、>25%~50%为2分、>50%为3分。细胞染色强度与平均阳性细胞率的评分之和为PC-1与PC-2的免疫组织化学染色最终得分。将评分结果1分定为阴性、2分为弱阳性,3分为阳性,>4分为强阳性。
1.5统计学方法 应用SPSS 21.0统计学软件分析数据。计数资料比较采用χ2检验及四格表资料的Fisher确切概率法检验。P<0.05为差异有统计学意义。
2 结 果
2.1PC-1与PC-2在成釉细胞瘤组和牙源性角化囊肿组中的表达 成釉细胞瘤组PC-1与PC-2主要表达于肿瘤的成釉细胞样细胞及部分星网状层样细胞的细胞浆和细胞膜(图1~2),尤其滤泡型成釉细胞瘤上皮团块中央的肿瘤细胞发生鳞状化生或囊性变时,鳞状化生和囊腔周边的细胞PC-1与PC-2呈强阳性(图3~4);成釉细胞瘤中PC-2的表达强于PC-1。牙源性角化囊肿组PC-1与PC-2呈现弱阳性或阴性表达(图5~6),弱阳性表达主要位于部分牙源性角化囊肿复层鳞状上皮的棘层、粒层及部分基底细胞,并且纤维囊壁中子囊周边细胞PC-1与PC-2呈阴性表达(图7~8)。成釉细胞瘤组PC-1与PC-2的阳性表达率明显高于牙源性角化囊肿组(P<0.05),见表1。
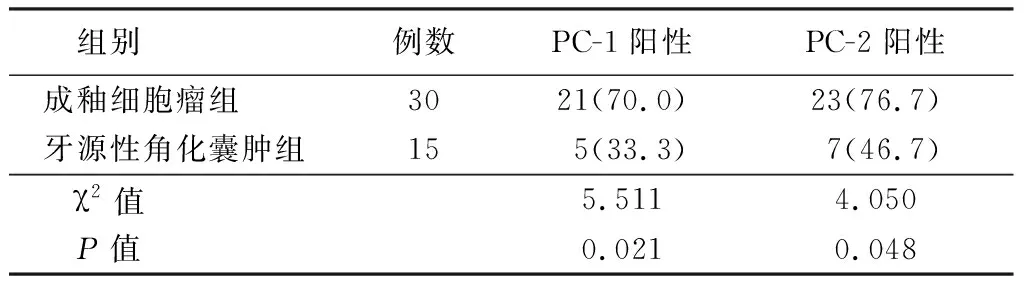
表1 PC-1与PC-2在成釉细胞瘤组和牙源性角化囊肿组中的表达Table 1 Expression of PC-1 and PC-2 in ameloblastoma and odontogenic keratocyst groups (例数,%)
2.2PC-1与PC-2在成釉细胞瘤组各病理亚型中的表达 PC-1与PC-2在实性/多囊型和单囊型成釉细胞瘤(图9~10)中分布和阳性表达率差异均无统计学意义(P>0.05)。在实性/多囊型成釉细胞瘤病理亚型中,滤泡型和丛状型成釉细胞瘤PC-1和PC-2的分布和阳性表达率差异均无统计学意义(P>0.05),见表2~3。
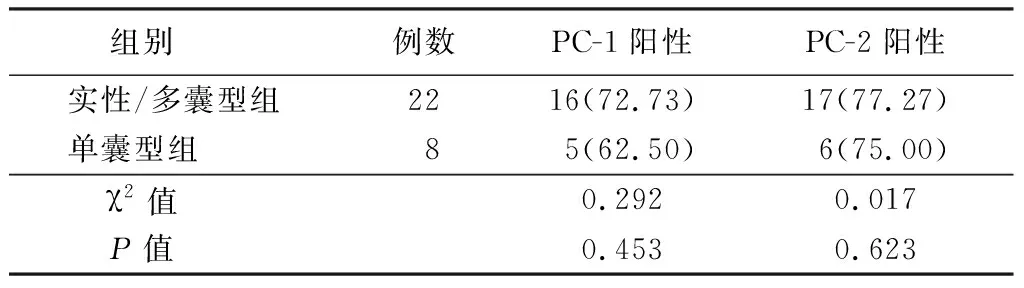
表2 PC-1与PC-2在实性/多囊型和单囊型成釉细胞瘤中的表达 Table 2 Expression of PC-1 and PC-2 in solid/multicystic and monocystic ameloblastoma (例数,%)
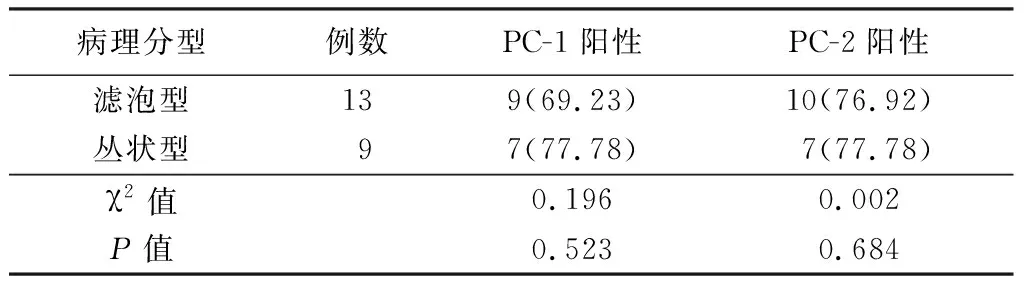
表3 PC-1与PC-2在实性/多囊型成釉细胞瘤各病理分型中的表达 Table 3 Expression of PC-1 and PC-2 in solid/polycystic ameloblastoma (例数,%)
3 讨 论
成釉细胞瘤是临床常见的良性牙源性上皮肿瘤,但是由于早期无明显临床表现而不易被早期发现。患者就诊时颌骨常常已有大范围破坏,再加上其侵袭性的生长方式,其治疗只能手术切除部分颌骨。但是切除部分颌骨必将影响患者的面容及咬合关系,影响患者的生存质量。因此,深入研究成釉细胞瘤的发生发展机制,探索新的早期诊断和治疗方法具有重要意义。
PC是一个受体样的跨膜蛋白,其位于胞内的羧基端含有3个潜在的酪氨酸激酶磷酸化位点,这提示该蛋白可能在细胞内外信号的传递中发挥作用。目前研究主要集中于PC-1和PC-2两种多囊蛋白异构体。PC-1主要分布于肝脏、肾脏、胰腺、肠、心脏等组织,可表达于上皮细胞、内分泌细胞、心肌细胞和骨骼肌细胞;PC-2主要分布于肾脏、甲状腺和血管组织中,而肝脏、胰腺、小肠、胃、脾脏、脑组织、食管中则未查及存在[5]。研究表明ADPKD中编码2种PC的基因突变导致了液体充盈的肾囊肿以及其他上皮器官(包括肝脏和胰腺)的囊肿的产生[7-10]。成釉细胞瘤是口腔颌面部的一种良性牙源性上皮性肿瘤,在组织病理学上常有单个或多个囊腔的形成,但是目前并无研究报道PC是否与成釉细胞瘤的囊腔形成和局部浸润的生物学特性有关。故本研究采用免疫组织化学方法检测PC-1与PC-2在成釉细胞瘤中的表达及分布,为研究其发生发展机制,寻找新的早期诊断标记物和新的治疗靶点提供线索。
长期以来关于PC对多囊肾、多囊肝以及多囊卵巢的病变形成及发展机制方面学者们作了大量研究。研究发现,PC不仅可以通过多个信号通路如:cAMP、MAPK、Wnt、JAK-STAT、Hippo、Src和mTOR等[11-12]参与调控细胞的生物过程,如细胞凋亡、细胞增殖分化、迁移及囊腔的形成等[13-16],而且还可以通过对mTOR通路调控肿瘤细胞的增殖[17-18]。肿瘤细胞所处的微环境可调节细胞外基质使其性能改变重塑,进而提高肿瘤细胞局部浸润和远处转移的能力[19]。研究已表明过度表达的PC-1与PC-2还能够通过mTOR通路促进肿瘤细胞的局部浸润,并且过表达的PC-1与上皮细胞向间充质转化(epithelial-to-mesenchymal transition,EMT)有关。有研究表明[20],大肠癌细胞HCT116中PC-1与PC-2的过度表达可以促进大肠癌的EMT进程,从而在大肠癌的局部浸润/远处转移的过程中起到重要调节作用。目前,EMT在成釉细胞瘤生物学行为中的调控作用也得到了证实:Siar等[21]认为EMT与成釉细胞瘤的局部浸润有关。本研究结果显示,PC-1与PC-2在实性/多囊型AB各病理分型中均为明显高表达,这提示PC-1与PC-2的高表达可能与成釉细胞瘤本身的肿瘤特性有关,PC可能参与成釉细胞瘤的上皮-间质转化,对其浸润性生长的生物学行为产生一定影响,但具体机制有待进一步研究。课题组认为,成釉细胞瘤与牙源性角化囊肿尽管在组织病理学上有一定相似性:①病变均有囊腔;②肿瘤中均含有细胞核极性倒置的成釉细胞样细胞,但两者本质还是不同的。而且以往认为成釉细胞瘤与牙源性角化囊性瘤均为牙源性上皮性肿瘤,但是2017年WHO对牙源性肿瘤重新进行了分类,将“牙源性角化囊性瘤”改回了以前的“牙源性角化囊肿”的名称,并将其划入了囊肿章节,而成釉细胞瘤仍属于牙源性肿瘤。PC-1与PC-2在大部分牙源性角化囊肿中呈现阴性表达,仅有少量为弱阳性表达,这明显不同于成釉细胞瘤中的高表达。此结果提示PC-1与PC-2可能与牙源性角化囊肿的形成无明显关系。此前,研究者曾发现PC-1在含牙囊肿所有上皮细胞均有表达,推测PC-1可能在含牙囊肿和其他牙源性囊肿的发病和进展中发挥作用[22]。本研究结果显示,成釉细胞瘤中发生鳞状化生或囊性变的肿瘤细胞PC-1与PC-2呈强阳性表达,而牙源性角化囊肿纤维囊壁中子囊周边的细胞两种蛋白的表达却为阴性。这提示PC-1与PC-2可能和成釉细胞瘤的囊性转化有一定关联,但是却并未为两种蛋白的表达与囊肿形成提供有力的证据。
目前研究发现,PC-1是一种机械敏感受体,具有受体功能的结构和特征,能够将机械刺激转化为细胞内生化信号[23];而PC-2是一种较小的跨膜蛋白,属于钙通道的瞬时受体电位家族,它能够调节细胞内钙离子,影响细胞增殖、分化和细胞极性等多种特征[6]。本研究结果显示,成釉细胞瘤组PC-1与PC-2主要表达于细胞核明显极性倒置的成釉细胞样细胞,且PC-2的表达强于PC-1;而两种蛋白在牙源性角化囊肿组上皮衬里呈极性倒置的基底细胞却呈阴性或弱阳性表达。推测PC-1与PC-2可能对成釉细胞瘤中肿瘤细胞的功能存在影响,尤其是可能影响肿瘤细胞的极性,但具体机制有待进一步研究。本研究结果显示,PC-1与PC-2在实性/多囊型和单囊型成釉细胞瘤及实性/多囊型成釉细胞瘤各病理亚型中的分布和阳性表达率差异均无统计学意义。推测这可能是由于实性/多囊型和单囊型成釉细胞瘤病理变化相似,镜下均由极性倒置的成釉细胞样细胞和星网状层样细胞构成所致。但也不排除此结果与成釉细胞瘤样本尤其是单囊型成釉细胞瘤样本较少有关,因此需要扩大样本来进一步证实。
综上所述,PC在成釉细胞瘤的表达可能与其发生发展,局部侵袭的生物学特性及成釉细胞瘤的囊性转化有关,这为探索成釉细胞瘤新的早期诊断和治疗方法提供了线索。(本文图见封三)
