牡蛎低聚肽对CTX诱导的PADAM大鼠性功能及生殖功能的干预作用
2020-09-23张海欣盛卓娴陶雅浩李国明金其贯刘文颖
刘 瑜,张海欣,盛卓娴,3,王 憬,陶雅浩,李国明,金其贯,*,刘文颖,*
(1.扬州大学体育学院,江苏扬州 225127;2.中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心,北京 100015;3.南京体育学院奥林匹克学院,江苏南京 211162)
40岁后的男性随着年龄增长常感性欲、性频率、阴茎勃起坚硬程度有所降低,50~60岁后更为明显,从而形成中老年男性雄激素部分缺乏综合征(Partial androgen deficiency of aging male,PADAM)。PADAM又称为男性更年期综合征,是指中老年男性体内睾酮水平降低或者靶器官对睾酮或对其活性代谢产物敏感性随着年龄的增长而降低,出现以植物神经系统和生殖系统生理功能紊乱为主的症候群[1-5],主要表现为性欲减退、勃起功能障碍、精子活性降低、疲劳、注意力不集中、烦躁、易怒、甚至焦虑、抑郁等一系列症状和体征,严重影响患者的工作与生活质量。雄激素替代疗法是治疗PADAM的主要方法,但是雄激素补充治疗引起的红细胞增多、前列腺增生以及前列腺癌的潜在影响也引起人们的密切关注,影响了雄激素补充治疗的临床应用[5-9]。有研究发现,许多营养素与人类的生殖功能、精子发生、雄激素合成与分泌都有一定的关系,特别是维生素E、维生素A、锌和硒等微量元素[10]。
牡蛎(Oyster)俗称海蛎子,肉质鲜美,含有丰富蛋白质、氨基酸、牛磺酸、维生素和矿物质等,具有增强免疫力、降血糖等功效,是第一批被我国卫生部批准列为药食两用的保健疗效品,具有很好的食疗价值[11-13],而且能增强男性雄激素的分泌,有补肾壮阳作用[14-15]。而牡蛎低聚肽(Oyster oligopeptides,OOP)是对牡蛎蛋白进行酶解、干燥,获得分子量小于1000 Da的寡肽。由于寡肽可以不经消化迅速被吸收,且比游离氨基酸吸收率更高,且寡肽是介于氨基酸和蛋白质之间的结构功能片段,因此OOP与自然牡蛎蛋白相比,不仅具有较高的生物活性,而且吸收率更高[16-17]。目前不少研究证实OOP可以增强雄性激素的分泌和男性的生殖功能。张亭等[18]研究发现OOP配伍核桃低聚肽和山药多糖能显著提高正常小鼠血清一氧化氮(NO)及睾酮含量,显著增强性功能。张雪妍等[19]通过离体实验发现了牡蛎酶解产物及其超滤组分(<5 ku和5~10 ku)可有效增强小鼠睾丸间质细胞TM3的增殖活性并促进其分泌睾酮,且具有浓度依赖性。陈悦等[20]通过实验进一步证实小分子牡蛎多肽可通过提高正常小鼠黄体生成素(Luteinizing hormone,LH)、卵泡刺激素(Follicle stimulating hormone,FSH)的分泌,增加睾丸类固醇生成急性调节蛋白(StAR)、细胞色素P450 胆固醇侧链裂解酶(P450scc)和3β-羟基类固醇脱氢酶(3β-HSD)的基因表达,促进间质细胞睾酮的合成和分泌,提高血清睾酮的含量,从而起到增强雄性小鼠交配能力、性功能的作用。最近,李大炜等[21]通过D-半乳糖建立衰老大鼠模型,发现高剂量牡蛎肽能显著改善模型大鼠睾丸组织及精子质量的衰老状态。但是OOP能否有效地干预PADAM的形成目前尚未见到研究报道。
本研究通过对雄性大鼠腹腔注射环磷酰胺(Cyclophosphamide,CTX)建立PADAM大鼠模型[22],与此同时补充不同剂量的OOP,6周后观察大鼠的性行为、精子性状等指标的变化,探讨不同剂量的OOP对PADAM大鼠性功能和生殖功能的影响;同时观察血清中FSH、LH、总睾酮(Total testosterone,TT)、游离睾酮(Free testosterone,FT)以及睾丸雄激素受体(Androgen receptor,AR)含量的变化,探讨OOP干预性功能和生殖机能的生理机制,为OOP的开发利用提供实验依据。
1 材料和方法
1.1 材料与仪器
OOP 北京市蛋白功能肽工程技术研究中心提供,其主要成分:游离氨基酸占28.36%,肽含量占57.39%,其中分子量在1000 Da以下的有88.4%,3000 Da以下的占98.8%;CTX 江苏盛迪医药有限公司(国药准字H32020857);苯甲酸雌二醇 杭州动物药品厂(兽药字(2103)110202511);M199培养基 Sigma-Aldrich;血清TT、FT、LH、FSH和睾丸AR含量Elisa试剂盒 南京森贝伽生物科技有限公司;雄性和雌性SD大鼠,SPF级 上海杰思捷实验动物有限公司,质量许可证号为SCXK(沪)2013-0006。
精子、微生物动(静)态自动监测系统 清华同方;Multiskan Go全波长酶标仪 Thermo Scientific。
1.2 实验方法
1.2.1 动物分组及干预方案 SD大鼠雄性50只和雌性10只,体重180~220 g,分笼饲养,每笼5只,室温(25±2) ℃,每3天更换垫料。大鼠适应性喂养1周后,将雄性大鼠随机分为正常对照组(NC,n=10)、PADAM组(PC,n=10)、PADAM+低剂量OOP组(PLO,n=10)、PADAM+中剂量OOP组(PMO,n=10)、PADAM+高剂量OOP组(PHO,n=10)共5组。在实验期间每组喂饲普通饲料,PC、PLO、PMO、PHO 4组在实验开始时按照20 mg/(kg·d)的剂量腹腔注射CTX,连续5 d,复制PADAM大鼠模型[22]。与此同时,PLO组每天灌服0.5 g/kg·bw OOP,PMO组每天灌服1.2 g/kg·bw OOP,PHO组每天灌服2.0 g/kg·bw OOP[23],共6周。
1.2.2 实验取材 动物在末次灌胃结束后的第二天上午取材,在取材前断食不断水8 h,每只腹腔注射2%的戊巴比妥钠(50 mg/kg)进行麻醉,然后从腹主动脉取血5 mL,放入试管中,静置60 min 后4000 r/min离心15 min,分离的血清保存于-80 ℃冰箱,用于测定血清TT、FT、LH、FSH含量。取左侧睾丸制备10%组织匀浆用于测定睾丸AR含量,取左侧附睾,用于测定精子性状。
1.2.3 指标测定
1.2.3.1 各组大鼠性行为的测定 在实验取材前1周,参照杨菊[24]的实验方法进行大鼠性行为实验。实验前48 h给雌性大鼠皮下注射苯甲酸雌二醇(0.02 mg/只),使之处于动情期。在晚上7~11时测定雄性大鼠的性行为,将雄性大鼠单独放入鼠笼中5 min以适应环境,然后每笼放入雌性大鼠1只,观察并记录从雌鼠投入至雄鼠首次捕捉雌鼠的时间(捕捉潜伏期)、雄鼠首次与雌鼠交配的时间(交配潜伏期)以及20 min内雄鼠捕捉雌鼠和发生交配的次数。
1.2.3.2 精子性状的测定 取部分附睾尾准确称重后,置于含有4 mL 预温37 ℃的M199培养基的培养皿中,用手术剪刀剪破被膜,放入37 ℃二氧化碳培养箱孵育5 min,用尖头镊子移出残余组织,缓慢摇动培养皿,使精子悬液混匀[25-26]。吸取30 μL的精子悬液至预温的细胞计数板中,用精子、微生物动(静)态自动监测系统进行摄像后观察和计算精子数量、精子活率及精子密度。其中精子数量(个/mg)=液体精子密度(个/mL)× 4(mL)/称取附睾重(mg),精子活力=前向运动精子数/总精子数×100,精子活率=(前向运动+横向摆动精子)/总精子数×100。
1.2.3.3 血清TT、FT、LH、FSH和睾丸AR含量测定 血清TT、FT、LH、FSH和睾丸AR含量采用Elisa测定,严格依照试剂盒说明书操作。
1.3 数据处理
2 结果与分析
2.1 各组大鼠性行为的变化
如表1所示,与NC相比,PC组捕捉潜伏期有极显著性延长(P<0.01),捕捉次数虽有所减少,但无显著性差异(P>0.05)。与PC组相比,PLO、PMO和PHO组捕捉潜伏期均极显著性缩短(P<0.01),捕捉次数均极显著性增加(P<0.01);PLO、PMO和PHO组之间捕捉潜伏期和捕捉次数均无显著性差异(P>0.05)。

表1 各组大鼠捕捉潜伏期和捕捉次数的变化
如表2所示,与NC组相比,PC组交配潜伏期显著性延长(P<0.05),且交配次数显著性减少(P<0.05),从而说明,在CTX诱导大鼠形成PADAM时,伴随着性功能的降低。与PC组相比,PLO组交配潜伏期有所缩短,但无显著性差异(P>0.05),而交配次数有极显著性增多(P<0.01);PMO和PHO组交配潜伏期均极显著或显著短于PC组(P<0.01、P<0.05),交配次数均极显著性增多(P<0.01)。与PLO组相比,PMO和PHO组交配潜伏期有所缩短,但无显著性差异(P>0.05),而交配次数均极显著性增多(P<0.01)。PMO和PHO组之间交配潜伏期和交配次数均无显著性差异(P>0.05)。从而说明在CTX诱导大鼠形成PADAM时补充不同剂量的OOP可以明显改善大鼠的性功能,且以中、高剂量的OOP效果较好。

表2 各组大鼠交配潜伏期和交配次数的变化
2.2 各组大鼠精子性状的变化
如表3所示,与NC组相比,PC组精子数量显著性减少(P<0.05),精子活率和精子活力显著或极显著性降低(P<0.01、P<0.05),从而说明在CTX诱导大鼠形成PADAM时,生殖功能也显著降低。与PC组相比,PLO组精子数量、精子活率和精子活力均有所增加,但无显著性差异(P>0.05),虽然PMO组精子数量无显著性增加(P>0.05),但精子活率和精子活力均显著或极显著性增加(P<0.01、P<0.05);PHO组精子数量、精子活率和精子活力均极显著性增加(P<0.01);在PLO、PMO和PHO组之间,除了PHO精子活率显著高于PLO组之外(P<0.05),精子数量和精子活力随着OOP补充剂量的增加有增加趋势,但无显著性差异(P>0.05)。从而说明在CTX诱导大鼠形成PADAM时补充不同剂量的OOP可以改善大鼠的生殖功能,且以中、高剂量的OOP效果较好。

表3 各组大鼠精子性状的变化
2.3 各组大鼠血清TT和FT含量的变化
如表4所示,与NC组相比,PC组血清TT和FT均有极显著性降低(P<0.01),从而说明小剂量的CTX可导致血清睾酮含量的显著降低,可成功诱导大鼠PADAM的形成。与PC组相比,PLO组血清TT和FT含量有所增加,但无显著性差异(P>0.05),PMO组和PHO组血清TT(P<0.01)和FT(P<0.01,P<0.05)含量均显著性增加。与PLO组相比,PMO和PHO组血清TT均显著性增加(P<0.05,P<0.01),而血清FT含量有增加趋势,但无显著性差异(P>0.05);与PMO组相比,PHO组血清TT和FT含量均无显著性增加(P>0.05)。从而说明,补充中、高剂量的OOP对CTX诱导大鼠PADAM的形成具有显著的干预作用。
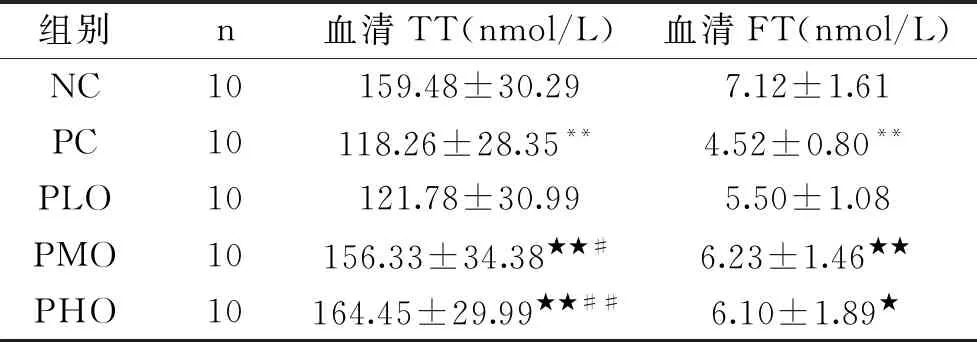
表4 各组大鼠血清TT和FT含量的变化
2.4 各组大鼠血清FSH、LH和睾丸AR含量的变化
如表5所示,与NC组相比,PC组血清LH含量和睾丸AR含量显著性降低(P<0.01,P<0.05),从而说明在CTX诱导PADAM形成过程中,垂体分泌LH显著减少是睾丸睾酮合成和分泌减少的重要原因,与此同时伴随着睾丸AR表达的降低,从而引起精子数量的减少以及精子活率和精子活力的降低。与PC组相比,PLO组血清FSH、LH和睾丸AR含量无显著性增加(P>0.05),而PMO和PHO组血清FSH(P<0.01)、LH(P<0.05,P<0.01)和睾丸AR(P<0.01)含量均显著性升高;与PLO组相比,PMO血清FSH含量极显著性增加(P<0.01),PHO组血清FSH、LH和睾丸AR含量均显著性增加(P<0.01,P<0.05,P<0.05);与PMO组相比,PHO组血清FSH、LH和睾丸AR含量有增加的趋势,但无显著性差异(P>0.05)。从而说明中、高剂量的OPP能够促进垂体LH和FSH的分泌和睾丸AR的合成,这可能是OOP补充有效预防CTX引起血清睾酮降低、改善性功能和生殖功能的生物学机制。

表5 各组大鼠血清FSH、LH和睾丸AR含量的变化
3 讨论
目前研究PADAM的动物模型很少,主要采用自然老化的更年期大鼠模型。由于20~24月龄的大鼠较为接近于PADAM的生物学特性[22],但是自然老化的更年期大鼠饲养成本较高,来源非常稀少。由于CTX具有生殖毒性,可导致睾丸损伤、生精功能障碍、染色体畸变、睾酮合成障碍等[22,27]。何清湖等[22]给大鼠连续5 d腹腔注射CTX 20 mg/kg,30 d后发现,与正常组比较,模型组大鼠毛发发黄、卷曲、干枯无光泽,体重减轻,活动减少,血清TT、FT含量极显著性降低,睾丸系数显著下降,曲精小管直径缩小、间距增宽、生精上皮变薄、生精细胞和间质细胞数量减少等,这些退行性变化与PADAM基本相似,从而说明应用CTX复制PADAM 动物模型是可行的。由于PADAM的发生是由于体内睾酮水平部分降低或靶器官对睾酮或其活性代谢产物的敏感性降低而产生的一种临床状态[5],因此睾酮水平是判定PADAM的重要指标之一。本研究通过连续5 d给雄性大鼠腹腔注射20 mg/kg体重的CTX,6周后 PC组血清TT、FT水平均有显著性低于NC组(P<0.05),这与何清湖等实验结果相符[22],从而说明本研究通过注射小剂量的CTX成功复制了PADAM 大鼠模型。
交配实验能通过受试动物捕捉、骑跨等性行为的潜伏期和次数可直接反映出大鼠性功能的强弱,当其中一项结果有差异性时,即可表明性行为实验成功[28]。本研究结果发现,与NC组相比,PC组不仅捕捉潜伏期和交配潜伏期显著性增长(P<0.05),交配次数显著性降低(P<0.05),而且精子数量和活力显著性降低(P<0.05),精子活率极显著性降低(P<0.01)。由于精子数量和精子活力则是判定精子质量的重要指标,有充足数量和活力的精子才能运动到输卵管完成受精活动。从而说明,在大鼠PADAM的形成过程中,伴随着血清睾酮的降低,其性功能和生殖功能会显著减弱。
睾酮的合成与分泌和精子的产生受到下丘脑-垂体-性腺轴(Hypothalamus-pituitary-gonads axis,HPG)的调控。垂体分泌的LH又称间质细胞刺激素(ICSH),与间质细胞膜上的LH受体结合,促进睾酮在线粒体内合成;而生精过程受睾酮及FSH的双重控制,FSH作用于曲细精管起始动生精作用,而LH通过睾酮有维持生精的效用[29-30]。虽然有研究发现,CTX在导致血清TT含量下降的同时,血液中FSH和LH含量不仅没有降低,反而有所增加,并认为这可能与负反馈调节机制有关。但本研究发现,与NC组相比,PC组血清LH含量极显著性降低(P<0.01),而FSH含量有所降低,但无显著性差异(P>0.05)。从而说明CTX引起大鼠PADAM形成的同时,血清睾酮含量的下降,在一定程度上与垂体分泌LH的减少有关,其具体机制还有待于进一步研究。虽然生精细胞无AR,但是支持细胞中含有丰富的AR,睾酮与支持细胞上AR结合,促进蛋白质的生物合成为生精细胞精子的生成提供了营养支持[30]。本研究发现,与NC组相比,PC组睾丸中AR含量显著性降低(P<0.05)。因此,在CTX诱导PADAM形成过程中,垂体LH分泌的减少导致睾丸睾酮合成和分泌减少的同时伴随着睾丸AR表达的降低,从而引起精子数量的减少以及精子活率和精子活力的降低。
OOP是利用现代酶解技术水解牡蛎蛋白形成的小分子寡肽,可以不经消化迅速被吸收,其吸收率、生物效价和营养价值比游离氨基酸更高。为了进一步探讨OOP的补充对PADAM形成的干预作用,本研究在PADAM形成的同时补充不同剂量的OOP,结果发现,与PC组相比,PLO组血清TT、FT、FSH、LH含量均无显著性升高(P>0.05),PMO和PHO组血清TT、FT、FSH、LH和睾丸AR含量显著增加,且PMO和PHO组血清TT、FSH含量显著高于PLO组,PHO组血清LH和睾丸AR含量显著高于PLO组(P<0.05)。其与陈悦的研究结果[20]相同,从而进一步说明在CTX诱导PADAM形成的过程中补充OOP,不仅能够促进LH和FSH的分泌,有效防止CTX引起的血清TT和FT含量的降低,而且能够促进睾丸AR的表达,有效防止PADAM的形成。
本研究还发现,PLO组捕捉潜伏期显著缩短,捕捉次数和交配次数显著增多(P<0.01),PMO和PHO组捕捉潜伏期和交配潜伏期显著缩短、捕捉次数和交配次数显著增多(P<0.05),且PMO和PHO组的交配次数显著多于PLO组(P<0.01)。当受试动物捕捉、交配的潜伏期和次数等性行为中一项结果为阳性时,即可表明干预物质对性功能具有一定的促进作用[21],从而说明,在PADAM形成的同时补充不同剂量的OPP均能有效地改善机体的性功能,但以中、高剂量为好。与此同时,与PC组相比,PMO组精子数量虽然不能显著性增多(P>0.05),但精子活率和精子活力显著性增大(P<0.01,P<0.05),而PHO组精子数量、精子活率和精子活力均极显著性增加(P<0.01),且PHO组的精子活率显著高于PLO组(P<0.05)。从而说明随着OOP补充剂量的增加,精子数量、精子活率和精子活力的增加幅度也增大,这与李大炜的研究结果[21]相似。因此,在CTX诱导PADAM形成的过程中,OOP的补充不仅能够促进LH和FSH的分泌,能够促进睾丸间质细胞睾酮的生成和支持细胞AR的表达,有效防止CTX引起的血清TT和FT含量的降低和PADAM的形成,而且对改善性功能和生殖功能具有非常重要的作用,并具有一定的剂量效应,以中、高剂量的OOP效果较好。
4 结论
在CTX诱导PADAM形成的同时,补充不同剂量的牡蛎低聚肽能够改善HPG轴的功能,有效防止CTX引起的睾酮降低和PADAM的形成,并改善性功能和生殖功能,以中、高剂量的牡蛎低聚肽效果较好。
