植物灰霉病及抗性研究进展
2020-09-22陈宇春陈敏王其刚
陈宇春 陈敏 王其刚
摘要:灰霉病是由灰葡萄孢(Botrytis cinerea)侵染引起的真菌病害之一,对农业产品及园林观赏植物均有较大危害。对植物灰霉病的症状、发病规律及发病条件、防治措施、抗病分子水平等方面的研究情况进行了概述。对灰霉病的防治研究主要针对果蔬类,而对园林观赏植物的研究较少,这为后期对灰霉病抗性的研究提供新的研究方向。
关键词:灰霉病;致病机制;防治方法;抗病基因;基因工程
中图分类号: S432.4+4 文献标志码: A 文章编号:1002-1302(2020)15-0042-10
灰霉病是由灰葡萄孢(Botrytis cinerea)侵染引起的真菌病害之一,对农业产品及园林观赏植物均有较大危害,其侵染范围广泛,可危害茄科、葫芦科、蔷薇科等470多种植物[1]。一旦侵染农作物可引起植株叶片大量脱落,果蔬腐烂,产品质量下降,侵染花卉植物,如月季(Rosa hybrida),主要侵染其花,严重时也会对幼枝和叶片造成危害,可引起花瓣变褐色、腐烂、萎蔫,直至整个花朵褐变枯萎[2-3],从而降低花卉观賞价值。番茄(Lycopersicon esculentum)是全国栽培广泛、消耗量最大的蔬菜作物之一,番茄感病后,发病部位会产生灰白色或灰褐色霉层,甚至烂苗、烂果,从而降低产量[4]。而草莓(Fragaria×ananassa)营养价值与其独特的口味深受人们喜爱,但灰霉病对其侵染十分严重,危害草莓地上部的所有器官,包括果实、花器(包括花瓣、雄蕊、花萼)、果柄、叶片、叶柄等,其中以果实受害最重[5]。
近年来,灰霉病主要采用化学防治,如使用多菌灵、速克灵等化学药剂。但由于使用防治的药物在一定程度上也会抑制植物的生理活性,长期使用化学试剂会降低植物对病源菌的抵御能力[6],使防治效果大大降低,而且大量使用化学试剂不仅成本高,还会加大对环境和人体健康的危害。所以,研发新的抗病产品以及使用生物防治的方法是控制灰霉病的有效途径。
1 灰霉病的概述
1.1 发病症状
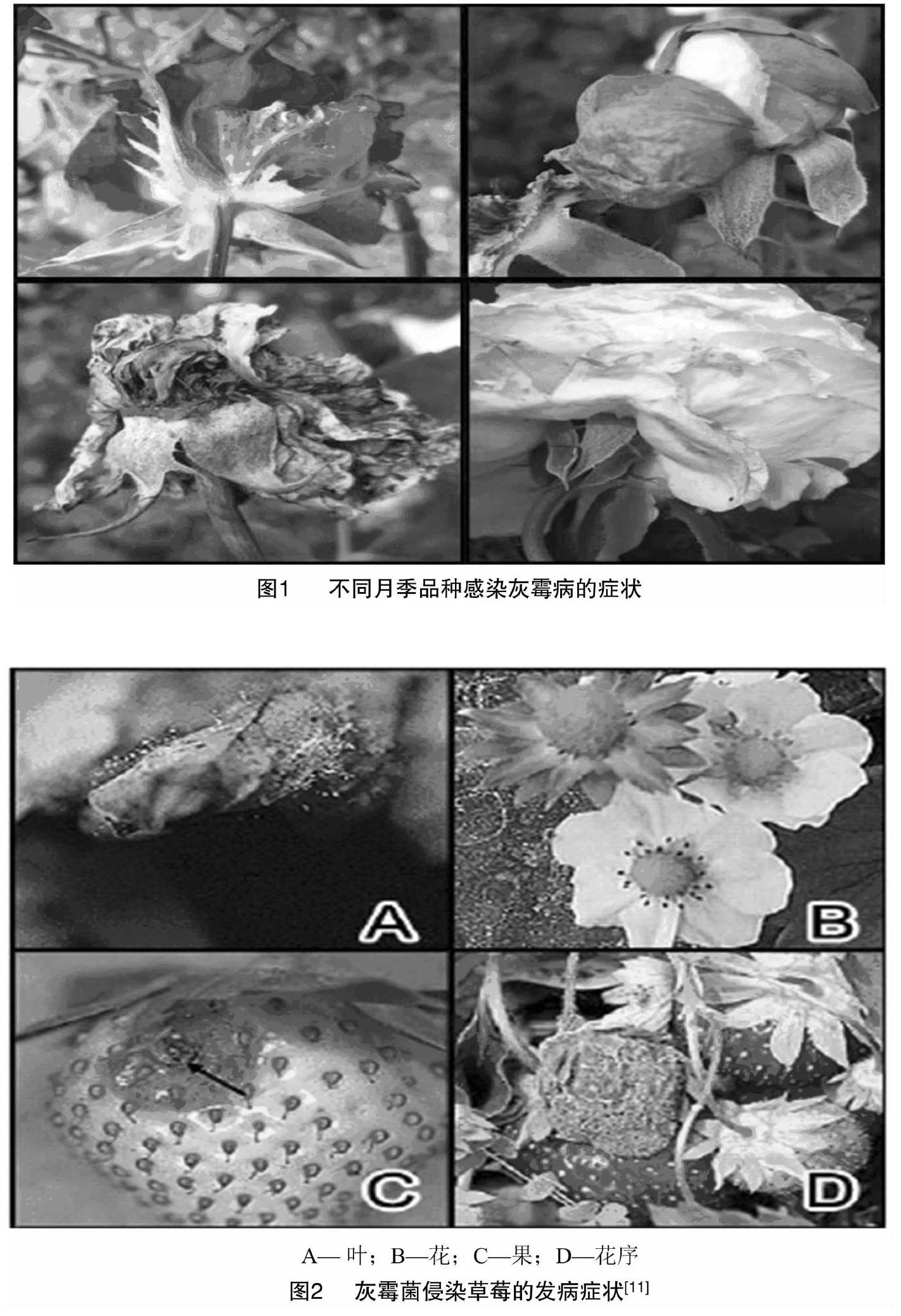
在月季植物中,灰霉病主要侵染月季的花器,严重时也会侵染叶片,花的萼片易感病,发病后变褐坏死[3]。幼蕾发病时,会先在花托部位产生水渍状不规则小斑,然后稍凹陷形成灰黑色病斑,最后扩展至整个花蕾,导致病蕾无法开放,变褐色腐烂枯死。叶片感病,首先在叶缘和叶尖产生水渍状不规则淡褐色斑点,然后稍下陷变褐并腐败。当灰霉菌侵染芍药时会导致其叶片干枯坏死,茎部凹陷折倒,花瓣褐色腐烂,甚至整个植株死亡[7]。在黄芩植物中,主要侵染叶片和茎秆,形成褐色病斑,严重时会导致整株叶片干枯,植株死亡[8]。侵染农作物如番茄,叶片发病主要从叶尖开始,刚开始出现水渍状,浅褐色边缘不规则深浅相间的轮纹;侵染茎时也会出现水浸状小点,后扩展为长椭圆形或长条形斑,浅褐色;侵染果实会导致果皮呈灰白色、水渍状,然后变软腐烂[9](图1)。灰霉菌侵染草莓时,症状发生过程不大相同,如侵染果实时最初在果面上出现浅褐色水渍状斑点,进而形成褐色病斑,近圆形或不规则形;侵染花瓣和萼片染病后变褐,先是形成水渍状小斑点,后扩展为不规则病斑,严重时整朵花和花序枯死(图2)。病原菌易于在草莓花药和花瓣组织内定殖[10-12]。根据以上可以得出,灰霉菌不管是侵染经济作物还是粮食作物,均会造成其产量及商业价值大大降低。
1.2 灰霉病病菌的分类
灰霉病是灰葡萄孢侵染引起的真菌病害之一,是半知菌亚门葡萄孢属,其有性态为富克尔葡萄孢盘菌(Botryotinia fuckeliana)[13]。葡萄孢属的真菌共包括23个种,其中1个杂交种,大多数的侵染范围较窄,只能感染1个或同1个植物属中的一些亲缘关系近的物种[14],而灰霉菌的侵染范围较广,可侵染400多种植物。近年来,发现灰葡萄属中其他具有致病能力的致病菌,例如草莓葡萄孢(B. frgariae)、卡罗莱纳葡萄孢(B. caroliniana)、中华葡萄生葡萄孢(B. sinoviticola)[15]。灰霉菌是一个复合种,种内不同菌株间的生物学特性及抗性均有较大差异,所以对灰霉菌的分类主要从生物学性状、致病力、抗药性这3个方面着手。据最新研究报道,使用电子显微技术观察灰霉菌不同菌株之间孢子表面纹饰的异同也可作为区分灰霉菌的一项指标[16],这为深入研究灰霉菌的类群划分提供了理论基础。
1.3 灰霉病病菌的形态
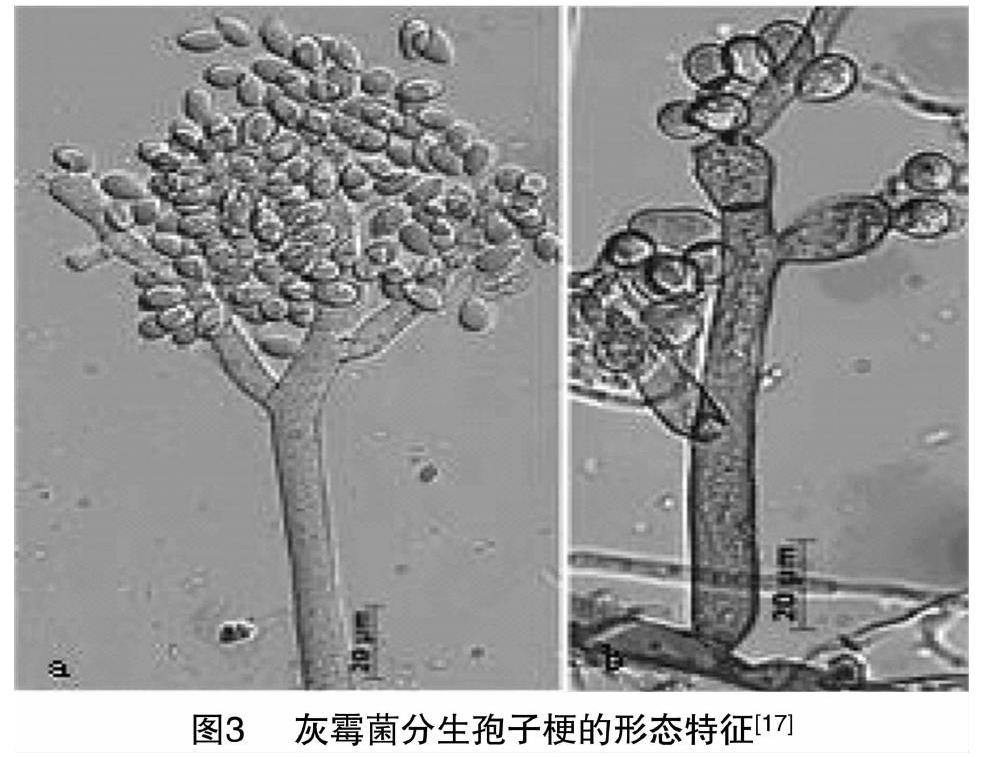
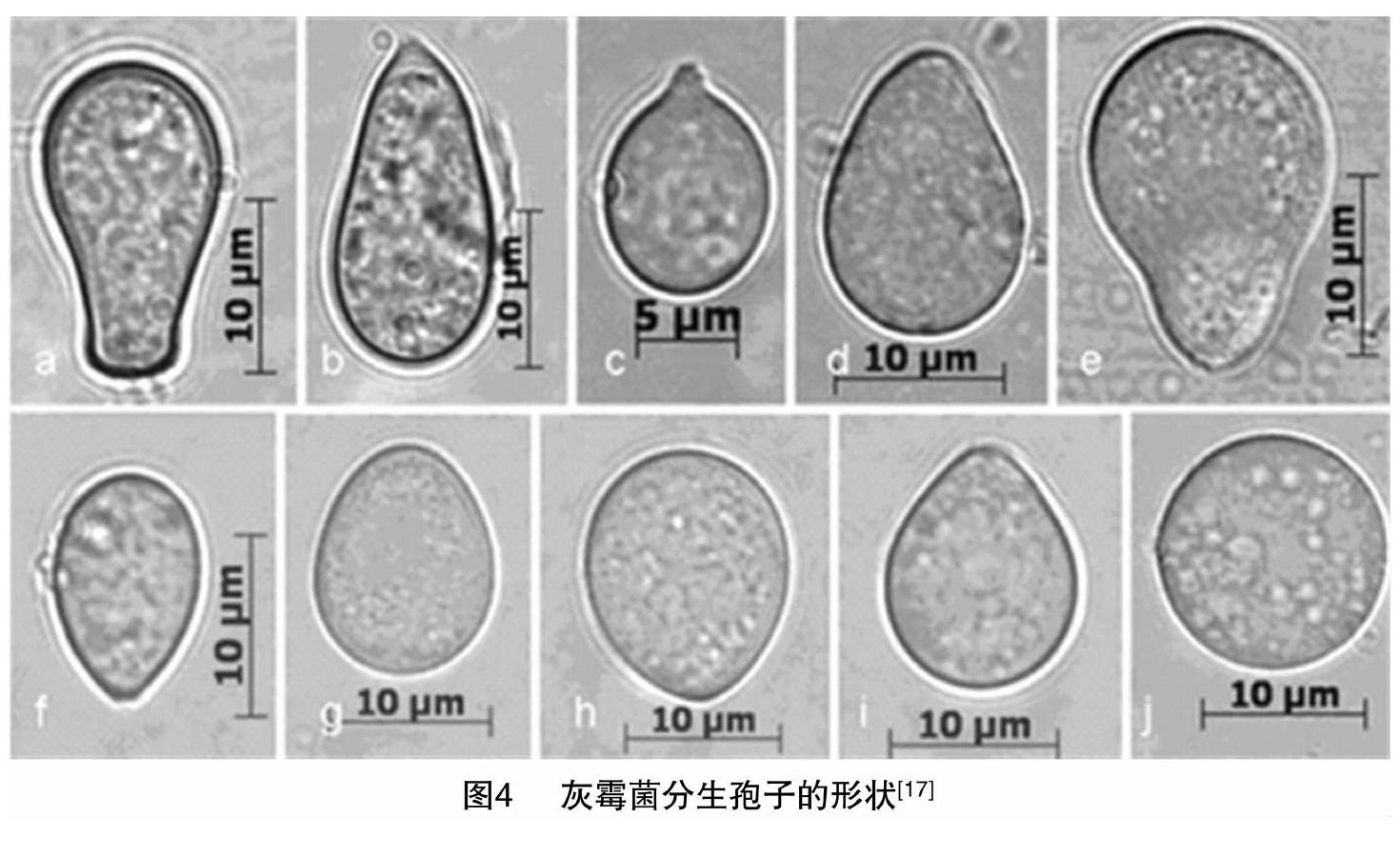
在紫皮石斛上首次报道灰霉菌的侵染,通过在PDA培养基培养,观察到灰霉菌形态,初为白色,渐变为淡黄色,菌落稀疏,能产生黑色小菌核。肉眼可见在菌落表面有许多小球状物,即分生孢子梗顶端的分生孢子团。分生孢子梗着生于菌丝上,在分生孢子梗基部与菌丝之间会产生横隔膜群生或单生,(135~)270~1 500 μm×12.5~22.5 μm,不分枝或分枝,直立,有横隔,分枝处稍有缢缩现象,分生孢子梗顶端细胞膨大,其上着生小梗(图3),无色或淡色,分生孢子圆形、椭圆形、卵圆形等多种形状油[17](图4)。
1.4 发病规律及发病条件
灰霉病在低温高湿的环境下容易暴发。病害主要表现为病菌从萼毛、花梗的气孔或伤口处入侵,向果梗上蔓延,果皮呈灰白色水渍状软腐,湿度大时果面产生大量灰色霉层。病菌以菌丝体和菌核形式在植株病部、病残体或遗留在土壤中越冬,成为主要初侵染源,灰霉病菌是一种兼性寄生菌[3,18]。病菌与菌核分别在2~31、3~27 ℃下萌发,菌丝最适温度为20~24 ℃,当温度达到 15 ℃、相对湿度在85%以上即会发病。若温度在20 ℃、相对湿度在90%以上时,病害迅速发生。一般在开花结果初期,灰霉病进入发病高峰,在病部产生的霉菌又通过气流进行更大范围的传染,3—5月及10月前后是灰霉病的主要发生时期。一般在密度过大、秧苗或植株生长不良、空气相对湿度过高时容易发生病害[9]。
2 致病机制
病菌以菌核为主要的越冬方式,部分菌丝体也可以在树皮和冬眠芽上越冬。无论是植物体还是土壤中的温度和湿度均可使其存活。菌核和分生孢子的抗逆性都很强,翌春气候条件适宜时,越冬的分生孢子及菌核即可萌发产生新的分生孢子,其通过气流即可传播到花序及幼果穗上,当植物幼嫩部位受到外界刺激后外渗物质极易侵染萌发生成新一代孢子,此时大量的孢子可以进行大规模的传播。灰霉菌侵染具有很长的潜伏期,并且具有低温致病性。在温室条件下,该病主要以分生孢子进行初侵染和再侵染,周年发生。在菌丝入侵植物表皮细胞的初期杀死植物细胞,从植物的死细胞中吸取营养,以利于菌丝的进一步侵入[19](图5)。
灰霉菌是一种典型的腐生型真菌,它可以产生细胞壁降解酶和其他许多有毒性的次级代谢产物,如毒素是植物病原菌产生的次级代谢产物,病菌培养滤液经三氯甲烷萃取后旋转蒸发,可得到粗毒素,对其进行生物活性检测发现,能在番茄叶片上能产生与病菌接种的病斑相似的症状,可以显著抑制胚根的生长,并能够导致番茄幼苗失水萎蔫。因此,灰葡萄孢毒素对番茄植株具有明显的毒害作用[20]。
3 防治措施
3.1 化学防治
目前,对灰霉病主要采用化学防治,其化学药剂主要有2类,一类是治疗性杀菌剂,如苯并咪唑类(如多菌灵、二甲酰亚胺类)和N-苯氨基甲酸酯类(如多霉灵);另一类是保护剂,如百菌清、代森锰锌、克菌丹等,其只起到预防的作用[22]。不同化学试剂对灰霉菌的防治效果也有所差异,据报道,在速克灵、多菌灵、乙霉威、代森锰锌等4种农药中,前2种农药对灰葡萄孢的防治效果较好,但对于来自不同寄主的灰葡萄孢菌株,4种农药的防治效果各有高低,防效高低顺序依次为多菌灵>速克灵>乙霉威>代森锰锌[23]。灰霉菌的侵染会引起寄主体内酶活性的差异,如不同灰葡萄孢接种草莓叶片后其体内过氧化物酶同工酶(peroxidase,简称POD)、多酚氧化酶同工酶(polyphenol oxidase,简称PPO)、超氧化物岐化酶同工酶(superoxidedismutase,简称SOD)3种酶的活性均发生了明显变化,并且不同寄主来源的灰葡萄孢株接种草莓后产生的同工酶谱带在数目和颜色上都存在差异,其中POD的差异最为明显,SOD的差异最小。苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,简称PAL)是植物体重要次级代谢内烷类代谢途径中的限速酶和关键酶,PAL被认为是与果蔬抗病反应密切相关的酶类[24]。将疫霉根腐病菌接种到不同的大豆品种上,结果发现,抗病野生大豆的根和茎中PAL活性显著增强[25],植株的抗病性提高。
除了使用农药防治病菌,也有研究人员使用生物源化学物来预防。植物源杀菌是从植物中提取出来的某些活性部分或有效成分,经过分离纯化加工而成的用于防治植物病害的药剂,使用这些药剂能降低对环境的污染以及对人体健康的危害。如叶艳英等研究表明,通过采用植物源杀菌剂也可用于防治植物病害,包括植物源杀真菌剂、杀细菌剂、病毒抑制剂和杀线虫剂,植物中抑菌有效成分主要有四大类,分别是萜类化合物及其衍生物,生物碱、酰胺及蛋白质等含氮含硫化合物,脂肪类化合物,芳香族化合物,其试验结果表明,采用植物源杀菌剂对番茄、辣椒、草莓等灰霉病起到了一定的抑制作用。酚类是植物次生代谢形成的一系列物质,具有抑菌、抗氧化和清除自由基能力,被认为是植物体最普遍的抗性相关物质,而根皮苷和阿魏酸作为重要的酚类物质因其生化性质而在植物抗病过程中发挥重要作用[26]。有研究者將水杨酸和红酵母单独使用或组合使用进行对比发现,水杨酸和红酵母组合使用能够有效防治草莓灰霉病[27];也有研究者发现,控制壳聚糖的浓度也能有效防御黄瓜灰霉病的侵染情况[28]。除此之外,水杨酸还能引起多种植物对细菌、真菌、病毒等产生抗性,如黄瓜、马铃薯[29-30]。王媛等利用外源水杨酸喷洒拟南芥(Arabidopsis thaliana)植株并接种灰霉菌后发现,PAL和POD活性的提高引起木质素含量的增加,从而阻止灰霉菌的进一步入侵[31]。此外,Wang等采用氧化还原状态的调节有助于对用β-氨基丁酸(BABA)处理的葡萄浆果中的灰霉菌进行防御,通过BABA诱导确定抗病特异性形式,说明氧化还原状态的改变参与了BABA激活的葡萄浆果的防御反应,在 10 mmol/L BABA处理引发葡萄浆果对番茄灰霉病的浸染产生了有效的抗病性[32]。
此外,物理方法如热激处理对真菌性病原体灰霉菌同样具有抑制作用[33]。电子辐射照处理能延缓草莓的发病情况,并能提高与抗病相关酶活性和抗病物质的含量[34];Forges等试验表明,将草莓植物暴露于低重复剂量的UV-C可以提高它们对灰色的抵抗力霉菌,同时避免对植物产生任何明显的负面影响[35]。随着化学试剂的大量使用,不仅加重了环境污染,还使灰霉菌的抗药性不断提高,而物理防治方法在生产上并不便利,因此研发新的抗病品种及使用生物防治极其重要。
3.2 生物防治
目前,对灰霉病具有防治效果的微生物有真菌、链霉菌、细菌、酵母,可以控制番茄、辣椒、草莓、苹果和葡萄等植物灰霉病的发生和危害,其中研究与应用较为广泛的有木霉、酵母等[36]。Tronsmo等用拟康木霉(T. pseudokoningii)来控制灰霉引起的草莓果实腐烂[36];Dik等通过比较3种不同微生物即哈茨木霉(T. harzianum) T39、出芽短梗霉(Aureobasidium pulluans)和浅白隐球酵母(Cryptococcus albidus)对黄瓜和番茄灰霉病防治效果,发现前2种微生物能够降低植物的死亡率[37]。除了利用木霉来防治植物灰霉病,Harman等还利用哈茨木霉(T. harzianum)代替异菌脲和农利灵有效防治了葡萄串腐病[38]。采用放线菌链霉菌科链霉菌属产生的武夷菌素、磷氮霉素、白肽霉素、变构霉素等将灰绿链霉菌(Streptomy griseovirides)的1个菌株制成Mycostop(灰绿链霉菌剂)菌剂,室内和田间试验均表明其防治效果较高[39-40]。酵母菌是灰霉病微生物防治研究中的又一类重要真菌,纤细假丝酵母和清酒假丝酵母可使灰葡萄孢造成的苹果伤口腐烂降低50%[41],罗伦隐球酵母(Cryptococcus laurentii)可作为草莓采后灰霉菌合成杀菌剂替代物[42]。
在生物防治灰霉病方法中,对细菌的使用也较为广泛,如芽孢杆菌(Bacillu)在防御灰霉菌侵染草莓、梨(Pyrus pyrifolia)[43-44]等有重要作用。目前,在防治植物灰霉病中应用最多的芽孢杆菌、枯草芽孢杆(B. subtilis)、多黏芽孢杆菌(B. polymyxa)、短体芽孢杆菌(B. pumilus)、等近10种[45]。现有的研究显示,利用枯草芽孢杆菌产生的抗菌素能够有效地抑制灰霉菌的感染。枯草芽孢杆菌除了对灰霉病有防治作用外,对采后柑橘青霉病、油桃褐腐病、香蕉冠腐病等均有拮抗作用[46-48]。
在使用微生物防治时,真菌、细菌等在寄主体内也产生了相应的生物防护机制,如拮抗、竞争、诱导等作用[49]。如de Meyer等报道铜绿假单孢菌(Pseudomonas aeruginosa)和哈茨木霉T39能诱导菜豆(Phaseolus vulgaris)产生水杨酸使其获得对灰霉病的抗性[50]。Daulagala等采用L-形式的假单胞菌(P. syringae),诱导几丁质酶并增强其对灰葡萄孢的抗性大白菜感染,使灰霉病病原体灰葡萄孢的感染具有增强抗性[52]。
植物还可以利用自身的免疫反应来抵抗灰霉菌的感染,如病原/损伤相关分子模式触发的免疫(P/DAMP triggered immunity,简称PTI)是植物抗灰霉病菌免疫反应的重要组成部分[53]。已有的研究表明,病原/损伤相关分子模式(pathogen/damage-associated molecular patterns,简称P/DAMP)激发的免疫反应PTI是植物抗灰霉病菌机制的主要组成部分[54-55]。采用微生物来防治微生物病害,不仅能降低成本,而且能降低对环境的污染。
3.3 农业防治
3.3.1 选用抗病品种 选择适应当地生长的抗病品种,可降低培养成本。例如,对101份不同葡萄品种进行叶片抗白腐病和灰霉病鉴定,结果显示,不同葡萄品种对白腐病与灰霉病的抗性差异明显,其中筛选出8份高抗灰霉病材料,分别为皇冠、双优、金星无核、康可、秦岭桑叶、着色香、高妻、火星无核[55];选用29个不同品种的草莓对灰霉病的抗性进行研究,结果发现,高抗品种有硕丰、甜查理、全明星、津美等4个品种[56]。研究结果可作为选育抗病新品种的亲本,也为生产栽培选择品种提供依据。
3.3.2 栽培防治 在植物栽培过程中,除了使用相应的农药进行病害防治,还可采用适当的栽培技术与农药相结合,从而大大降低病害的发生率。如在温室栽培月季,种植密度要合理,保证植株的通风和透光。通过采取通风换气、加温和科学灌溉等措施,温室内的相对湿度控制在85%以下,合理修剪,保持植株旺盛生长,及时清除病部,科学施肥,平衡植株的营养,施足有机肥,在保证氮肥的基础上,增施磷、钾肥,提高植株的抗病力。定期喷波尔多液、甲基硫菌灵、代森锰锌等农药或施放防治灰霉病的烟雾剂,预防病害发生[2]。种植黄瓜时,大棚温度控制在18~23 ℃;当湿度超过90%时,灰霉病就会比较严重,但是当温度高于25 ℃时,发病反而会有一定程度的减轻,温度高于30 ℃时不会发病,因此白天要适当提高大棚温度,从而对灰霉病进行有效控制,通常情况下,结瓜期的最佳温度设置:上午 27~30 ℃,下午20~25 ℃,晚上前半夜在17~19 ℃,后半夜在12~14 ℃[57]。
4 植物抗灰霉病分子水平研究
选择具有抗病基因和抗病相关基因是培育具有抗病特性植物的关键。伴随着分子生物学的发展,对植物灰霉病抗病相关基因及抗病基因的研究不断深入。
顶头孢霉引发剂和枯草杆菌蛋白酶(Acremonium strictum elicitor and subtilisin,AsES)是一种新型的细胞外激发子蛋白,是由草莓真菌病原体顶头孢霉的有毒分离株SS71产生的,AsES差异性地影响对水杨酸反应受损的突变体酸:茉莉酸和乙烯,这表明AsES通过这三者触发了拟南芥对灰霉菌的防御反应发信号途径[58]。雷帕霉素是一种具有抗真菌活性的大环内酯类物质,并具有抗真菌特性;王彦通过试验对雷帕霉素作用靶标蛋白相关基因进行克隆,获得灰葡萄孢菌的2个cDNA序列,即BcFKBP基因和BcTOR基因;将其作为靶细胞,利用RNA干扰技术,获得了BcTOR基因的沉默菌株,该菌株能使草莓叶片、草莓果实和番茄果实的致病能力下降[59]。从黄瓜中诱导Ⅲ类几丁质酶基因(CHI2),然后利用CHI2培养出转基因黄瓜,发现转基因黄瓜对灰霉菌具有抗性[60]。Liana利用粉红黏帚菌处理番茄,发现其产生了2种高表达蛋白,其中atpA基因的表达最高,且对番茄灰霉病产生抗性[61]。在灰霉菌侵染植物体时,对灰霉菌的6个BcPG基因功能分别进行研究,发现将BcPG1和BcPG2的基因敲除会导致突变体致病力显著下降,这表明其在侵入植物组织的过程中发挥了重要作用[62-63]。
通过转录组测序技术(RNA-seq)测序分析筛选出在菌核形成阶段高表达的基因BCIG09891、BClG14375、BClG12206、BcCVNH。这4个基因在菌核形成和致病阶段均有表达,BcCVNH基因在致病阶段表达上调,其他3个基因在菌核形成阶段表达明显上调,但敲除BcCVNH不会影响灰葡萄孢的菌核形成、菌落形态、菌丝生长速度和产酸等表型,但BcCVNH敲除转化子的致病力明显减弱,产孢量降低[68]。在番茄灰霉病抗性研究中,郭林霞构建了35S启动子驱动杜仲(Eucommia ulmoides Oliver)几丁质酶基因EuCHIT1的植物表达载体pCAMBIA1301-35S-EuCHIT1,采用農杆菌介导的愈伤转化和茎尖转化2种转化方法导入Micro-Tom番茄中,通过筛选转基因植株发现EuCHIT1基因在番茄中的表达可以提高番茄植株中病程相关蛋白基因的表达,从而增强转基因番茄植株的抗病性[65]。利用PCR技术从黑曲霉中扩增并克隆了GO基因,然后将马铃薯病原诱导型启动子(Prp1-1基因启动子)与其融合构建了植物表达载体pCAMGO,经农杆菌介导转化获得转基因草莓,经灰霉菌诱导后发现转基因草莓的抗性明显提高[66]。
拟南芥为重要的模式植物,对其研究也较为广泛,被克隆出多种抗病基因,如抗霜霉病基因RPP1、RPP2[67-68]、抗白锈病基因RAC1[69-70]、抗白粉病基因RPW8[71]等抗病基因。当然,对其抗灰霉病基因的研究也有报道。早期Mengiste等通过筛选拟南芥突变体库,获得接种病菌后感病症状明显加重的突变体——bos1(灰霉病敏感突变体),然后分离到受病菌诱导BOS1(BOTRYTIS SUSCEPTIBLE1)基因,明确BOS1基因编码R2R3MYB转录因子蛋白并与茉莉酮酸酯信号转导途径交互作用[72]。2004年,Veronese等通过筛选到灰霉病敏感的突变体bos2、bos3、bos4等,确定了BOS2、BOS3、BOS4是灰霉病菌侵染必需的3个新的独立位点[73]。通过前期研究者的一系列试验,学者利用传统mRNA差异显示技术(DDRT-PCR)和末端快速扩增技术(rapid amplification of cDNA end,RACE技术)获得一新的拟南芥抗灰葡萄孢相关基因BRG1,陈展从拟南芥SALK库中获得BRG1基因的T-DNA插入突变体brg1,将突变体brg1和野生型Col-0进行灰葡萄孢接种,发现野生型表现出典型的抗病性,而突变体植株表现出明显的感病症状,初步确定BRG1基因与拟南芥对灰葡萄孢的抗性相关,然后通过构建AtBRG1基因的表达载体pCAMBIA1300/BRG1将其整合到brg1突变体和 Col-0生态型基因组中,进行接种试验后,进一步确定了BRG1基因在拟南芥抗灰葡萄孢侵染过程中发挥了重要作用[74]。
对番茄研究也较为丰富。在1926—1931年间,MacArthur利用形态标记绘制了第1张番茄遗传图谱[75],Tanksley等于1992年构建了第1张番茄高密度的RFLP分子遗传连锁图谱,该图谱包括1 030个分子标记、1 276个图谱单位[76]。经过几十年的研究,Suliman-Pollatschek等利用来自潘那利番茄(Lycopersicon pennellii)的永久群体,还构建了扩增片断长度多态性(AFLP)、简单重复序列(SSR)及单核苷酸多态性(SNP)图谱[77]。张孝峰等对来自抗灰霉病多毛番茄PI134417的BC1分离群体进行数量性状位点(QTL)分析,共发现2个控制番茄叶部抗灰霉病的位点,1个位于LG3,为抗病QTL,另1个位于LG13,为感病QTL(图6-A、图6-B),采用同样的方法发现控制番茄果实抗灰霉病的位点1个,为抗病QTL(图6-C)[75]。
目前对草莓全部基因组尚未测序出来,但根据相关的分子标记,已经建立了几张关于草莓的遗传图谱。在已有的研究中,研究者采用分离群体分组分析(bulked segregate analysis,简称BSA)方法随机扩增多态性DNA标记(random amplified polymorphic DNA,简称RAPD)筛选出7个与草莓抗霉病基因Rpf1连锁的标记,其中距离最近的为1.7 cM,以及利用BSA法选择AFLP标记进行筛选,得到4个与草莓抗炭疽病基因Rca2连锁的标记[78-79]。曹娴根据Sargent等构建的关于草莓遗传连锁图谱[80],对119对引物进行连锁分析,最后一个与抗灰霉病基因遗传距离为15.9 cM的标记UFFxa01H05,该标记在Sargent等的连锁图谱中位于第四连锁群,但其具体是在哪一侧还有待深入研究[11]。
葡萄为四大水果之一,是第4种完成测序的开花植物[81]。与白粉病相关的抗病基因如RPW8(包含RPW8.1、RPW8.2等2个基因形式)在宿主细胞氧化损伤介导的抗白粉病机制中起重要的作用[82]。另外在代谢调节过程中,葡萄RING-H2-TYPE泛素连接酶基因VpRH2在受到白粉病菌诱导后表达量显著增加,研究也发现,VpRH2能与VpGRP2A直接作用参与调控,VpGRP2A过量表达后能提高VpRH2的表达水平,VpRH2却抑制VpGRP2A的表达,这表明VpRH2与VpGRP2A相互调控参与葡萄对白粉病的防御反应[83]。将圆叶葡萄和欧洲葡萄Dzhandzhal Kara杂交培育并通过筛选得到的RUN1REN1株系,该植株对白粉病表现出强大的抗性,以致于该株系成为葡萄抗病基因挖掘的新型资源[84]。在葡萄的抗灰霉病研究中,多聚半乳糖醛酸酶抑制蛋白(polygalacturonase-inhibiting protein,简称PGIPs)能特异性地抑制真菌内源多聚半乳糖醛酸酶(polygalacturonase,简称PG),当植株的叶片感染灰霉病时,PGIP能有效抑制病原菌的生长和病斑扩散[85]。在闫筱筱的研究中,其利用葡萄基因组数据库鉴定获得葡萄类甜蛋白(TLPs)基因家族33个成员,按照染色体的位置命名为VvTLP1~VvTLP33,接种灰霉菌后发现部分基因的表达量增加[86]。
研究报道,张军辉采用室内离体叶片菌丝块接种法,对杂交后代进行灰霉病抗病性鉴定,结合已经构建的葡萄分子遗传连锁图谱和抗性表型值,运用区间作图法对葡萄灰霉病抗性进行QTL定位。在定位区段内找出有关抗性的基因,筛选出3个抗病候选基因SGT1、MYB44、ERF023,而这3种抗病候选基因可能在抗病品种和感病品种灰霉病抗性中发挥着不同程度的作用[87]。这些抗病基因和抗病相关基因的研究不仅有助于明确该基因在植物中的作用,也为开发培养新抗病品种方面奠定了重要基础,并为其提供了理论依据。
月季作为世界四大切花之一[88],在云南被广泛种植,其在园林、食用和商业方面有着巨大的经济价值,但深受灰霉病的危害。灰霉菌侵染月季后,其孢子会分泌大量的细胞壁降解酶,主要发挥作用的是果胶酶,寄主细胞壁中的果胶在灰霉菌内聚半乳糖醛酸酶类(PGs)的作用下分解为寡聚半乳糖醛酸苷(oligogalacturonides,简称OGs),从而使灰霉菌成功侵入植物[89-90]。目前,对月季灰霉病的研究较少,但对黑斑病[91]、白粉病的研究较多,其中对月季白粉病的研究較为深入[92-94]。周青等分别利用SSRs、AFLPs分别建立了二倍体月季分子连锁图谱和四倍体月季遗传连锁图谱,这为月季后期的分子研究奠定了科学基础[95-96]。植物模式识别受体根据其胞外结构域的不同分为3类,其中一类细胞壁连接的类受体激酶(WAK)类受体可结合植物自身细胞壁降解的长链寡聚半乳糖醛酸(OGs)激活下游的抗性反应,阻止灰霉菌的进一步侵害,由此推测WAK类受体可能参与灰霉病的抗性反应[97-99]。也有研究者对WAXs在月季中的作用进行了深入研究。
5 展望
灰霉病作为危害植物的主要真菌病害之一,不管是对园林植物还是农作物均带来了巨大的经济损失。我国种植草莓面积较大,但由于灰霉病的危害,一般会造成减产20%~30%,严重时高达50%以上,这对果农造成了不可小觑的经济损失[6]。葡萄在贮藏过程中也常遭受灰霉病的危害,严重时造成的产后损失高达50%[100]。灰霉病作为番茄栽培的重要病害,会造成番茄减产20%~30%,甚至会高达50%。在园林观赏植物中,月季在长途冷藏运输过程中也深受其害,通过调查发现,在极端条件下可造成70%以上的采后损失。可见,灰霉病对植物的危害性是不可忽視的。
目前,对灰霉病的防治主要采用化学防治,在生产上常用的化学试剂如多菌灵、二甲酰亚胺类、多霉灵等不仅会造成化学药物残留危害人体,还会对环境造成污染。在生物防治措施中常采用木霉对其进行防治,但也主要针对经济作物,如番茄、草莓、葡萄等。园林观赏植物也为我国带来了不可忽视的经济价值,但对园林观赏植物的防治的研究较少,仅对红麻、芍药等[7,101]有所研究。所以,今后应当关注观赏植物灰霉病的相关研究。针对主要花卉(如月季、菊花、百合等)灰霉病的研究,不仅能提高花卉植物的观赏价值与产量,同时还能提高花农的经济收入,并且通过研究灰霉病的抗病基因及其机制,将为研发花卉抗病新品种、减少农药的使用、保护生态环境等方面带来显著的效果。
参考文献:
[1]孟祥东,傅俊范,周如军,等. 保护地主要园艺作物灰霉病菌生物学特性比较研究[J]. 沈阳农业大学学报,2007,38(3):322-326.
[2]郎立新,蒋兰玲. 切花月季温室灰霉病[J]. 中国花卉园艺,2006(20):41.
[3]费林瑶,高 征,费琳琪,等. 日光温室切花月季灰霉病的发生与控制[J]. 辽宁农业职业技术学院学报,2007,9(1):12-13.
[4]赵 杨,苗则彦,李 颖,等. 番茄灰霉病防治研究进展[J]. 中国植保导刊,2014(7):21-29.
[5]张国珍,钟 珊. 草莓灰霉病研究进展[J]. 植物保护,2018,44(2):1-10.
[6]张云峰,管会林,谢庆华,等. 有机物发酵液对温室大棚月季灰霉病发病率及采后性状的影响[J]. 北方园艺,2008(11):157-161.
[7]龚赛杰. 芍药灰霉病抗性差异的转录组测序分析研究[D]. 扬州:扬州大学,2016:16-18.
[8]王 艳,杜 弢,曾翠云,等. 甘肃省黄芩灰霉病的发生及其病原鉴定[J]. 中国现代中药,2017,19(12):1735-1738.
[9]王迪轩. 大棚蔬菜灰霉病的发生原因与综合防治[J]. 农村实用技术,2017(4):44-45.
[10]张 静,吴明德,杨 龙,等. 设施蔬菜灰霉病的发生与防治技术[J]. 长江蔬菜,2019(6):25-28.
[11]曹 娴. 草莓抗灰霉病基因定位及榉树种质资源多样性的ISSR分析[D]. 上海:上海交通大学,2011:3-4.
[12]Bristow P R,Mcnicol R J,Williamson B. Infection of strawberry flowers by Botrytis cinerea and its relevance to grey mould development[J]. Annals of Applied Biology,1986,109(3):545-554.
[13]高智谋,李艳梅,李喜玲,等. 源自不同寄主的灰葡萄孢生物学特性的比较研究[J]. 菌物学报,2009,28(3):370-377.
[14]Staats M,Baarlen P V,Kan J V. Molecular phylogeny of the plant pathogenic genus botrytis and the evolution of host specificity[J]. Molecular Biology and Evolution,2005,22(2):333-346.
[15]陈忠宪,姚环宇,张学明,等. 草莓灰霉病的发生与防治措施[J]. 吉林农业,2018(20):68-69.
[16]崔志婧. 灰霉菌产孢类群的划分及其遗传多态性分析[D]. 上海:华东师范大学,2012:2-9.
[17]赵菊润,席刚俊,赵桂华. 紫皮石斛上灰葡萄孢的分离和鉴定[J]. 西部林业科学,2014(2):42-47.
[18]邬 颖. 灰霉病防治[J]. 林业与生态,2018(5):38-38.
[19]席雪丽. 灰霉菌侵染拟南芥过程中ACD5的功能分析[D]. 广州:中山大学,2011:2-3.
[20]魏伶俐. 灰葡萄孢毒素的产生条件及其对番茄植株的致病作用[D]. 扬州:扬州大学,2007:21-30.
[21]Plourde V,Gasconbarré M,Willems B,et al. Choledocho-ureteral anastomosis in the rat,a new experimental model of long-term,total,internal bile diversion[J]. Journal of Hepatology,1993,17(3):373-376.
[22]叶艳英,熊春晖,袁经相,等. 植物源杀菌剂防治灰霉病研究进展[J]. 生物灾害科学,2016,39(1):27-31.
[23]陈 琪. 灰葡萄孢对速克灵抗性遗传及病理生理学的研究[D]. 合肥:安徽农业大学,2004:7-16.
[43]Singh V,Devemll B. Baeillus subtilis as control agent against fungal pathogens of citrus fruit[J]. Trans Br Mycol Soc,1984,83(3):487-490.
[44]Mad M,Guizzardi M,Pratctla P C. Biological control of grey mold in pears by antiagonistic baeterla[J]. Biological Control,1996,7:30-37.
[45]马 晨,周欣玥,王 全. 番茄灰霉病生物防治的研究进展[J]. 园艺与种苗,2018,38(2):61-62.
[46]Arras G. In vitro and in vivo control of Penicillium digitatum and Botrytis cinerea in citrus fruit by Bacillus subtilis strains[J]. Agri-coltura Mediterranea,1994,124(1):56-61.
[47]Fan Q,Tian S P,Li Y X,et al. Biological control of postharvest brown rot in peach and nectarine fruits by Bacillus subtilis (B-912)[J]. Acta Botanica Sinica,2000,42(11):1137-1143.
[48]张荣意,林运萍,谭志琼,等. 4株枯草芽孢杆菌对香蕉冠腐病的防效测定[J]. 热带农业科学,2004,24(2):4-8.
[49]孙健健. 灰霉病的微生物防治研究进展[J]. 天津化工,2012,26(4):11-14.
[50]de Meyer G,Bigirimana J,Elad Y,et al. Induced systemic resistance in Trichoderma harzianum T39 biocontrol of Botrytis cinerea[J]. European Journal of Plant Pathology,1998,104(3):279-286.
[51]童蕴慧,纪兆林,徐敬友,等. 灰霉病生物防治研究进展[J]. 中国生物防治,2003,19(3):131-135.
[52]Daulagala P P,Allan E J,Daulagala P P,et al. L-form bacteria of Pseudomonas syringae pv. phaseolicola,induce chitinases and enhance resistance to Botrytis cinerea,infection in Chinese cabbage[J]. Physiological and Molecular Plant Pathology,2003,62(5):253-263.
[53]張 燕,夏更寿,赖志兵. 植物抗灰霉病菌分子机制的研究进展[J]. 生物技术通报,2018,34(2):10-24.
[54]Tesfaye M. Plant immunity to necrotrophs[J]. Annual Review of Phytopathology,2012,50(1):267-294.
[55]刘丽婷. 葡萄品种资源叶片白腐病和灰霉病的抗病鉴定及评价[D]. 沈阳:沈阳农业大学,2018:14-21.
[56]贾 薇. 不同草莓品种对白粉病和灰霉病的抗性及其组织生理特征[D]. 保定:河北农业大学,2018:8-15.
[57]杜文昌. 浅谈北方大棚黄瓜灰霉病的发生与防治[J]. 农业开发与装备,2018(9):187-188.
[58]Haelconrad V,Aboumansour E,DíazRicci J C,et al. The novel elicitor AsES triggers a defense response against Botrytis cinerea in Arabidopsis thaliana[J]. Plant Science,2015,241:120-127.
[59]王 彦. 雷帕霉素拮抗灰葡萄孢菌的作用研究及分子机制初探[D]. 杭州:浙江农林大学,2016:45-49.
[60]Kishimoto K,Nishizawa Y,Tabei Y,et al. Transgenic cucumber expressing an endogenous class Ⅲ chitinase gene has reduced symptoms from Botrytis cinerea[J]. Journal of General Plant Pathology,2004,70(6):314-320.
[61]Liana O M D. 粉红黏帚菌诱导番茄灰霉病抗性的研究和番茄中关键抗性基因atpA的功能鉴定[D]. 哈尔滨:哈尔滨工业大学,2014:60-64.
[62]Kars I. The role of pectin degradation in pathogenesis of Botrytis cinerea[J]. Wur Wageningen Ur,2007.
[63]Lai Z B,Tesfaye M. Genetic and cellular mechanisms regulating plant responses to necrotrophic pathogens[J]. Current Opinion in Plant Biology,2013,16(4):505-512.
[64]薛晓梦. 灰葡萄孢致病和菌核形成相关基因功能的初步研究[D]. 武汉:华中农业大学,2016:43-51.
[65]郭林霞. 转杜仲几丁质酶基因EuCHIT1番茄对灰霉病抗性研究[D]. 贵阳:贵州大学,2016:42-51.
[66]金万梅,尹淑萍,鲁韧强,等. GO基因对草莓遗传转化及抗病性鉴定[J]. 分子植物育种,2005,3(6):797-800.
[67]Botella M A,Parker J E,Frost L N,et al.Three genes of the Arabidopsis RPP1 vomplex resistance locus recognize distinct Peronospora parasitica avirulence determinants[J]. Plant Cell,1998,10:1847-1860.
[68]Sinapidou E,Williams K,Nott L,et al. Two TIR:NB:LRR genes are required to specify resistance to Peronospora parasitica isolate Cala2 in Arabidopsis[J]. Plant Journal,2004,38(6):898-909.
[69]Borhan M H,Holub E B,Beynon J L,et al. The Arabidopsis TIR-NB-LRR gene RAC1 confers resistance to albugo candida(white rust)and is dependent on EDS1 but not PAD4[J]. Molecular Plant-Microbe Interactionst,2004,17(7):711-719.
[70]Century M H,Holub E B,Beynon J L,et al. The Arabidopsis TIR-NB-LRR gene RAC1 confers resistance to albugo candida(white rust)and is resistance[J]. Science,1997,278(5345):1963-1965.
[71]Xiao S,Ellwood S,Calis O,et al. Broad-spectrum mildew resistance in Arabidopsis thaliana mediated by RPW8[J]. Science,2001,291(5501):118-120.
[72]Mengiste T,Chen X,Salmeron J,et al. The BOTRYTIS SUSCEPTIBLE1 gene encodes an R2R3MYB transcription factor protein that is required for biotic and abiotic stress responses in Arabidopsis[J]. Plant Cell,2003,15(11):2551-2565.
[73]Denby K J,Kumar P,Kliebenstein D J. Identification of botrytis cinerea susceptibility loci in Arabidopsis thaliana[J]. Plant Journal,2004,38(3):473-486.
[74]陈 展. 拟南芥抗灰霉病相关基因AtBRG1的功能研究[D]. 保定:河北农业大学,2010:25-32.
[75]张孝峰. 番茄分子遺传图谱的构建及抗灰霉病QTL的定位[D]. 呼和浩特:内蒙古农业大学,2006:9-10.
[76]Tanksley S D,Ganal M W,Prince J P,et al. High density molecular linkage maps of the tomato and potato genomes[J]. Genetics,1992,132(4):1141-1160.
[77]Suliman-Pollatschek S,Kashkush K,Shats H,et al. Generation and mapping of AFLP,SSRs and SNPs in Lycopersicon esculentum[J]. Cellular & Molecular Biology Letters,2002,7(2A):583-597.
[78]Haymes K M,Henken B,Davis T M,et al. Identification of RAPD markers linked to a phytophthora fragaria resistance gene (Rpf1) in the cultivated strawberry[J]. Theor Appl Genet,1997,94:1097-1101.
[79]Lerceteau-Khler E,Guérin G,Denoyes-Rothan B. Identification of SCAR markers linked to Rca2 anthracnose resistance gene and their assessment in strawberry germ plasm[J]. Theoretical & Applied Genetics,2005,111(5):862-870.
[80]Sargent D J,Clarke J,Simpson D W,et al. An enhanced microsatellite map of diploid Fragaria[J]. Theoretical and Applied Genetics,2006,112(7):1349-1359.
[81]Jaillon O,Aury J M,Noel B,et al. The grapevine genome sequence suggests ancestral hexaploidization in major angiosperm phyla[J]. Nature,2007,449(7161):463-467.
[82]Eckardt N A. The Arabidopsis RPW8 resistance protein is recruited to the extrahaustorial membrane of biotrophic powdery mildew fungi[J]. The plant cell online,2009,21(9):2543-2543.
[83]Wang L,Xie X Q,Yao W K,et al. RING-H2-type E3 gene VpRH2 from Vitis pseudoreticulata improves resistance to powdery mildew by interacting with VpGRP2A[J]. J Exp Bot,2017,68:1669-1687.
[84]Agurto M,Schlechter R O,Armijo G,et al. RUN1 and REN1 pyramiding in grapevine (Vitis vinifera cv. crimson seedless)displays an improved defense response leading to enhanced resistance to powdery mildew (Erysiphe necator)[J]. Frontiers in Plant Science,2017,8(758):758.
[85]Agüero C B,Uratsu S L,Greve C,et al. Evaluation of tolerance to Pierces disease and Botrytis in transgenic plants of Vitis vinifera L. expressing the pear PGIP gene[J]. Molecular Plant Pathology,2005,6(1).
[86]闫筱筱. 中国野生毛葡萄转录因子JAZ和TLP基因抗病功能研究[D]. 杨凌:西北农林科技大学,2018:13-39.
[87]张军辉. 葡萄灰霉病抗性QTL定位及候选基因研究[D]. 沈阳:沈阳农业大学,2018:13-26.
[88]蒋 妮,白丹宇,宋利沙,等. 棘孢木霉F2菌株对三七灰霉病的生物防治作用[J]. 江苏农业科学,2018,46(20):94-97.
[89]张金云,王清羿. 切花月季品种的比较及其花枝生产规律的研究[J]. 安徽农业科学,2004,32(5):945-946.
[90]Govrin E M,Levine A. The hypersensitive response facilitates plant infection by the necrotrophic pathogen Botrytis cinerea[J]. Current Biology,2000,10(13):751-757.
[91]Ten H A,Breuil W,Wubben J P,et al. Botrytis cinerea endopolygalacturonase genes are differentially expressed in various plant tissues[J]. Fungal Genetics and Biology,2001,33(2):97-105.
[92]張真建,向贵生,陈 敏,等. 月季黑斑病及其抗性研究进展[J]. 江苏农业科学,2019,47(5):78-84.
[93]纪 程,邱显钦,张 颢,等. 中国古老月季资源的白粉病抗性鉴定[J]. 北方园艺,2013(9):146-148.
[94]邱显钦. 月季抗白粉病基因Mlo的克隆和功能分析[D]. 武汉:华中农业大学,2015.
[95]周 青. 高通量SSR标记开发及二倍体月季分子连锁图谱构建[D]. 武汉:华中农业大学,2014.
[96]于 超. 四倍体月季遗传连锁图谱的构建及部分观赏性状的QTLs分析[D]. 北京:北京林业大学,2015.
[97]Kohorn B D. The state of cell wall pectin monitored by wall associated kinases:a model[J]. Plant Signaling & Behavior,2015,10(7):e1035854.
[98]Kanneganti V,Gupta A K. Wall associated kinases from plants—an overview[J]. Physiol Mol Biol Plant,2008,14(1/2):109-118.
[99]Thomma B P,Penninckx I A,Broekaert W F,et al. The complexity of disease signaling in Arabidopsis[J]. Current Opinion in Immunology,2001,13(1):63-68.
[100]陈宇飞,文景芝,李立军. 葡萄灰霉病研究进展[J]. 东北农业大学学报,2006,37(5):693-699.
[101]陈玉森,祁建民,方树民. 红麻灰霉菌生物学特性及其交叉感染[J]. 福建农林大学学报(自然科学版),2004,33(3):308-312.
