水产养殖废水处理的菌藻共生系统中藻种优选及氮、磷转化特性
2020-09-16黄静依张皓驰李先宁
黄静依,张皓驰,李先宁
(东南大学能源与环境学院,江苏南京 210096)
我国是世界规模最大的水产养殖国家。新型生态养殖模式循环水养殖系统(recirculating aquaculture system,RAS)将水产养殖系统分为集中养殖区和水体净化区等单元[1],在循环利用水和氮、磷等资源的同时将养殖废水净化,最终实现水产养殖污染的零排放。菌藻共生系统利用细菌和微藻两类生物之间的生理功能协同作用来净化污水[2]。然而,单独使用菌藻共生系统处理水产养殖废水时需考虑有效的微藻拦截或回收方法,需避免大量微藻流入养殖水体形成水华等环境灾害。基于RAS理念,“高效菌藻共生单元-水生动物滤食单元-水耕蔬菜滤床单元”三级生物生态耦合处理工艺被创新提出。其中,第一级高效菌藻共生单元利用菌藻共生体系将水产养殖废水中溶解态的氮、磷同化为颗粒态生物质,有利于在后续处理单元中被水生动植物滤食和滤除。这种多级处理工艺既节约成本又避免了二次污染,通过收获水生动植物产品还能取得一定的经济收益。
作为三级生物生态耦合处理工艺的起始环节,菌藻共生系统的高效稳定运行至关重要。季节温度变化对开放系统中微藻生长的影响是本工艺中需要重点考虑的问题。此外,目前对菌藻共生系统处理废水的研究聚焦于氮、磷去除率,且常以蓝、绿藻门为研究对象,对于处理过程中氮、磷在不同形态间的转化规律研究较少,对于更多门类微藻的应用可行性研究有限,共生系统中细菌群落结构的变化及功能仍不明确。值得特别说明的是,目前的研究尚未从微藻进一步被水生动物滤食去除的角度探讨微藻的筛选标准。本研究工艺中,为保证微藻在后续单元中被有效去除,滤食性动物对其的同化率也作为微藻的筛选条件之一。因此,筛选出不同季节温度适应性强、生长稳定且易于被动物滤食消化的藻种具有重要的理论研究和现实意义。
本研究根据微藻的生长特性、营养特征等,选用小球藻属(Chlorella,绿藻门)、卵囊藻属(Oocystis,绿藻门)、隐藻属(Cryptomonas,隐藻门)、舟形藻属(Navicula,硅藻门)的4种微藻作为研究对象,考察其在不同模拟季节温度下的生长状况,并综合考虑滤食动物对其的滤食性能,筛选出不同温度下处理水产养殖废水的适宜藻种;结合微生物群落结构分析,探究菌藻共生系统中微藻和细菌在氮、磷转化中的作用,为菌藻共生系统的工程应用提供理论基础。
1 试验材料与方法
1.1 试验用藻种及菌种
本研究试验藻种均采购自中国科学院淡水藻种库,普通小球藻(Chlorellavulgaris)和卵囊藻(Oocystissp.)采用BG11培养基,卵形隐藻(Cryptomonasobovata)采用AF-6培养基,舟形藻(Naviculapelliculosa)采用CSI培养基进行无菌扩培,培养至对数增长期后,即可用于试验。试验菌种由南京城东污水处理厂二沉池采集的活性污泥经实验室扩培获得。微藻、细菌的培养及试验均在人工气候光照培养箱(NGC-250P型,上海一恒)中进行,培养温度为(25±0.5)℃,光照强度为3 000~4 000 lux,光暗比为12 h∶12 h,每天定时摇瓶3次。
1.2 试验用模拟水产养殖废水
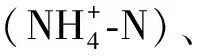

表1 模拟水产养殖废水指标Tab.1 Water Quality Index of Simulated Aquaculture Wastewater


表2 模拟无机水产养殖废水指标Tab.2 Water Quality Index of Simulated Inorganic Aquaculture Wastewater
1.3 试验设计
1.3.1 不同环境温度下的藻种筛选试验
本试验采用无菌纯藻在模拟无机水产养殖废水(表2)中进行。在250 mL锥形瓶中加入150 mL无机模拟废水,瓶口包裹无菌透气封口膜,高压蒸汽灭菌锅灭菌(121 ℃,30 min),冷却至室温后,在超净工作台中接种1%藻种(v/v)。4种微藻在5、10、15、25、30 ℃这5种温度下分别进行生长培养试验。试验期间的光照培养箱条件:光照强度为3 000~4 000 lux,光暗比为12 h∶12 h。每批试验进行14 d。取样采用破坏性取样方式,每2 d取样1次,取整瓶水样进行水质和生物量分析。每个取样点设置3个平行,每天定时摇动培养瓶3次。
1.3.2 菌藻在共生系统中的作用
在温度筛选试验的基础上选出2种微藻,在模拟水产养殖废水(表1)中进行菌藻共生系统研究试验。在250 mL锥形瓶中加入150 mL模拟废水,灭菌处理后,2种微藻试验组分别接种1%微藻(v/v)+1%细菌(v/v),另外设置1组不加菌藻的空白对照组。在光照培养箱中(25±0.5)℃、3 000~4 000 lux光照强度、 12 h∶12 h光暗比条件下,培养16 d。每2 d进行1次破坏性取样,每个点设置3个平行,每天定时摇动培养瓶3次。
1.4 水质指标测定
CPN(PP)=CTN(TP)-CTDN(TDP)
(1)
(2)
(3)
(4)
1.5 生物量测定及细菌群落多样性分析
菌、藻生物量的测定与水质测定同时进行。由于各试验组间微藻种类、大小不同,微藻生物量用单位体积中微藻干重表示,用重量法(GB 11901—1989)测定;细菌生物量采用DAPI荧光染色计数法,在荧光显微镜(ECLIPSE Ci-L,日本Nikon公司)下计数得到细菌密度。
生物对数增长期的比生长速率(μ)由式(5)计算。
(5)
其中:t2-t1——某一时间间隔,d;
x1——间隔开始时微藻或细菌的生物量,mg/L或个/mL;
x2——间隔终结时微藻或细菌的生物量,mg/L或个/mL;
μ——生物对数增长期的比生长速率,d-1。

图1 不同温度下各微藻生长曲线Fig.1 Growth Curve of Each Algae under Different Temperatures
各组试验结束时,取50 mL均质的悬浊藻液,以8 000 r/min离心15 min,弃去上清液,用无菌水从离心管中洗出沉淀物,测定生物质氮、磷,测定方法与TN、TP相同。菌藻共生试验前后,采集微生物样品,由北京奥维森基因科技有限公司进行16S rRNA(V3~V4区)扩增子高通量测序,分析试验前后细菌群落结构的差异。
1.6 数据处理与统计分析
利用Excel 2016对数据进行处理,各组试验数据的显著性差异分析利用SPSS 21.0软件进行,显著水平P取0.05,P<0.05说明2组数据具有显著性差异,反之则无显著性差异。数据表示方式为平均值±标准偏差。
2 结果与讨论
2.1 不同环境温度下藻种筛选试验
5~30 ℃下,4种微藻在无菌无机模拟废水中的生长曲线如图1所示。微藻对数增长期的平均比生长速率μ及最高生物量如表3所示。结果表明,温度对各微藻的生长均有显著影响,且不同藻种对温度的适应性差异显著。小球藻、卵囊藻、隐藻都在25 ℃下生长最佳,达到各自最高的μ值和最高生物量,分别为0.424、0.388、0.698 d-1和140、114、149 mg/L。而舟形藻在15 ℃下生长最好,该温度下其μ值和最高生物量分别为0.427 d-1和83 mg/L。低温和高温对各种微藻生长均有一定的抑制作用。30 ℃高温对舟形藻生长抑制极为明显,舟形藻经4 d缓慢增长至17 mg/L后即迅速衰亡。温度低于15 ℃时,小球藻和卵囊藻2种绿藻生长受到明显抑制;低于10 ℃时,2种绿藻生长6 d后即进入衰亡期;5 ℃时,小球藻和卵囊藻的最高生物量与25 ℃时相比分别降低了127 mg/L和104 mg/L。隐藻在各温度条件下均有4种微藻中最大的μ值和最高生物量,但随着温度下降,其生长也受到明显抑制,最高生物量显著下降。此外,隐藻生长周期较短,各温度条件下,隐藻生长8~10 d后即进入稳定期或衰亡期,藻液由深绿色逐渐变为黄绿色;隐藻具有鞭毛,镜检观察到试验初期隐藻细胞快速运动,8~10 d后藻细胞活性明显减弱。
选取适宜微藻生长的25 ℃,比较相同温度下各微藻处理组中DIN、DIP与生物质氮、磷的变化情况,如图2所示。结果表明,水体中DIN、DIP的去除量与微藻生物质氮、磷的积累量无显著差异,基本成等价关系(P>0.05)。14 d小球藻、卵囊藻、舟形藻、隐藻试验组DIN的去除量分别为5.98、3.33、3.76、6.42 mg/L,DIP的去除量分别为1.08、1.11、0.96、1.20 mg/L。隐藻组具有最高的DIN、DIP去除率和生物质氮、磷积累量。

表3 不同温度下各微藻对数增长期平均增长率及最高生物量Tab.3 Average Growth Rate and Highest Biomass of Each Algae under Different Temperatures

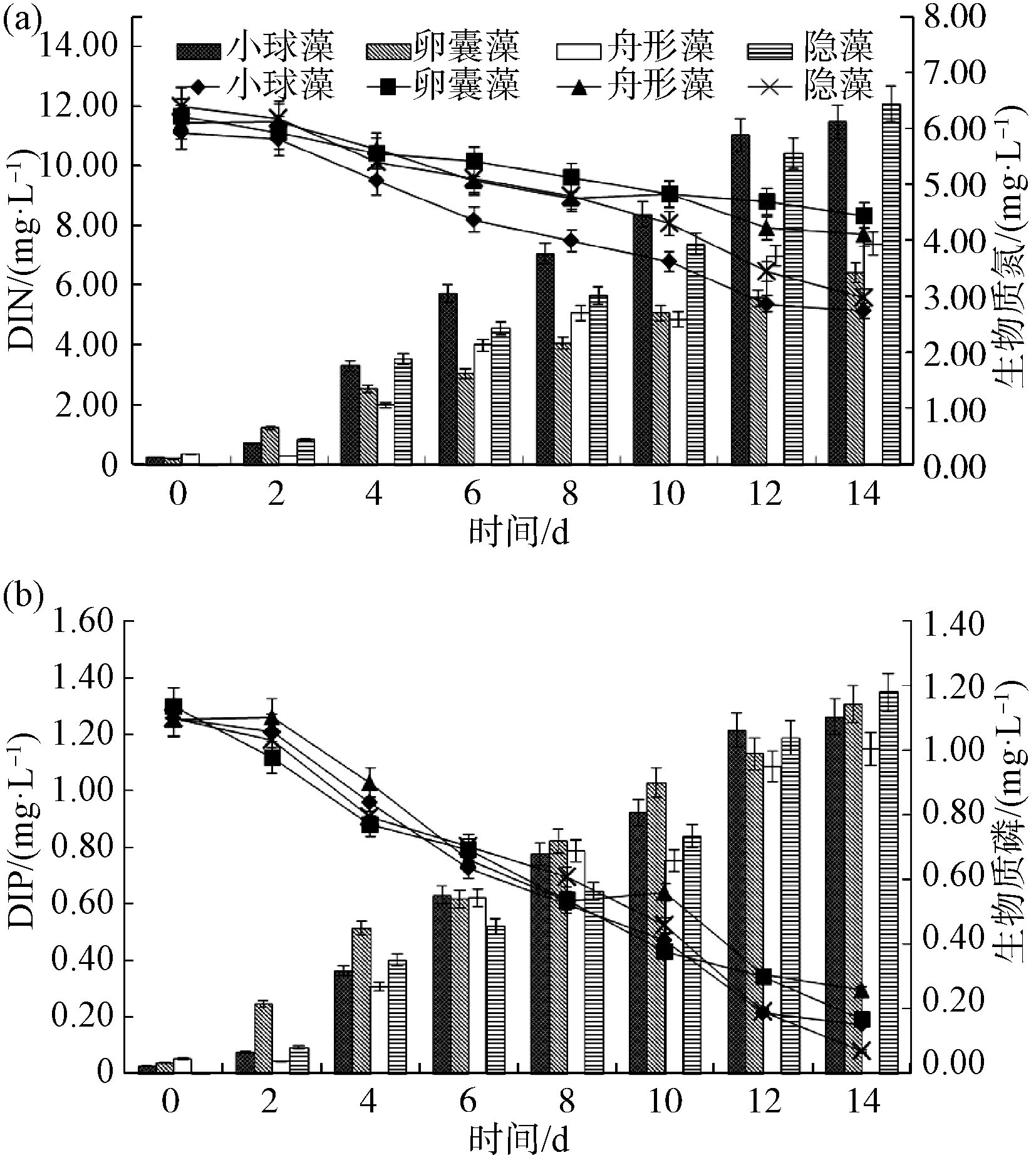
图2 25 ℃时各试验组DIN、DIP(折线图)及生物质氮、磷变化(柱状图)Fig.2 Changes of DIN, DIP (Line Chart) and Biomass Nitrogen, Phosphorus (Histogram) in Each Group at 25 ℃

图3 25 ℃时隐藻组各形态氮(a)和磷(b)的收支平衡Fig.3 Nitrogen(a) and Phosphorus(b) Balancing of Cryptomonas obovata Group at 25 ℃

表4 25 ℃下各微藻平均生物质氮、磷含量Tab.4 Average Biomass Nitrogen and Phosphorus Contents of Algae at 25 ℃
不同藻种对高温和低温的耐受性存在显著差异。通常,温度可以通过影响微藻细胞结构和酶的活性影响其代谢过程。高温会破坏微藻生物膜的功能键,膜结构破坏,阻碍微藻各种生理代谢过程;低温可使微藻脂膜受损,改变酶的活性,降低细胞对营养物的利用率[3-5]。温度还会对微藻叶绿素荧光活性、叶绿素含量产生影响。薄香兰等[6]发现,15 ℃低温时,小球藻的光合机构受到明显抑制,从而影响了其营养摄取和生长。本研究结果表明,小球藻在25~30 ℃较高温度内表现出理想的生长状态,此时小球藻生长稳定且生物质氮、磷含量较高,是滤食性动物的合适饵料。因此,小球藻适宜夏秋高温季节应用于水产养殖废水的处理。
舟形藻对低温有较好的适应性,长江下游地区冬春季硅藻种类相对夏秋更为丰富[10]。Iris等[11]研究了生长在北极地区的舟形藻(Naviculaperminuta)的生理,发现该藻在寒冷黑暗条件下降低基础代谢的同时可利用体内的储能物质三酰甘油(TAG)和游离脂肪酸(FFA)进行内源代谢,从而维持生长。舟形藻同时又是一种重要的商业饲料,营养价值高,滤食性动物同化率高。尽管如此,舟形藻在低温下占优势的一大原因是绿藻受到了明显抑制,舟形藻本身的生物量很低,且生长缓慢。因此,尽管舟形藻低温适应性强且易于被动物滤食,但并非处理水产养殖废水的理想藻种。
隐藻是浮游动物的重要食物,其对各个季节温度具有广泛的适应性,低温下也具有较高的生长速率和最高生物量,是理想的应用藻种。Wirth等[12]研究了温度与光照对隐藻生长的交互影响,发现在10~28 ℃时,隐藻的生长受温度影响较小,且在20 ℃以下时生长速率更高。
各微藻生物质氮、磷占比表明,小球藻和隐藻具有相近的氮、磷含量。费志良等[13]研究了滤食性动物三角帆蚌对不同微藻的滤食类和消化率,其中,对隐藻的的滤食率和消化率分别为23.0%和41.1%,小球藻为44.3%和75.2%,舟形藻为77.7%和84.4%。可见,滤食性动物对不同藻种的同化率:舟形藻>小球藻>隐藻。
综合考虑温度生长和动物滤食因素,5~15 ℃低温时,隐藻能够保持较好的生长状态,因此,冬春低温季节应选用隐藻作为水处理藻种;25~30 ℃高温时,小球藻和隐藻均有较高的生长速率和氮、磷同化率,但考虑到滤食性动物对小球藻的同化率更高,而隐藻生长周期较短,因此,选用小球藻作为夏秋高温季节的水处理藻种。
2.2 菌藻在共生系统中的作用
2.2.1 菌藻共生系统中的生物量变化
细菌与微藻具有利用O2和CO2、有机物和无机物并产生互补的生理特性,且菌藻可分泌促进彼此生长的促进因子,使其能够形成高效的菌藻共生系统。罗龙皂等[14]的研究表明,添加有机降解菌不仅有助于促进微藻生长,还能促进废水中碳、氮、磷的去除效果。25 ℃时,小球藻-菌、隐藻-菌共生试验组的生物量变化如图4所示。结果表明,在相同的环境条件及水产养殖废水氮、磷营养物水平下,菌藻共生系统中小球藻、隐藻的最高生物量分别达到194、215 mg/L,细菌密度达到7.00×106、8.80×106个/mL,微藻生物量比纯藻系统分别高出54 mg/L和66 mg/L,且隐藻组的微藻和细菌增长速率及最高生物量均高于小球藻组,隐藻与细菌形成了更为高效的菌藻共生系统。

图4 25 ℃时小球藻/隐藻-细菌试验组生物量变化Fig.4 Growth of Chlorella, Cryptomonas and Symbiotic Bacteria at 25 ℃
2.2.2 菌藻共生系统中的pH、DO变化
25 ℃时,各处理组pH、DO的变化分别如图5、图6所示。试验期间,对照组pH、DO均无显著变化(P>0.05),表明非生物作用对pH、DO变化的影响可忽略不计。在菌藻共生系统中,微藻光合作用对CO2的利用以及O2的释放可明显升高系统内的pH和DO,而菌藻呼吸作用则会降低系统内的pH和DO。本试验中,小球藻、隐藻组试验初始pH值均为6.8,2 d时两组的pH值均略微降低,分别为6.5和6.6。由图4微藻生长曲线可知,此时2种微藻仍处于生长适应期,光合作用较弱,菌藻的呼吸作用导致水体pH降低。随后,小球藻试验组,pH值逐步上升,10 d之后稳定在8.7~9.0;隐藻试验组,pH值在2~8 d逐步上升,8 d后又快速下降,试验结束时降低至5.4,水体酸化严重,藻液从深绿色逐渐变为黄绿色,结合隐藻生长曲线,推测隐藻已进入衰亡期,微藻老化导致pH降低[15],结合2.1节温度生长试验,进一步表明隐藻具有生长周期较短的特点。小球藻、隐藻试验组,DO浓度初始值为7.8~7.9 mg/L,2 d时迅速降低至4.6 mg/L和4.4 mg/L,随后又均快速上升;小球藻试验组,DO浓度8 d后稳定在8.2~8.8 mg/L,隐藻组则先快速上升,然后缓慢下降,16 d时降至7.1 mg/L。与pH变化趋势相似,试验初期,菌藻的呼吸作用导致DO下降明显,微藻进入对数增长期后大量释放O2,导致DO升高,但10 d后隐藻生长减缓甚至衰亡,导致隐藻试验组中DO有所降低。

图5 各处理组试验期间pH的变化Fig.5 Variation of pH Value in Each Treatment Group

图6 各处理组试验期间DO的变化Fig.6 Variation of DO in Each Treatment Group
2.2.3 菌藻共生系统中的细菌群落结构变化
菌藻共生系统是一种人工微生态系统,由多个功能性微生物群落组成,这些菌群与菌藻共生系统的性能密切相关。16 d试验前后,小球藻、隐藻试验组中细菌微生物多样性如图7所示,样品Origin、Chlorella、Crypto分别代表试验前细菌原液、试验后小球藻组及试验后隐藻组的水样。结果表明,小球藻、隐藻组试验前后细菌群落结构均发生了显著变化且表现出差异,说明不同微藻对细菌群落结构的形成具有重要影响,这些影响又会反作用于微藻生长,并共同作用于水产养殖废水中营养物质的转化过程。在门水平上,变形菌门(Proteobacteria)在3个样品中的相对比重均为最高,在试验前占72.0%,试验后2个试验组均有提高,小球藻、隐藻组中分别占84.6%和92.0%。厚壁菌门(Firmicutes)试验前占19.3%,试验后小球藻、隐藻组分别降低至2.1%和2.7%。蓝藻门(Cyanobacteria)在试验后2组中明显增加,小球藻和隐藻组中分别占12.5%和5.0%。

图7 试验前(Origin)、试验后小球藻试验组(Chlorella)(a)及隐藻试验组(Crypto)(b)物种聚类柱状图Fig.7 Histogram of Microbial Flora Species Composition Analysis before (Origin) and after Experiment (Chlorella and Crypto) on Phylum Level (a) and Genus Level (b)
在属水平上,丛毛单胞菌属(Comamonas)为试验前的优势菌种(57.4%),试验后小球藻组和隐藻组分别降低至27.0%和19.0%,但仍为优势菌种。试验后,小球藻组中短波单胞菌属(Brevundimonas)(22.7%)、鞘氨醇菌属(Sphingopyxis)(12.5%)明显增加,隐藻组中鞘氨醇单胞菌属(Sphingomonas)(31.9%)、芽孢单菌属(Blastomonas)(13.7%)明显增加。此外,隐藻组中无色杆菌属(Achromobacter)和产碱杆菌科(Alcaligenaceae)也明显增加,分别从0.1%和0.1%提高到2.1%和2.1%。
2.2.4 菌藻共生系统中的氮、磷形态变化及菌藻作用分析
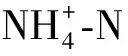

图8 各处理组不同形态氮浓度的变化Fig.8 Changes of Nitrogen Concentration of Different Forms in Each Treatment Group
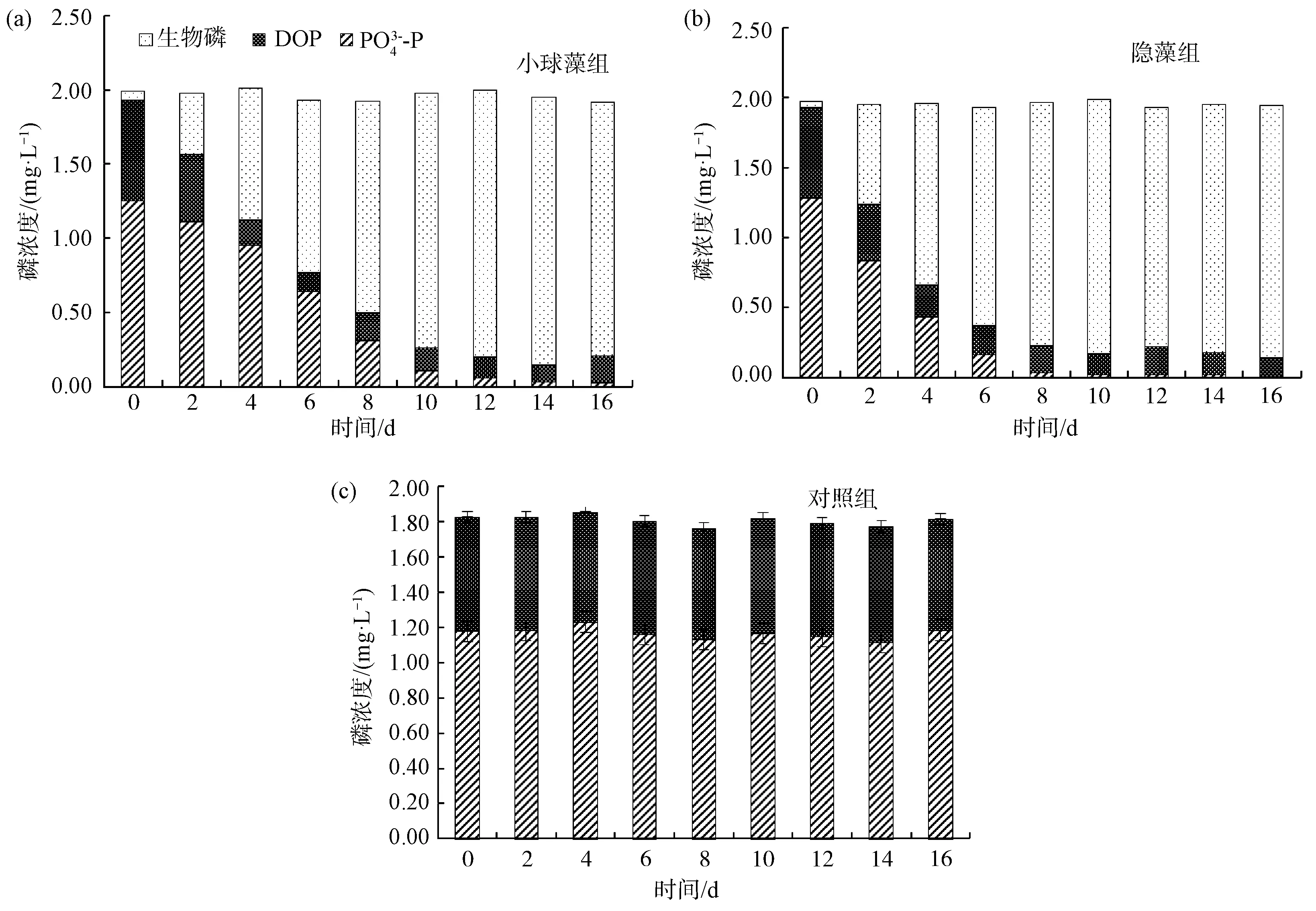
图9 各处理组不同形态磷的变化Fig.9 Changes of Phosphorus Concentration of Different Forms in Each Treatment Group

3 结论
本研究基于针对水产养殖废水处理的“高效菌藻共生单元-水生动物滤食单元-水耕蔬菜滤床单元”三级生物生态耦合处理工艺,对第一级“高效菌藻共生单元”进行研究,结果如下。
(1)综合考虑温度生长和动物滤食因素,冬春低温季节和夏秋高温季节分别适宜选用隐藻和小球藻作为水产养殖废水处理藻种。
(2)以模拟水产养殖废水培养的菌藻共生系统比纯藻系统表现出更高的生物量及氮、磷去除率。不同微藻对细菌群落结构有重要影响。好氧异养菌首先快速生长导致pH、DO短时间大幅降低;亚硝态氮的短暂积累可能归因于AOB和NOB的活性差异以及异养硝化-好氧反硝化细菌的作用。
(3)各组无菌纯藻系统中氮、磷能够达到收支平衡,微藻同化是纯藻系统中DIN、DIP去除的唯一途径;小球藻、隐藻菌藻共生系统中,生物同化是TDN、TDP去除的主要途径,实现了溶解态氮、磷向颗粒态氮、磷的高效转化;但2组菌藻共生系统中均出现了TN损失,推测是好氧反硝化细菌产生含氮气体逸出体系的作用。
