卡拉胶/琼脂/羟丙基-β-环糊精复合凝胶的合成及其载药性能研究*
2020-09-16苏衍华庞丽艳陈章良李兆楼王凤琴
张 波 苏衍华 庞丽艳 陈章良 李兆楼 王凤琴Δ
(1济宁医学院基础医学院,济宁 272067;2济宁医学院药学院,日照 276826 ;3济宁医学院临床医学院,济宁 272013)
凝胶是介于固体和液体之间的一种物质,天然多糖构筑的水凝胶,以非共价键结合,在人体内容易降解和分解,能够吸附、装载、释放药物[1]。凝胶良好的物理性质和生物相容性为其作为缓释、控释制剂载体提供了巨大的应用前景[2-3]。卡拉胶(Kappa-Carrageenan,KC)、琼脂(Agar)和羟丙基-β-环糊精(Hydroxypropyl-β-Cyclodextrin,HP-β-CD)属无毒物质,广泛应用于食品、医药、卫生等领域。目前KC和Agar应用于药物载体的研究较少。KC和Agar能够产生协同增效作用,分子之间能够形成三维网络结构。本实验尝试合成了KC/Agar/HP-β-CD复合凝胶。
甲氨蝶呤(Methotrexate,MTX )又称为氨甲喋呤,是一种叶酸类抗肿瘤药物,广泛应用于儿童白血病及淋巴癌等恶性肿瘤,但是用量达到一定程度时对骨髓、肝细胞有毒副作用[4],因此研发以复合凝胶为辅料的新型甲氨蝶呤药物制剂具有重要的意义。本文对KC/Agar/HP-β-CD复合凝胶作为甲氨蝶呤载体进行了初步研究,探讨了其微结构、包封率及其释放行为。
1 材料与方法
1.1 试剂与仪器
KC(化学纯,安徽酷尔有限公司);Agar(生化试剂,国药集团化学试剂有限公司);HP-β-CD(生化试剂,上海源叶生物科技有限公司);MTX(中国药品生物制品检定所,批号100187-200602);MTX原料药(湖北远成赛创科技有限公司);透析袋(截留分子量1000,北京索莱宝科技有限公司);扫描电子显微镜(FESEM,德国蔡司公司);岛津IRAffinity-1S傅里叶变换红外光谱仪;岛津UV-2450/2550紫外可见分光光度计;SDT-Q600 V8.3 Build 101 (USA)热分析仪;German Bruker/D8ADVANCE X射线衍射仪;智能溶出试验仪(天津大学无线电厂)等。
1.2 凝胶的制备
称取0.2369g KC,0.0789g Agar,0.056g HP-β-CD放入比色管中,然后加蒸馏水6ml,超声1min,于55℃下恒温搅拌30min,继续恒温搅拌直至比色管中凝胶形成,静置得鲜凝胶。对比实验的凝胶,不加HP-β-CD,按上述方法制备。将上述所得的鲜凝胶,置于真空干燥箱(温度40℃)中干燥24h,得到干凝胶。
1.3 凝胶结构观察
用光学显微镜观察所得凝胶样品的结构形貌,并拍照记录典型形貌。将干燥所得的干凝胶进行喷金,并用电子扫描显微镜观察干凝胶的结构和形貌得到电子显微镜图片。
1.4 凝胶的流变学分析
采用Thermo Haake RS300流变仪的堆板系统(直径35mm,间隙0.105mm)测定各凝胶样品的流变学性能。
1.5 红外光谱分析
采用岛津IRAffinity-1S傅里叶变换红外光谱仪,KBr压片法,获得干凝胶红外光谱图。
1.6 X光粉末衍射法(XRD)
将干凝胶样品置于样品池,采用German Bruker/D8ADVANCE X射线衍射仪扫描记录谱图。
1.7 载药凝胶的制备
1.7.1MTX载药凝胶的制备 称取HP-β-CD 0.0957g、MTX 0.0318g(凝胶总质量的5‰),配制HP-β-CD与药物的包合溶液,并避光放置24h。称取0.2369g KC、0.0789g Agar,加上述包合溶液6ml于比色管中,超声1min,在45℃下恒温搅拌30min,继续恒温搅拌直至比色管中凝胶形成,于黑暗阴凉处静置得MTX载药凝胶。对比实验的药物凝胶,不加HP-β-CD,按上述方法制备。
1.7.2标准曲线的建立 精密称取5.0mg MTX标准品溶于0.01mol/L的氢氧化钠溶液,转置于50ml容量瓶中,用0.01mol/L的氢氧化钠溶液定容。分别取上述溶液2.0,4.0,6.0,8.0,10.0ml,置于50ml容量瓶中,用0.01mol/L的氢氧化钠溶液定容,得其浓度分别为4、8、12、16和20μg/ml。以0.01mol/L的氢氧化钠溶液作空白对照,在303nm处测定其吸光度,在测定浓度范围内,MTX溶液的浓度C (μg/ml)与吸光度A之间存在良好的线性关系,其回归方程为:Y=0.05397C-0.00307,R2=0.9999[5]。见图1。
1.7.3包封率测定 取PBS缓冲液75ml于100ml小烧杯中,称取1.0g载药凝胶装入处理过的透析袋中,然后放置于PBS缓冲液中透析24h。采用紫外分光光度计测量最大吸收波长处的吸光度(MTX为303nm),依据标准曲线计算包封率:EE%=(C总-C游离)/C总×100%。
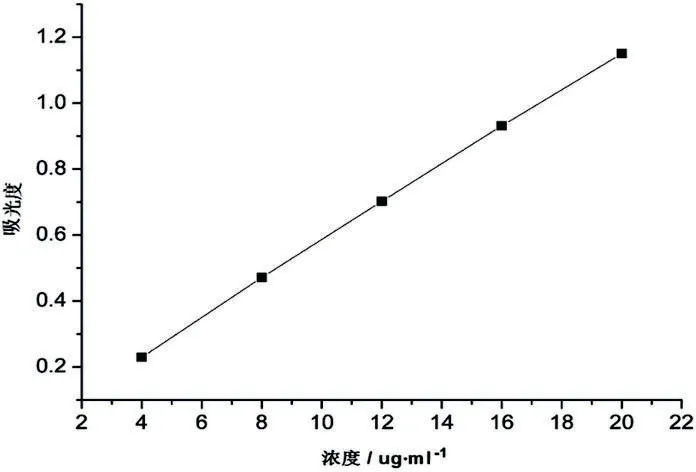
图1 甲氨蝶呤标准曲线图
1.7.4体外释放实验 称取1.0g载药凝胶,放入准备好的透析袋中,然后放入装有模拟人体胃液或模拟人体肠液的智能溶出仪中,设定温度37℃,转速为60r/min,模拟人体内环境进行药物释放实验。24h内每隔一小时取同体积相同温度的模拟液,于紫外可见分光光度计上在303nm测量吸光度,描绘释药曲线。
2 结果与讨论
2.1 溶胶与凝胶相变过程
使用溶胶-凝胶法制备KC/Agar/HP-β-CD复合凝胶,经过了一个相转变过程。该体系的溶胶,在70℃恒温和磁力搅拌条件下,恒温后形成了白色的凝胶。凝胶形成的最低总浓度为2%,凝胶浓度为5%(KC/Agar),添加HP-β-CD后,三者比例为4∶1.5∶1。如果加入MTX(载药量为5‰),在35℃~55℃加热搅拌条件下形成亮黄色的MTX载药凝胶。
2.2 凝胶的微观形貌
通过光学显微镜和电子显微镜可以观察到KC/Agar/HP-β-CD复合凝胶的微观形貌(图2)。在图2的A和B是KC/Agar/HP-β-CD复合凝胶的光学显微镜照片,其中难以观察到复合凝胶的结构,这是由于凝胶饱吸水分子,凝胶表面涨成平面,导致表面平滑。为了进一步探究凝胶的微观形貌,用干凝胶获得了复合凝胶的SEM扫描(图2C和2D)。去除溶剂之后,复配干凝胶样品微结构具有许多孔洞,这些孔洞可以包裹、吸附装载药物分子,实现控制药物的释放[6]。
2.3 凝胶的流变学性质
KC/Agar/HP-β-CD复合凝胶的力学机械性能,可以通过流变测量来描述。复合凝胶样品在流变测量(图3a和3b) 中提供储能模量(G’)和耗能模量(G”)。如图3a在扫描频率测试中,在1Pa的外加应力条件下,样品的G’和G”是保持基本不变的;随着扫描频率越来越大,G’>G”且在整个频率中是基本保持不变的。在振幅扫描测试中,复合凝胶的弹性模量可达104Pa左右,说明这复合凝胶足够强劲、富有弹性。当外加应力在100Pa时复合凝胶体系出现了屈服点(3b),说明该凝胶具有一定的韧性[7-8]。
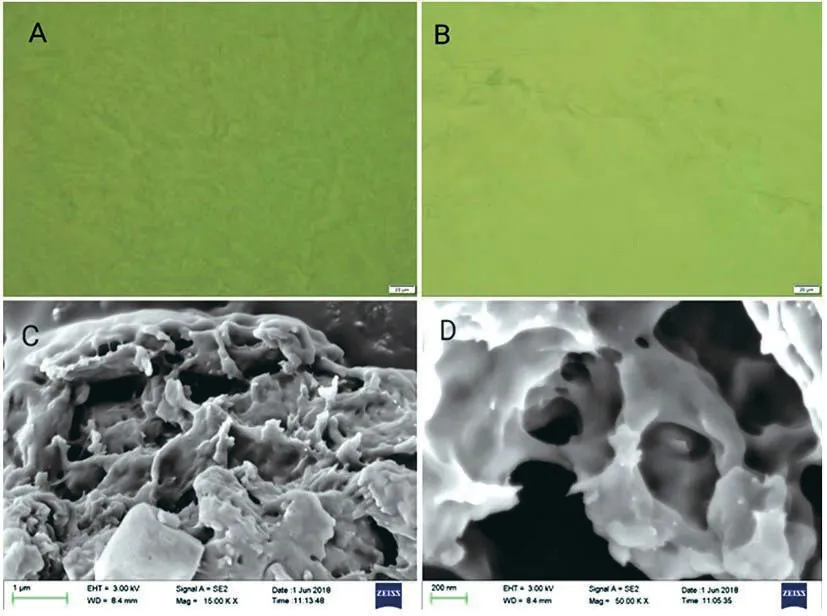
注:A&B.KC/Agar/HP-β-CD鲜凝胶(5wt%)光学显微镜图;C&D.KC/Agar/HP-β-CD干凝胶(5wt%)扫描电镜图
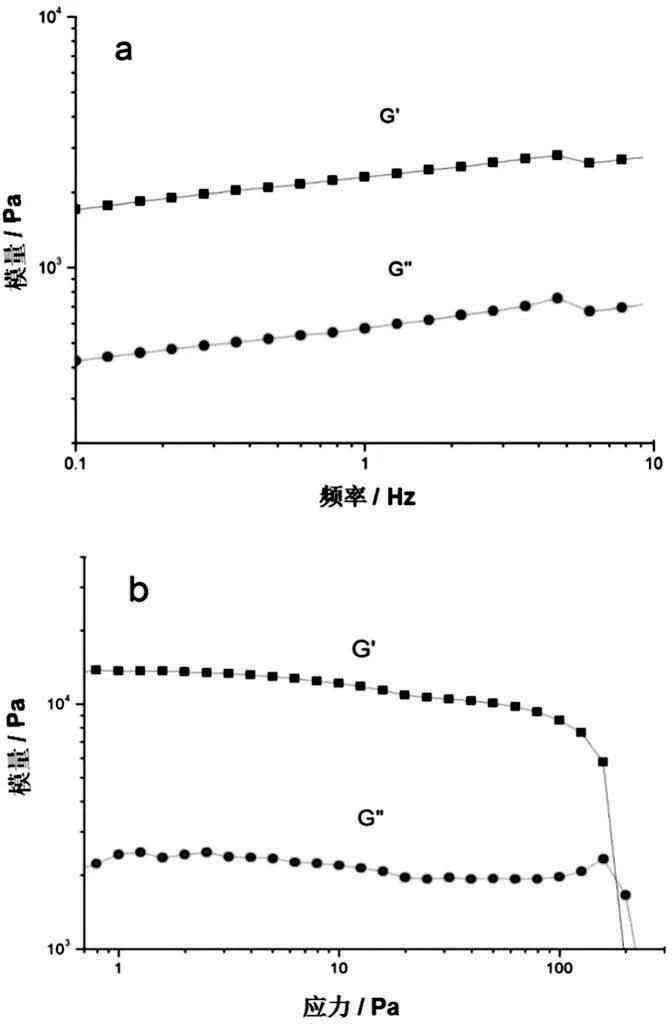
图3 KC/Agar/HP-β-CD复合凝胶的(5wt%)动态流变图
2.4 红外光谱分析及凝胶微结构
复合凝胶的红外光谱反映出凝胶内部分子的官能团之间的相互作用力(图4)。Agar(图4c)和KC(图4b)原料分子分别在3344cm-1和3385cm-1的红外吸收峰被归属为O-H键的伸缩振动[9],而在干凝胶中移至到3415cm-1(图4a)吸收峰。此处发生了蓝移现象,这是因为发生氢键相互作用。图4d所示,吸收峰3394cm-1由原料HP-β-CD的O-H伸缩振动引起的,然而,一旦HP-β-CD组装到复合凝胶中,就会出现峰值移动至3415cm-1(图4a),这是O-H形成氢键造成的结果。纯HP-β-CD的糖环1155cm-1(图4d)的C-O伸缩振动吸收峰,却在干凝胶样品中移动到了1159cm-1(图4a)的吸收位置,这是由C-O耦合拉伸振动引起的。所以,复合凝胶内部的分子之间主要存在着氢键作用力,这也说明了复合凝胶并没有发生化学变化,只是一个物理交联过程。
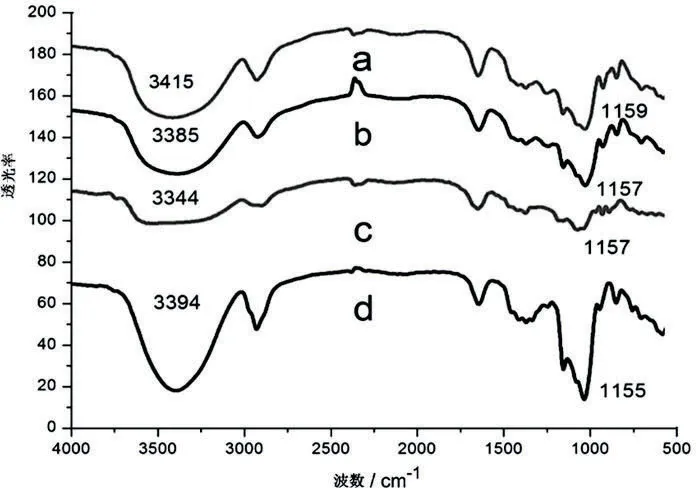
注:a.KC/Agar/HP-β-CD干凝胶(5wt%); b.KC原料;c.Agar原料;d.HP-β-CD
2.5 X射线粉末衍射(XRD)谱图
XRD图谱也可以反映出复合凝胶内部分子的结构信息(图5)。Agar原料(图5c)在2θ=19.8°有一个宽泛的峰值,没有尖锐或者狭窄的峰值,表明它是无定形状态[10]。KC原料(图5d)在2θ=27.9°有一个明显的尖峰,表明有晶体结构的存在,而KC本身是非晶体结构,这是因为KC原料的杂质晶体无机盐如氯化钾造成的[11]。HP-β-CD(图5b)在2θ=18.8°也只有一个宽泛的峰存在,它也是一个非晶形结构。但是,三者合成复合凝胶(图5a)后,也只在2θ=20.05°有一个广泛的峰且尖锐的峰消失(无机盐分解),说明合成的复合凝胶无定形结构,三种原料分子充分结合、相互作用形成了一定结构的复合凝胶体系。
2.6 载药凝胶的包封率
包封率反映凝胶对药物的装载及包裹情况[12]。实验表明,含有羟丙基-β-环糊精的复合凝胶体系包封率达到50.29%;若不加羟丙基-β-环糊精,则凝胶的包封率只是14.9%。这说明加入羟丙基-β-环糊精后,羟丙基-β-环糊精与药物分子之间具有主客体包合作用,对药物的缓控释作用更强,提高了载药凝胶的包封率(表1)。

注:a.KC/Agar/HP-β-CD干凝胶(5wt%);b.HP-β-CD;c.Agar原料;d.KC原料
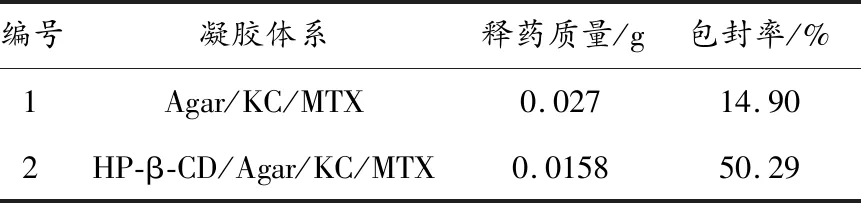
表1 载药凝胶包封率
2.7 载药凝胶的体外释放
2.7.1体外释放实验结果 体外释放实验可反映复合凝胶对药物控制释放的能力。在模拟人体肠液中(图6),不加HP-β-CD的MTX载药凝胶(图6a)在5h之内基本上达到释放溶解平衡,累积释放药物69%;而加入HP-β-CD的MTX载药凝胶(图6b)大约需要10h才达到释放溶解平衡,累积释放药物62%。加入HP-β-CD后,载药凝胶释药率降低约7%,说明在凝胶体系中加入HP-β-CD后,复合凝胶对药物的释放控制得更有效[13]。同样,在模拟人体胃液中(图7),不加HP-β-CD的MTX载药凝胶(图7a)在6h之内基本上达到释放溶解平衡,累积释放药物82%;而加入HP-β-CD的MTX载药凝胶(图7b)大约需要11h才达到释放溶解平衡,累积释放药物73%。加入HP-β-CD后,载药凝胶释药率降低约9%,仍然说明HP-β-CD在凝胶体系中对药物的释放控制更有效果。因此,不论是在模拟人体肠液,还是模拟人体胃液中,KC和Agar等多糖为主的凝胶体系,加入HP-β-CD后显示了主体功能分子的主客体作用,能够更好地控制药物释放效果。
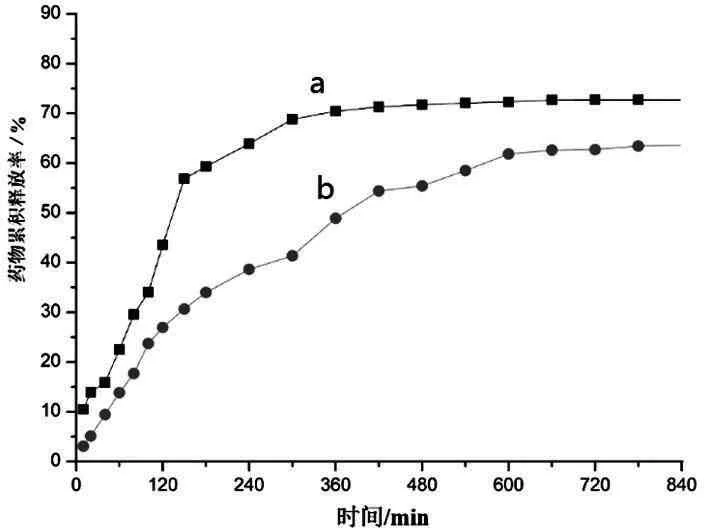
注:a.KC/Agar/MTX凝胶(5wt%);b.HP-β-CD/KC/Agar/MTX凝胶(5wt%)
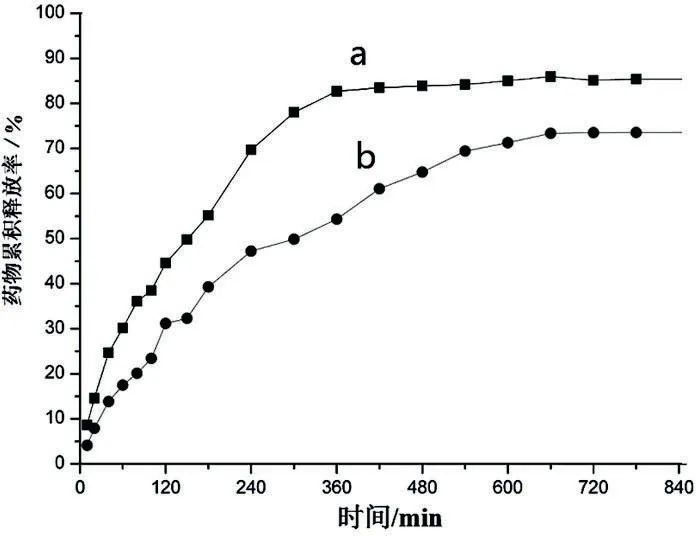
注:a.KC/Agar/MTX凝胶(5wt%); b.HP-β-CD/KC/Agar/MTX凝胶(5wt%)
2.7.2复合凝胶微结构 依据上述数据,对KC/Agar/HP-β-CD复合凝胶结构进行推断,k-KC为粗分子绳和细分子绳的混合(粗分子绳为大量的螺旋结构混合在一起,细绳为未螺旋排布的分子链),可知KC主要是以螺旋形式存在。Agar和KC都是由半乳糖的衍生物构成的长链多糖,不同的是,在Agar中D-半乳糖(1→3)和L-半乳糖衍生物(1→4)相交替,而KC都是D-型的半乳糖或其衍生物的交替共聚物[14]。两者的分子结构一个是左旋的,一个是右旋的。当Agar和KC结合时,两者分别形成链网络,两个链网络相互贯穿,且存在一些物理接触点[15]。包裹药物的HP-β-CD分子分散在凝胶网络体系中,对网络结构起稳定作用,加强了网络空间结构中氢键的形成,有利于凝胶的形成,少量的HP-β-CD可嵌入凝胶骨架之中,稳定结构[16-17]。
药物能够均匀分布于凝胶基质中,释药速率由药物通过高分子基质的扩散来控制。MTX一部分直接分布在凝胶基质中,另一部分以HP-β-CD包合物被分布在凝胶基质中。药物的释药量随药物扩散到凝胶表面距离的增加而下降[18],随时间的增加而减少。凝胶内部药物首先扩散到凝胶表面,然后才能顺利被释放。
3 结论
采用溶胶-凝胶法合成了KC/Agar/HP-β-CD复合凝胶。该复合凝胶是一种良好的药物载体,所载抗癌药甲氨蝶呤与HP-β-CD形成了稳定的包合物,包载于复合凝胶体系中,使得甲氨蝶呤具有较为缓慢的释放速率,可以明显延长药物的作用时间[19]。
