倒春寒胁迫与恢复对茅苍术生长、生理及关键酶基因的影响
2020-09-15巢建国盛业龙王玉卓惠西珂王圆圆
夏 蕴 巢建国* 谷 巍 盛业龙 王玉卓 惠西珂 王 凯 王圆圆
(1.南京中医药大学, 江苏南京210023; 2.常州市孟河双峰中草药科技有限公司, 江苏常州213000)
温度作为环境因素之一,为影响植物抗寒冻性的重要因子[1]。当植物面临低温时,会通过一系列响应表现以减少低温带来的损伤。研究低温对黄瓜[2]、薏苡[3]、红芸豆[4]等的影响,发现低温会抑制植物、作物株高、茎粗等生长指标的增加,造成生长减缓。研究[5⁃7]表明,低温下植物可溶性蛋白含有量增加,抗氧化酶活性提高,以增强抵御低温的能力,同时,低温也会造成植物叶绿素含有量下降,丙二醛含有量增加。另外,温度的改变会使植物基因表达等信号转导产生变化,低温下平欧杂交榛叶片ChaCBF1 表达量就随时间延长而升高[8]。可见,植物应对低温产生的一系列变化与其抗寒抗冷能力息息相关。
苍术Atractylodes Lancea(Thunb.) DC.作为常用中药,在临床和药用价值上起到了相当重要的作用。茅山为其道地产区,近年来,低温寒流天气频频发生,对植物生长发育和产量形成造成了一定影响。而有关茅苍术应对低温等不良环境的研究报道较少,因此,本实验通过模拟倒春寒期间低温胁迫来探究茅苍术对低温的感应变化、基因表达变化,以期为茅苍术抗冷性种植提供参考。
1 材料与方法
1.1 实验材料与设计
1.1.1 试验地信息 试验地位于江苏省常州市新北区双峰中草药基地内,地理位置为北纬32°01′28.97″,东经119°47′56.60″。本实验于2018 年12 月28 日将收集的茅苍术种苗(产自江苏茅山地区),经须根修剪、多菌灵浸泡等处理后进行种植,经南京中医药大学中药资源与开发教研室巢建国教授鉴定为菊科植物苍术Atractylodes lancea(Thunb.) DC.的根茎。
1.1.2 实验设计 待出苗后且长出5 至7 片叶片时,利用人工培养箱分别对茅苍术幼苗进行倒春寒温度 (10、15 ℃) 模拟,并模拟较适宜生长温度(25 ℃) 作为对照组,每组8 盆,一盆3 株,期间给予正常水分,光照强度均为3 000 lux,光照和黑暗时间均为12 h,实验前均在自然条件环境下生长,待胁迫结束恢复自然生长。胁迫期间观察各温度组种苗生长情况,记录,进行外观表征测定,并测定胁迫前后与恢复期如株高、茎粗、叶绿素、丙二醛等一系列生理指标,进行分析。
1.2 指标测定与方法
1.2.1 倒春寒模拟胁迫期间茅苍术幼苗植株冷害指数统计方法 观察并统计胁迫前后茅苍术幼苗的外观形态特征,计算各组冷害指数。冷害指数分级如下: 0 级为叶片无枯萎,呈现略微皱缩状态;1 级为1~2 片叶片发黄,呈现轻微萎焉状态;2 级为3~4 片叶片发黄,呈现轻、中度萎焉状态;3 级为4 片以上叶片发黄,呈现中度萎焉状态;4 级为叶片出现干枯、倒伏现象,卷曲严重,呈现重度萎焉状态。参照Semeniuk[9]、李小玲等[10]研究方法,按公式冷害指数= (∑冷害级数×相应株数) / (最高级数×总株数)进行计算,∑冷害级数×相应株数为各组对应冷害级别株数之和。
1.2.2 倒春寒模拟胁迫期间茅苍术幼苗生长指标测定方法 测定胁迫前后茅苍术幼苗的生长指标,具体为株高(cm) 用直尺测定,茎粗(mm) 用游标卡尺测定。
1.2.3 倒春寒模拟胁迫期间茅苍术幼苗生理指标测定方法 选取各组大小、长势相近的植株叶片,混匀,去除叶脉,剪碎,每组3 个重复,进行以下生理指标测定: 过氧化物酶(POD) 和还原型谷胱甘肽(GSH) 含有量均采用试剂盒(北京索来宝生物科技有限公司) 进行测定,叶绿素含有量测定用乙醇法,可溶性蛋白含有量测定用考马斯亮蓝法 (其回归方程为Y=0.000 7X+0.705),丙二醛(MDA) 含有量测定用硫代巴比妥酸法。
1.2.4 倒春寒模拟胁迫期间茅苍术幼苗叶片关键酶基因测定方法 分别于胁迫期间的第5、15 天时采集茅苍术幼苗叶片,用液氮处理后存放在-80 ℃冰箱中,采用RNA 提取试剂盒[天根生化科技(北京) 有限公司] 说明书方法提取低温胁迫期间茅苍术叶片的RNA,反转录为cDNA,最后进行PCR 荧光定量测定,反应程序为94 ℃预变性5 min,94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸40 s,45个循环。根据课题组前期实验筛选出的内参基因,利用2-ΔΔCt法(以25 ℃组为参照) 进行计算,对比不同低温对其关键酶基因表达量差异,从而进行分析。qRT⁃PCR 引物序列见表1。

表1 qRT⁃PCR 引物序列
1.3 数据处理与分析 生长指标和生理生化指标均利用SPSS 22.0 进行单因素差异分析,并应用GraphPad Prism 5软件进行图表绘制。
2 结果与分析
2.1 倒春寒模拟胁迫期间茅苍术幼苗植株情况 实验前茅苍术幼苗叶片均呈完全舒展状态,处于正常生长期。图1显示,经低温胁迫后,茅苍术叶片均出现不同程度脱水、变软、卷曲、皱缩和萎焉等现象,且15 ℃组叶片黄化现象比10 ℃组严重。据统计,至10 ℃组倒春寒模拟胁迫结束时,有50%幼苗叶片无枯萎现象,仅有略微皱缩,有25%幼苗叶片表现出轻中度萎焉,仅有12.5%幼苗叶片出现轻微萎焉和重度萎焉表现,其冷害指数为0.281。至15 ℃组倒春寒模拟胁迫结束时,12.5% 植株有轻微黄叶,但无明显枯萎情况,25%植株出现个别黄叶,呈现轻微、中度萎焉状态,仅有12.5%植株出现叶片皱缩、卷曲严重,呈重度萎焉状态,还伴有倒伏现象,其冷害指数为0.438。

图1 倒春寒低温胁迫对茅苍术外观形态的影响
2.2 倒春寒模拟胁迫前后茅苍术幼苗生长情况 图2 显示,通过对比倒春寒模拟胁迫前后的茅苍术生长速率表现,发现各组株高、茎粗生长速率有所差异。15 ℃组茅苍术株高、茎粗生长速率和25 ℃组无明显差异,而10 ℃组茅苍术株高、茎粗生长速率明显下降,且与15、25 ℃组均呈显著性差异。表明15 ℃处理下茅苍术仍能维持正常生长,而10 ℃处理下茅苍术株高、茎粗生长受到一定抑制,生长减缓。
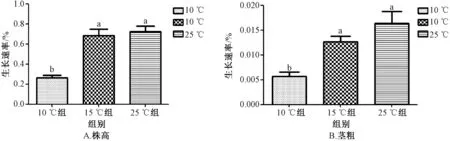
图2 倒春寒低温胁迫对茅苍术株高、茎粗的影响
2.3 生理生化指标测定
2.3.1 叶绿素总量测定 图3 显示,无论是倒春寒胁迫后期还是恢复期阶段,10 ℃组和25 ℃组叶绿素含有量均呈不断增加趋势,而15 ℃组则呈先上升后下降趋势。经胁迫后,15 ℃组增加明显,与25 ℃组比较增加了5.740%,但无显著性差异;与10 ℃组比较增加了16.216%,有显著性差异。而后恢复正常生长发现,10 ℃组和15 ℃组同期叶绿素含有量均低于25 ℃组,比较25 ℃组,10 ℃组降低了13.012%,15 ℃组降低了14.760%,且2 组均与其呈显著性差异。
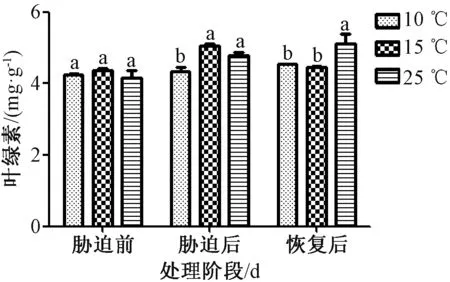
图3 倒春寒低温胁迫对茅苍术叶绿素总量的影响
2.3.2 丙二醛含有量测定 图4 显示,三组丙二醛含有量变化趋势各不相同。10 ℃组呈持续上升情况,15 ℃组表现为先上升后下降趋势,25 ℃组则为先降后升情况。经低温胁迫后,发现15 ℃组丙二醛含有量大大增加,同期约为25 ℃组的4 倍多,且与25 ℃组有显著性差异,而10 ℃组丙二醛含有量虽然也有所上升,但与25 ℃组不呈显著性差异。经过恢复后,发现10 ℃组和25 ℃组丙二醛含有量仍有增加,而15 ℃组丙二醛含有量有所回落,但15 ℃组仍高于10、25 ℃组,同比为10 ℃组的40.759%,同比为25 ℃组的28.919%,且与其他2 组均呈显著性差异。

图4 倒春寒低温胁迫对茅苍术丙二醛含有量的影响
2.3.3 过氧化物酶(POD) 活性测定 图5 显示,25 ℃组POD 活性为先降后升趋势,而10、15 ℃组均为先上升后下降趋势。经胁迫后发现,10 ℃组与25、10 ℃组与15 ℃组均呈显著性差异,与25 ℃组比较,10 ℃组同期增加了43.678%,与15 ℃组比较,10 ℃组同期降低24.902%;同时,15 ℃组与25 ℃组呈极显著性差异,与其比较,同期增加了79.456%。经恢复后可见,15 ℃组POD 含有量虽然有所下降,但仍与10 ℃组呈显著性差异,与25 ℃组呈极显著性差异。

图5 倒春寒低温胁迫对茅苍术POD 活性的影响
2.3.4 还原型谷胱甘肽(GSH) 含有量测定 图6 显示,10、15 ℃组GSH 含有量始终呈上升趋势,而25 ℃组呈先下降后上升趋势。经胁迫后发现,10 ℃组与25 ℃组呈显著性差异,与25 ℃组比较,10 ℃组同期增加了61.750%,15 ℃组与25 ℃组呈极显著性差异,与其比较,同期增加了244.057%。经恢复后可见,15 ℃组仍然呈增加走势,并与10 ℃组呈显著性差异,与25 ℃组呈极显著性差异。

图6 倒春寒低温胁迫对茅苍术GSH 含有量的影响
2.3.5 可溶性蛋白质含有量测定 图7 显示,10、25 ℃组可溶性蛋白质含有量均为先降低后上升趋势,而15 ℃组则是先增加后下降情况。经胁迫后发现,15 ℃组可溶性蛋白质含有量大幅增加,且与10、25 ℃组均有显著性差异,同比10 ℃组增加了111.581%,同比25 ℃组增加了85.661%。而后经过短暂恢复后可见,10 ℃组和25 ℃组可溶性蛋白质含有量都有所上升,15 ℃组则有所降低,此时15 ℃组和25 ℃组差异不明显,但其与10 ℃组有显著性差异。

图7 倒春寒低温胁迫对茅苍术可溶性蛋白质含有量的影响
2.4 倒春寒低温胁迫对茅苍术叶片关键酶基因表达量的影响 图8A 显示,经胁迫5 d 后,25 ℃组法尼基焦磷酸合酶(FPPS) 基因表达量大幅上调,而10 ℃组和15 ℃组FPPS基因表达量均有所下降。表明低温会使茅苍术叶片FPPS基因表达受到抑制。而后经15 d 胁迫后,25 ℃组FPPS基因表达量变幅不大,15 ℃组FPPS基因表达量仍呈持续下降趋势,10 ℃组则有所回升。图8B 显示,经5 d 胁迫后,3组3⁃羟基⁃3⁃甲基戊二酸单酰辅酶A 还原酶(HMGR) 基因表达量均为上升情况,其中10 ℃组增幅明显,表明低温使茅苍术叶片HMGR基因表达上调,而后经15 d 胁迫后,与25 ℃组比较,10、15 ℃组HMGR基因表达量均有所下降,表明HMGR基因与胁迫时间有紧密联系。

图8 倒春寒低温胁迫对茅苍术叶片关键酶基因表达量的影响
3 讨论
本实验中,与25 ℃组比较,15 ℃组茅苍术幼苗初期受冷影响表现不明显,只有少数植株有轻微冷害和重度冷害表现。而10 ℃组幼苗受冷害影响较明显,表明温度越低,受冷害程度越明显。结果表明温度越低,茅苍术萎焉、发黄越严重[11⁃12]。可见,叶片受冷程度表现可作为评判植物冷害程度最直观的依据。植物的生长情况一定程度上可反映其对周遭环境的适应性,以及自身抗性的强弱程度。本实验中,10 ℃、15 ℃组茅苍术幼苗相对25 ℃组而言,株高、茎粗生长速率均有所下降,且温度越低,其生长速率受抑制越显著,表明低温确实会使植物生长受到一定抑制[13⁃14]。但目前低温对药用植物生长的影响研究和报道甚少,其结论和作用机理还需进一步研究、考证。
温度为影响植物体内光合色素变化的主要因素之一,当植物遇到逆境时,其叶绿素含有量会作出相应变化[15⁃16]。本实验中,经低温胁迫后,15 ℃组叶绿素含有量高于25 ℃组,而10 ℃组则低于25 ℃组,可能与低温下植物体内叶绿素合成受阻有关,推测在15 ℃处理下,茅苍术体内叶绿素合成还未达到抑制温度[17⁃18],但与欧俊梅等[19]研究结果是相反的,表明不同植物应对低温时,其叶绿素总量响应变化各异。
丙二醛是评价植物应对逆境时的受损程度和体现自身抗性的主要指标[20]。本实验中,当遭受低温胁迫后,2 低温组丙二醛含有量相较25 ℃组均有所增加,并随温度下降而降低。表明低温对茅苍术幼苗造成了一定伤害,同时,丙二醛含有量随温度降低而下降,可能与植株的承受范围有关,也可能与细胞膜内代谢体系暂时性失衡有关[21⁃23]。经恢复后,各组丙二醛含有量有所降低,但15 ℃组仍处于较高水平,表明温度越高,对茅苍术伤害越大,但其可通过自身调节以恢复至正常水平。
低温下,植物会产生一系列活性氧等有害物质,此时,通过调节体内抗氧化酶活性来减少氧化损伤[24]。本实验中,当茅苍术感受低温时,其POD 活性和GSH 含有量均有所上升,表明茅苍术对低温有一定的耐受力和抗性,POD和GSH 两者在抵御低温时起到了重要作用[25]。同时,较25 ℃组而言,温度越低,其POD 活性和GSH 含有量增幅也随之减少,表明随着温度的降低,其酶活力会逐渐受到抑制,在一定程度上可通过调节酶活性来增强其抗性[26]。
可溶性蛋白质为维持植物渗透平衡的重要调节物质之一,其具有一定保水能力。本实验中,不管是低温胁迫后还是经恢复生长后,与25 ℃组比较,15 ℃组可溶性蛋白质含有量大大增加,而10 ℃组则有所下降,表明温度与可溶性蛋白质含有量呈正相关,表明茅苍术可承受10 ℃以上温度,随着温度的降低,其保水能力也逐渐减弱。在一定范围内,可溶性蛋白质含有量的升高,推测与新蛋白质或抗冷性蛋白质合成有关[27⁃28]。也有研究[29]表明可溶性蛋白质也可反映植株抗性的强弱,关于其对低温的响应变化机制仍需深入研究。
据悉,FPPS 和HMGR 是三萜类成分合成的限速酶[30]。本实验中,低温胁迫初期时,茅苍术叶片中FPPS 表达量均有所下调,且温度越低,下调越明显,表明茅苍术叶片FPPS 表达量受抑制程度与温度有紧密联系[31]。随着低温的延长,10 ℃组FPPS 表达量又有所回升,推测与胁迫程度不断加重有关,具体原因有待探究。本实验中,茅苍术叶片HMGR 表达量经低温胁迫均为先升后降趋势,且温度越低,表现越明显,在一定范围内,茅苍术叶片HMGR 表达量受低温影响而上调,随后下降,可能与其胁迫程度和抗冷能力有关[32]。
总体而言,低温下茅苍术出现萎焉、变薄等现象且生长迟缓,叶片黄化,低温对其造成一定伤害。但茅苍术仍可通过提高酶活系统,调节可溶性蛋白质含有量,协调FPPS、HMGR基因共同作用来抵御低温,具有一定耐冷性。
