四君子颗粒含药血清对棕榈酸诱导的MIN6 细胞凋亡的影响
2020-09-15唐保露郑宇辰张叶明戚小宇杨解人郑书国
唐保露 郑宇辰 张叶明 袁 萍 戚小宇 张 旭 杨解人 郑书国
(1.皖南医学院药理学教研室, 安徽芜湖241002; 2.皖南医学院临床医学院, 安徽芜湖241002;3.皖南医学院药学院, 安徽芜湖241002; 4.皖南医学院定量药理研究所, 安徽芜湖241002)
2 型糖尿病是一种以胰岛素抵抗、高血糖和胰岛β 细胞功能障碍为特征的代谢性疾病,其病因复杂,其中肥胖是最主要危险因素之一[1]。大多数肥胖人群血浆游离脂肪酸水平明显升高,高水平脂肪酸对胰岛β 细胞可产生明显毒性作用,并可诱导机体发生胰岛素抵抗[2]。短期暴露于高浓度游离脂肪酸,可使胰岛素分泌代偿性增加,而时间过长则导致胰岛β 细胞功能损伤,甚至发生凋亡[3]。胰岛β 细胞数量减少及功能损伤是发生糖尿病的主要机制之一[4]。因此抑制游离脂肪酸诱导的胰岛功能损伤和β 细胞凋亡是防治2 型糖尿病的重要措施之一。
糖尿病属于中医“消渴” 范畴,其发生发展与脾胃关系密切,其中脾气亏虚是糖尿病发病的重要病机,“脾虚致消” “健脾愈消” 已成为中医治疗糖尿病的重要理论依据之一,临床以益气健脾方治疗2 型糖尿病也取得较好疗效[5⁃6]。四君子汤是益气健脾的经典方剂,由党参、白术、茯苓和甘草组成,临床用于治疗糖尿病取得了良好的效果[7],但对其改善2 型糖尿病的确切机制,目前仍不清楚。前期研究[8]发现,四君子颗粒可明显改善高糖高脂饮食诱导的大鼠糖尿病前期状态,减少胰岛细胞凋亡。本研究采用体外培养的小鼠胰岛β 细胞株(MIN6 细胞),应用血清药理学方法观察四君子汤对棕榈酸诱导的MIN6 细胞损伤和凋亡的影响,并从内质网应激角度探究其可能机制。
1 材料
1.1 动物 30 只SD 大鼠购于浙江省实验动物中心,生产许可证号SCXK (浙) 2014⁃0001。
1.2 药物与试剂 四君子颗粒(李时珍医药集团有限公司,批号20180516);MIN6 细胞株(上海博古生物科技有限公司);DMEM 培养基(批号AD12854263)、胎牛血清(批号MKF0602) 购自美国 HyClone 公 司;棕 榈 酸 钠 (批 号SLBQ0242V)、β⁃巯基乙醇(批号STBJ3747) 购自美国Sigma 公司;细胞凋亡检测试剂盒 (货号BB18061)、细胞增殖与细胞毒性检测试剂盒(货号BB18061X) 购自上海贝博生物科技有限公司;葡 萄 糖 调 节 蛋 白⁃78 (GRP78,批 号120617180313)、ATF4 抗体(批号011018180606)购自碧云天生物技术有限公司;PERK (批号66r8853)、p⁃PERK 抗体(批号86w3361) 购自美国Affinity Biosciences 公司;CHOP 抗体 (批号57c6807) 购自美国Cell Signaling Technology 公司;β⁃actin 抗体(批号20180926) 购自博士德生物工程有限公司;ECL 发光试剂盒(批号20180822)购自上海天能科技有限公司。
1.3 仪器 二氧化碳细胞培养箱(美国SIM 公司);超净工作台(苏州安泰空气技术有限公司);高速冷冻离心机(德国Eppendorf 公司);DYY⁃6C型电泳仪(北京六一仪器厂);Mini PROTEAN 转膜仪(美国Bio⁃Rad 公司);Fluor chem FC3 化学发光凝胶成像系统(美国Protein Simple 公司);Infinite 200 PRO 酶标仪(瑞士Tecan 公司);手持式细胞计数仪(美国Millipore 公司);流式细胞仪(美国BD 公司)。
2 方法
2.1 含药血清制备 30 只SD 大鼠随机分为正常对照组及四君子颗粒高、低剂量组 (10.5、5.25 g/kg),每组10 只,除正常对照组,其余2组分别灌胃给予高、低剂量四君子颗粒(10.5、5.25 g/kg),连续给药7 d。末次给药2 h 后,戊巴比妥钠麻醉,腹主动脉取血,无菌条件下分离血清,56 ℃水浴灭活30 min,-80 ℃冰箱保存备用。
2.2 MIN6 细胞培养 将MIN6 细胞培养于含10%胎牛血清的DMEM 培养液中(含50 μmol/L β⁃巯基乙醇),置于37 ℃、5% CO2、饱和湿度培养箱中,待细胞生长至近融合时,用0.25% 胰酶消化后传代培养。
2.3 MIN6 细胞活力检测 将MIN6 细胞用0.25%胰酶消化后,制备单细胞悬液,以2×104/孔接种于96 孔培养板,24 h 后弃培养液,PBS 洗涤后加入新的培养液,细胞随机分为对照组、模型组、空白血清组及四君子颗粒高、低剂量组。四君子颗粒高、低剂量组分别加入相应的含药血清,空白血清组加入空白对照组血清,使血清终浓度为10%,孵育 24 h;除对照组外,其余各组更换含0.4 mmol/L的棕榈酸培养基,孵育24 h,CCK⁃8 法检测细胞活性。
2.4 MIN6 细胞凋亡检测 取生长状态良好的MIN6 细胞,0.25% 胰酶消化后制备单细胞悬液,接种于6 孔培养板,24 h 后更换新鲜培养液。按“2.3” 项下分组及药物处理。弃培养液,PBS 洗涤后0.25%胰酶消化收集细胞,预冷PBS 洗涤2次。用400 μL Annexin V 结合液悬浮细胞,在细胞悬液中加入5 μL Annexin V⁃FITC 染色液,轻轻混匀后于4 ℃避光孵育15 min,然后加入10 μL PI染色液轻轻混匀,4 ℃避光孵育5 min,流式细胞仪检测细胞凋亡水平(激发波长488 nm,发射波长525 nm)。
2.5 Western blot 法检测蛋白表达 细胞接种于6孔培养板,按“2.3” 项下分组及药物处理。弃培养液,PBS 洗涤2 次,加入0.25%胰酶消化收集细胞,PIPA 裂解液(含磷酸酶和蛋白酶抑制剂) 冰浴裂解细胞。12 000g离心15 min,收集上清液,BCA 法测定蛋白浓度,聚丙烯酰胺凝胶电泳分离蛋白并转移至PVDF 膜,5%脱脂牛奶封闭2 h。分别加入β⁃actin、GRP78、ATF4、CHOP、p⁃PERK、PERK 抗体,4 ℃孵育过夜,TBST 洗涤后加入辣根过氧化物酶标记的二抗,室温孵育2 h,滴加ECL发光液显色,凝胶图像分析系统拍照并分析条带光密度,结果以 GPR78/β⁃actin、ATF4/β⁃actin、CHOP/β⁃actin、P⁃PERK/PERK 表示。
2.6 统计学分析 采用DAS1.0 统计软件进行分析,数据以() 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 法,以P<0.05为差异有统计学意义。
3 结果
3.1 四君子颗粒对MIN6 细胞活力的影响 由图1可见,0.4 mmol/L 棕榈酸孵育MIN6 细胞24 h 后可以诱导MIN 6 细胞损伤(P<0.01);四君子颗粒含药血清预孵24 h 可减轻棕榈酸诱导的细胞损伤(P<0.05,P<0.01);与模型组比较,空白血清组MIN 6 细胞活力差异无统计学意义。提示四君子颗粒可有效改善棕榈酸诱导的细胞损伤。

图1 四君子颗粒对棕榈酸诱导的MIN6 细胞损伤的影响(, n=6)Fig.1 Effects of SGs on the viability of palmitic acid⁃induced MIN6 cells (, n=6)
3.2 四君子颗粒对MIN6 细胞凋亡的影响 正常培养条件下,MIN6 细胞凋亡率很低,0.4 mmol/L棕榈酸诱导24 h 后,MIN6 细胞凋亡率升高(P<0.01),表现为凋亡早期和凋亡晚期的细胞均增加;四君子颗粒含药血清预孵24 h 可降低棕榈酸诱导的MIN6 细胞凋亡(P<0.01),而空白对照血清对棕榈酸诱导的细胞凋亡无明显影响,见图2。提示四君子颗粒可有效抑棕榈酸诱导的MIN6 细胞凋亡。
3.3 四君子颗粒对MIN6 细胞GRP78、ATF4、CHOP、p⁃PERK 表达的影响 由图3 可知,正常培养条件下,MIN6 细胞GRP78、ATF4 及CHOP蛋白表达较低,PERK 蛋白磷酸化也较低;0.4 mmol/L 棕榈酸诱导24 h 后,MIN6 细胞GRP78、ATF4、CHOP、p⁃PERK 蛋白表达升高(P<0.01);四君子颗粒含药血清预孵24 h 可降低细胞内GRP78、ATF4、CHOP、p⁃PERK 蛋白表达(P<0.05,P<0.01),而空白对照血清对GRP78、ATF4、CHOP 及p⁃PERK 蛋白表达均无明显影响,提示四君子颗粒含药血清可明显减轻棕榈酸诱导的MIN6 细胞内质网应激,这一作用与其抑制细胞凋亡作用一致,四君子颗粒抑制棕榈酸诱导的MIN6细胞凋亡与抑制内质网应激PERK⁃ ATF4⁃CHOP 信号通路有关。
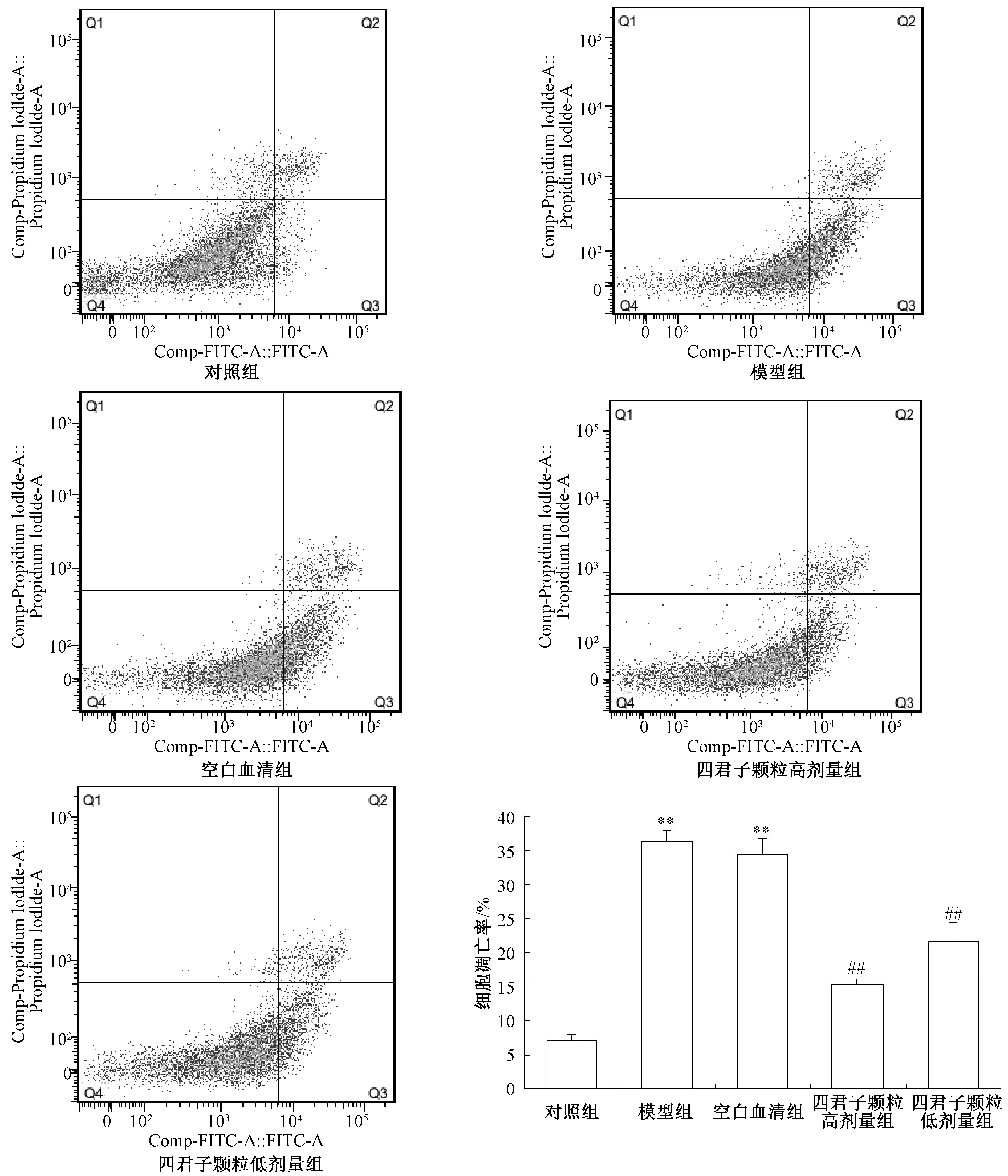
图2 四君子颗粒对棕榈酸诱导的MIN6 细胞凋亡的影响(, n=4)Fig.2 Effects of SGs on the apoptosis of palmitic acid⁃induced MIN6 cells (, n=4)
4 讨论
流行病学资料显示,肥胖是2 型糖尿病最主要危险因素之一,糖尿病患者除表现为高血糖外,还普遍存在脂代谢紊乱,表现为血浆三酰甘油(TG)、极低密度脂蛋白(VLDL) 和游离脂肪酸等水平显著升高[9]。大量研究显示,高水平游离脂肪酸一方面可干扰胰岛素信号转导,引起胰岛素抵抗,另一方面可诱导胰岛β 细胞凋亡,导致胰岛功能受损,诱发2 型糖尿病。因此,抑制高浓度游离脂肪酸诱导的胰岛β 细胞损伤和胰岛素抵抗是防治肥胖相关2 型糖尿病的有效途径之一。本研究采用血清药理学方法,观察四君子颗粒对MIN6 小鼠胰岛 β 细胞的保护作用。结果显示,0.4 mmol/L 棕榈酸孵育24 h 后,MIN6 细胞活力明显受损,细胞凋亡明显升高,这一结果与文献报道一致[10]。四君子颗粒含药血清预孵24 h,棕榈酸诱导的MIN6 细胞损伤减轻,细胞凋亡也显著下降,而空白对照血清对棕榈酸诱导的细胞损伤和凋亡无明显影响,提示四君子颗粒含药血清可有效改善棕榈酸诱导的MIN6 细胞损伤和凋亡。
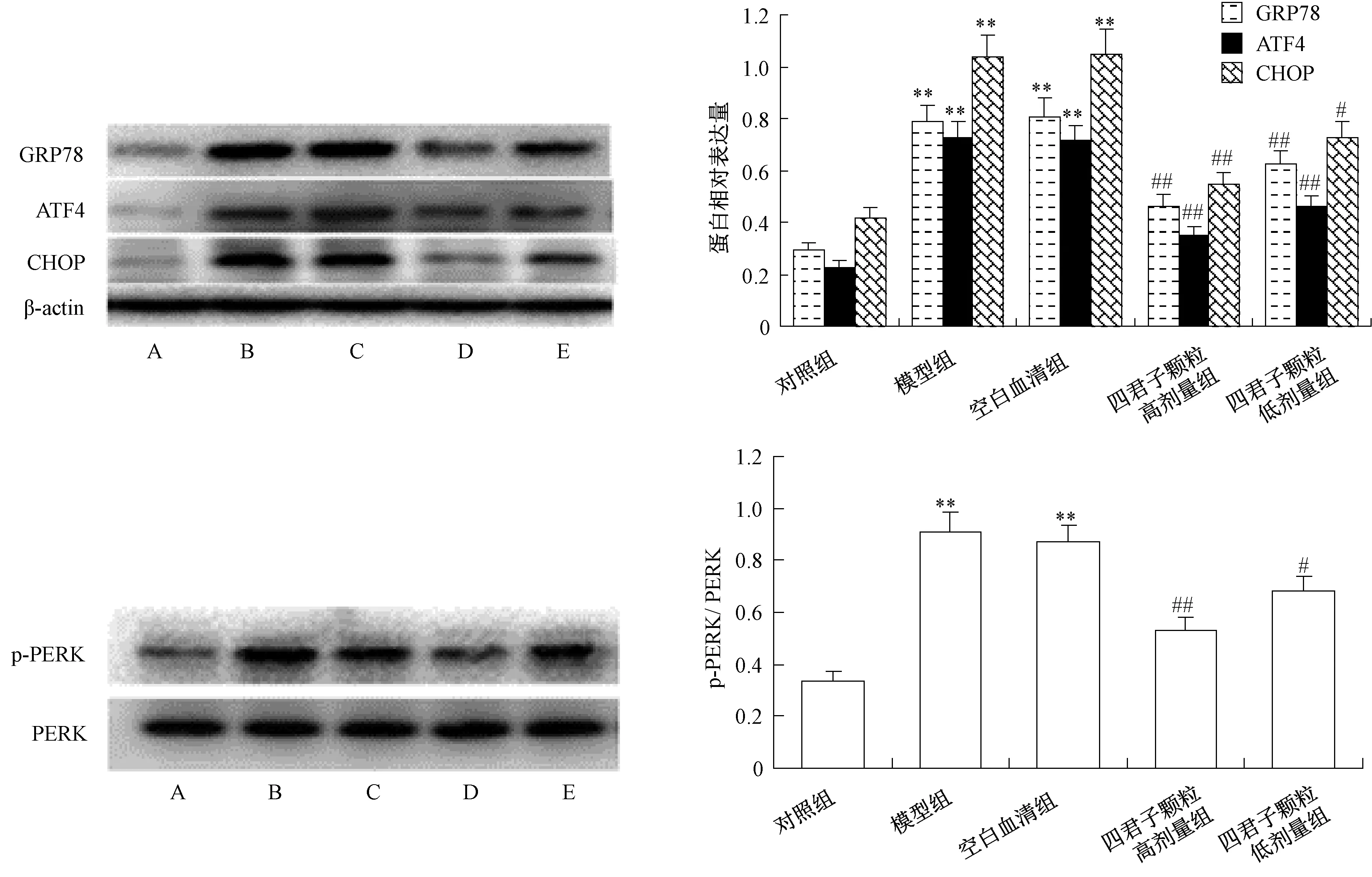
图3 四君子颗粒对棕榈酸诱导的MIN6 细胞GRP78、ATF4、CHOP、p⁃PERK 表达的影响(, n=4)Fig.3 Effects of SGs on GRP78,ATF4,CHOP and p⁃PERK expression of palmitic acid⁃induced MIN6 cells (,n=4)
游离脂肪酸可刺激胰岛β 细胞合成与分泌胰岛素,而长期暴露于高浓度游离脂肪酸则会加重β细胞胰岛素分泌负荷[11]。当胰岛素合成大量增加时,作为细胞内蛋白质合成与翻译后加工重要场所的内质网负担加重,大量未折叠或错误折叠蛋白在内质网腔内积聚,诱发内质网应激(endoplasmic reticulum stress,ERS)[12]。一旦发生内质网应激,细胞首先启动未折叠蛋白反应(unfolded protein re⁃sponse,UPR) 以缓解内质网应激,恢复内质网稳态。GRP78 合成增加是UPR 标志性事件之一[13]。本研究结果显示,暴露于棕榈酸24 h 后,MIN6 细胞GRP78 蛋白表达显著升高,说明棕榈酸诱发了明显的内质网应激。四君子颗粒含药血清预孵24 h后可明显下调细胞内GRP78 蛋白表达,而空白对照血清对GRP78 表达无明显影响,提示四君子颗粒含药血清可有效改善棕榈酸诱导的MIN6 细胞内质网应激。
生理条件下,GRP78 与内质网应激感受蛋白肌醇需求酶 1α (inositol⁃requiring enzyme 1α,IRE1α)、活化转录因子6 (activating transcription factor 6,ATF6) 和RNA⁃依赖的蛋白激酶样内质网激酶(PRK like ER associated kinase,PERK) 结合而使后者处于无活性状态。当大量未折叠蛋白在内质网腔内积聚时,一方面细胞代偿性合成GRP78增加;另一方面,结合于3 种膜蛋白上的GRP78解离,转而去结合未折叠蛋白,游离出的IRE⁃1α、PERK、ATF6 进而诱发内质网应激下游信号传递及相关基因表达[13]。通过上述信号通路,UPR 可改变细胞代谢方式,促使细胞存活。但当内质网应激过于强烈或持续时间过久,UPR 无法使内质网恢复稳态时,则可诱导细胞凋亡。IRE⁃1α、PERK和ATF6 通路的活化均可上调CHOP 蛋白表达,诱导细胞凋亡,其中PERK 途径在内质网应激诱导细胞凋亡中发挥主要作用[14]。本研究结果显示,与棕榈酸孵育24 h 后,MIN6 细胞内ATF4 蛋白、磷酸化PERK 及其下游蛋白CHOP 表达均显著升高,而与四君子颗粒含药血清预孵可明显抑制上述蛋白表达,这一作用与四君子颗粒含药血清抑制MIN6细胞凋亡作用一致,提示四君子颗粒含药血清抑制棕榈酸诱导的MIN6 细胞凋亡与抑制细胞内质网应激及PERK 相关凋亡信号通路有关。
综上所述,四君子颗粒含药血清可有效抑制棕榈酸诱导的MIN6 细胞凋亡,其机制与抑制内质网应激PERK 信号通路有关。该研究结果提示,四君子颗粒防治2 型糖尿病可能与保护胰岛β 细胞、改善胰岛功能有关。
