脐带脱细胞支架培养鼠肝前体样细胞功能研究
2020-09-04景宏舒彭媛王振宇李伟建袁天杰张洪丹鄢和新翟博
景宏舒 彭媛 王振宇 李伟建 袁天杰 张洪丹 鄢和新 翟博
肝脏组织工程,是一个跨学科的综合领域,涉及工程学、物理科学和生命科学等学科,旨在体外构建出有功能的肝脏[1]。肝脏细胞、支架材料以及细胞生长因子并称为肝脏组织工程的三大基本组成要素[2]。组织脱细胞技术是运用物理和化学方法,最大限度去除细胞成分,降低免疫原性,更好地保留细胞外基质成分的一项工程技术[3,4]。
材料与方法
一、材料与试剂
C57BL/6雄性小鼠购自上海南方模式生物科技有限公司。新鲜脐带取自上海交通大学医学院附属瑞金医院妇产科孕产妇,血清病毒指标阴性,已签署相关知情同意书。
TEM基于HepX Basal,补充成分N2和B27购自源培生物科技股份有限公司,FBS购自以色列BI公司,HGF、EGF、FGF 、A83-01、CHIR-99021和Y-27632均购自美国TargetMol公司,1% 丙酮酸钠溶液、Nac、Vc均购自上海陶速生物科技有限公司。KCI、SDS、TritonX-100、三溴乙醇粉末、EGTA粉末、BSA粉末均购自美国Sigma-Aldrich公司,Percoll溶液购自上海索宝生物科技有限公司,Ⅳ型胶原酶购自美国worthington公司。细胞膜红色荧光探针购自上海碧云天生物技术有限公司。
二、实验方法
(一)脐带脱细胞工艺处理 新鲜脐带组织置于无菌TissueMateTM组织运输液内,冰上保存并运输。取出脐带,用无菌PBS溶液洗净血污。切成长度3 cm的小段,沿长轴剖开,小心剔除2根脐动脉和1根脐静脉。依次浸没在10 mM TBS低渗溶液、含1 M KCl和1 %(v/v)TritonX-100高渗溶液、0.03 %(w/v)SDS溶液、50 mM TBS等渗溶液内,每个处理阶段需震荡作用12~24 h,最后用纯化水反复冲洗,冷冻干燥24 h后制备脐带脱细胞支架材料,25kGy低温辐照灭菌,4 ℃长期保存。
(二)小鼠原代肝细胞分离 麻醉雄性C57BL/6小鼠,400 mg/kg剂量腹腔注射2 %三溴乙醇溶液(阿拉丁),开腹充分暴露肝脏。将留置针从门静脉远心端穿刺,向肝脏方向依次灌注使用0.02% EGTA溶液和0.02% Ⅳ型胶原酶灌注液,肉眼观察肝脏逐渐变软时,停止灌注。剪下肝脏,放在内盛TEM的培养皿内,用1 mL注射器推杆钝性碾磨肝脏,直至观察无明显块状组织,制得细胞悬液。用70 μm滤网滤弃组织碎片,低速离心,用等体积Percoll溶液纯化得到小鼠原代肝细胞。
(三)肝前体样细胞2D培养和标记 分离得到的原代肝细胞,用转化与扩增培养基(Transition and Expansion Media, TEM)接种均匀培养。培养两周后,在TEM培养体系下,添加0.2 μM DiL共孵育20 min,在荧光倒置显微镜(Nicon)下观察小鼠肝前体样细胞(Rodent hepatocyte-derived liver progenitor-like cells, rHepLPCs)的标记情况。
(四)核酸、羟脯氨酸和糖胺聚糖定量分析 称取冷冻干燥处理过的脐带组织和脐带脱细胞材料,使用DNA抽提试剂盒(QIAamp)、羟脯氨酸定量试剂盒(酸化法)和BlyscanTM 硫酸化糖胺聚糖定量试剂盒(Biocolar),根据公式计算各个样品内各成分含量。
(五)石蜡包埋切片和化学染色 10%甲醛固定,不同浓度酒精脱水(75%、95%和100%),二甲苯脱蜡,用熔化石蜡包埋样品。用轮转式切片机切片、制片并烘干,常温保存。Masson染色和HE染色选用相应试剂盒并拍摄图片。
(六)肝前体样细胞3D培养和细胞增殖情况 制备rHepLPC细胞悬液,密度在5×107/mL,50 μL体积量接种在支架材料的华通胶面上,30 rpm水平摇晃培养,构建三维支架上培养rHepLPCs复合体(3D-rHepLPCs)。使用alamarBlueTM细胞活力检测试剂(Invitrogen)检测细胞活性,酶标仪读取吸光度值定量分析细胞增殖情况,对照组为2D培养的rHepLPCs。
(七)荧光定量PCR 使用Trizol试剂裂解支架上的细胞,三氯甲烷和异丙醇提取总RNA,使用GoScript?反转录试剂盒(Promega)合成cDNA,使用7300 plus实时PCR系统(Life Technologies)和SYBR Green qPCR Mix(2X,High ROX)(碧云天生物科技有限公司),以β-actin为内参进行内部控制计算相关基因的表达量,使用△△Ct方法分析基因转录数据,引物由上海华津生物科技有限公司合成,引物序列选自PrimerBank数据库。
(八)氨清除和尿素合成 换过新鲜培养基后,向TEM培养基中加入3 mM NH4CI,与细胞共同孵育24小时,氨成分(快速)试剂盒(Megazyme)检测氨清除量,QuantiChromTM尿素测定试剂盒(BioAssay Systems)检测尿素含量。
(九)统计学处理 通过GraphPad Prism 7软件进行统计学分析,采用student’st检验,P<0.05为差异有统计学意义。
结 果
一、脐带脱细胞材料的外观和内部结构
将新鲜脐带组织置于低-高渗透压环境破坏细胞,使用TritonX-100和SDS有效去除残留的细胞碎片,经过冷冻干燥,增加材料内部贯通程度,低温辐照灭菌,制备脐带脱细胞支架材料。H&E染色示材料孔隙增大,细胞核有效去除,而Masson染色示材料仍保留较多胶原成分,见图1。
二、材料的核酸残留量和细胞外基质含量情况
经定量分析,脱细胞处理前的脐带组织核酸含量为(629.87±22.30)ng/mg (干重),而脐带脱细胞支架材料仅保留(60.20±1.42)ng/mg (干重)核酸含量,核酸去除率达到90.5 %以上,有统计学上差异,P=0.0023;脱细胞处理前的脐带组织羟脯氨酸含量为(4.97±1.41)μg/mg(干重),脐带脱细胞支架材料仍能保留(2.74±0.49)μg/mg(干重)羟脯氨酸含量,差异无统计学意义(P=0.101 0);脱细胞处理前的脐带组织有(8.82±0.18)μg/mg(干重)糖胺聚糖含量,脱细胞处理后的支架材料含量为6.80±0.23)μg/mg(干重糖胺聚糖含量,有统计学上差异(P=0.030 6)。脱细胞工艺去除核酸效果明显,对羟脯氨酸和糖胺聚糖等成分含量影响较小。
三、rHepLPCs在脐带脱细胞支架上的分布和增殖情况
新鲜分离的小鼠原代肝细胞胞质大核深染,呈多边形,形态不均一。在TEM体外培养14 d,细胞形态发生变化,呈鱼梭形,核质比增大,形态均一。用Dil标记过的肝细胞在荧光显微镜镜下分布均匀,易于定位追踪。在TEM和三维培养下rHepLPCs(rHepLPCs-3D),细胞培养情况见图2。细胞增殖方面,第一天时支架上培养rHepLPCs细胞稍慢于平面培养,而培养14 d,细胞数量十分接近平面扩增量,见表1。

表1 不同天数支架材料上培养肝前体样细胞的吸光度值(±s)
四、rHepLPCs在脐带脱细胞支架上的功能基因表达和氨代谢情况
QPCR分析小鼠原代肝细胞、2D培养下rHepLPCs和rHepLPCs-3D功能基因表达情况,见表2。TEM作用下原代肝细胞向肝前体样细胞转化过程中,肝细胞标志物HNF4α表达明显下降,胆管细胞标志物CK19表达明显升高,提示肝前体细胞在体外高效扩增中部分丢失肝细胞功能,血浆蛋白Alb、氨代谢关键酶CPS和糖异生关键酶G6PC相应地表达下调。在脐带脱细胞支架上培养第7天和第14天,肝细胞功能基因表达部分恢复上调,胆管细胞标志物明显下调。
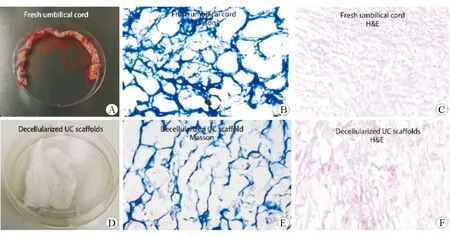
A:剖宫产妇脐带;B:新鲜脐带Masson染色;C:新鲜脐带H&E染色;D:脐带脱细胞支架材料;E:支架材料Masson染色;F:支架材料H&E染色,×40
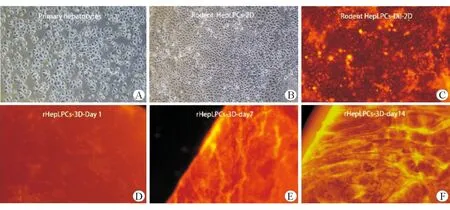
A:原代肝细胞贴壁4 h;B:肝前体样细胞2D培养下14 h;C:标记过Dil的rHepLPCs;D:支架培养rHepLPCs第1天;E:支架培养rHepLPCs第7天;F:支架培养rHepLPCs第14天,×40

表2 2D和3D培养下肝前体样细胞功能基因比较(±s)
氨代谢能力是肝细胞解毒功能的重要内容,表现为氨解毒和尿素合成的两个过程。2D培养下的rHepLPCs,氨清除量为(5.7±0.9)mg/(dL·106细胞·d),而尿素含量为(7.1±2.5)mg/(dL·106细胞·d),3D支架培养的rHepLPCs在培养1周时氨清除和尿素量达到2D培养的3倍水平,在培养2周时氨清除和尿素量达到2D培养的3倍水平近6倍,均有统计学意义,P<0.05,见表3。

表3 2D和3D培养下肝前体样细胞氨代谢能力比较[mg/( dL·106细胞·d)]
讨 论
组织工程化肝脏的核心要素是细胞,原代肝细胞是最理想的种子细胞[5,6]。细胞支架材料的选择,对3D培养体系下细胞功能提升和长期存活至关重要。使用化学小分子调控转录因子的表达逆转肝细胞命运,实现肝前体样细胞在体外高效扩增和进一步分化成熟,解决了肝细胞在体外不能长期扩增的难题[7,8]。rHepLPCs在脐带脱细胞支架上培养,实现了肝细胞功能部分恢复,尤其在氨代谢方面表现突出。
脐带组织(Umbilical Cord, UC),属于黏液结缔组织,包含两条动脉和一条静脉,周围包绕着华通胶成分(Wharton’s jelly matrix, DWJM)。华通胶富含胶原(Collagen)、糖胺聚糖(Glycosaminoglycan, GAGs)和多种生长因子[9]。此外,无血管滋养管、神经、淋巴等结构,使剥离脐带血管、保留华通胶结构成为可能[10]。从材料来源讲,脐带脱细胞支架作具有临床上易获得,医学伦理争议小等特点。
有多家国内外研究团队报道脐带脱细胞支架在软骨重建和神经损伤等组织修复方面,侧面证明脐带脱细胞支架材料的潜在应用价值[11,12]。
从组织工程化肝脏的构建方式讲,采用多种培养策略,提高肝前体样细胞在支架上再定植效率和分化成熟度[13-15];多细胞培养模式,如肝细胞、间充质干细胞和内皮细胞共培养,对改善细胞的氧耗和新陈代谢和功能性血管网络形成至关重要[16]。
综上所述,联合脐带脱细胞支架的3D培养,肝前体细胞可以发挥氨代谢的优势,建立富有潜力的肝脏组织功能单元,为以血氨升高为特征的急性肝衰竭治疗提供新选择。
