小干扰RNA的纳米药物输送系统及其用于癌症治疗的研究
2020-09-02左佑
摘 要:目的:研究小干扰RNA的纳米药物输送系统及其在癌症治疗中的应用。方法:制备给药体系,分析纳米颗粒分散度,借助于小鼠模型,分析纳米颗粒对肿瘤细胞生长和凋亡的影响。结果:将纳米颗粒悬于胎牛血清培養基中,使用动态光散射方法对粒径以及分散度进行检查。在72h内,分散度相对稳定,纳米颗粒具有良好的稳定性。将siPlk1和HepG2细胞进行培养,经染色处理后使用流式细胞术,由于输送siPlk1后,对癌细胞HepG2的Plk1基因表达起到下调作用,从而促进癌细胞的凋亡。利用小鼠乳腺癌细胞模型,向小鼠静脉注射siPlk1纳米颗粒,观察肿瘤生长情况,包载siPlk1纳米颗粒具有抑制肿瘤生长的作用,组间差异显著(P<0.05)。结论:通过PEG化规避和蛋白互相发生作用,避免受到免疫系统的清除,能够大量聚集在肿瘤位置,实现靶向治疗,对肿瘤细胞生长起到抑制作用。
关键词:纳米药物;输送系统;siRNA;癌症治疗
中图分类号:R730.5 文献标识码:A 文章编号:1671-2064(2020)07-0201-02
0 引言
PLK1是一种调控有丝分裂的激酶,乳腺癌患者体内过度表达,抑制PLK1表达,肿瘤细胞敏感度可有效提高[1]。利用RNA干扰技术对PLK1的表达抑制,有助于利用siRNA抑制PLK1表达,对乳腺癌细胞增殖起到抑制作用。在癌症治疗的siRNA药物中,常使用阳离子脂质体作为包载层,但有研究提出应用高分子聚合物在给药传输体系中,能够有机结合siRNA药物和靶向细胞,提高输送药物效果,引导药物在肿瘤病变区域聚集,对充分发挥疗效,提高治疗作用有积极作用。因此本文对siRNA给药体系及癌症治疗的应用作一研究如下:
1 资料与方法
1.1 试验材料
准备阳离子脂质、胎牛血清、DMEM培养基、PBS缓冲液、PLK1抗体、PLK1正义链等。
1.2 方法
验证纳米颗粒稳定性,需要将纳米颗粒siRNA和牛血清蛋白,在PBS溶液中混合,经过0h、12h、24h、36h、48h、72h的培养后,对纳米颗粒分散度进行动态光散射的检测。将癌症细胞终止与培养板中,在37℃恒温环境下进行培养,24h后,更换为包载和未经包载的siPlk1溶液,进行2h培养后,替换为完全培养基。继续培养46h后,使用PBS清洗2次,对细胞进行收集和消化,使用流式细胞计数仪进行检测。对雌性裸鼠乳腺脂肪垫接种癌症细胞,14d后可形成肿瘤,体积约为100mm3。经尾静脉注射不同纳米颗粒溶液,给药24h后,处死小鼠,取出肿瘤组织后,使用活体成像仪对肿瘤区域的富集进行检测。提取肿瘤组织后,使用多聚甲醛处理后,使用蔗糖溶液过夜处理。制作肿瘤切片,使用DPAI复染,使用激光检查siRNA的分布情况。建立原位模型后,取五组小鼠,每天注射药物,在移植14d、移植18d、移植22d、移植26d后,分别测量肿瘤体积。
1.3 统计学方法
采用SPSS 21.0软件处理数据,使用t和检验资料,P<0.05视为差异有统计学意义。
2 结果
2.1 纳米颗粒稳定性
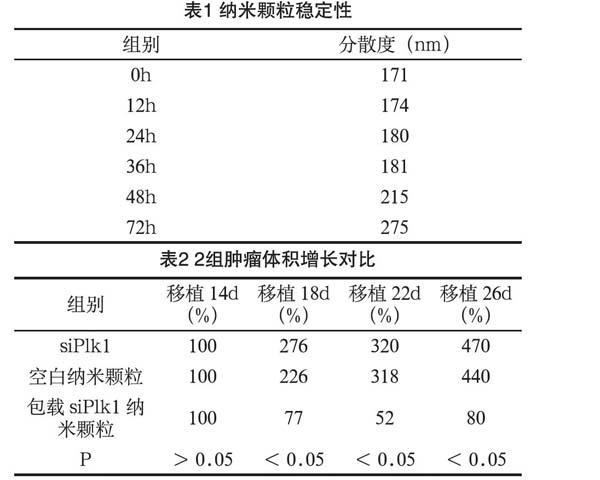
将纳米颗粒悬于胎牛血清培养基中,使用动态光散射方法对粒径以及分散度进行检查。经过观察发现纳米颗粒的粒径可在72h内保持稳定,代表颗粒PEG链段具有非特异性吸附阻止作用。详见表1。
2.2 纳米颗粒输送siPlk1对癌细胞凋亡的影响
将siPlk1和HepG2细胞进行培养,经染色处理后使用流式细胞术,分析对癌细胞的影响。将siPlk1输送至癌细胞中,可发现癌细胞大量凋亡,凋亡比例和输送剂量存在直接关联。未经包载的siPlk1颗粒未见癌细胞凋亡。由于输送siPlk1后,对癌细胞HepG2的Plk1基因表达起到下调作用,从而促进癌细胞的凋亡。
2.3 纳米颗粒对癌细胞生长的影响
包载siPlk1纳米颗粒具有抑制肿瘤生长的作用,而裸siPlk1、空白纳米颗粒均无法达到抑制肿瘤生长的作用,组间差异显著(P<0.05)。详见表2。
3 讨论
siRNA在肿瘤治疗中具有特异性和高效性的作用优势,逐渐在多种肿瘤治疗中应用,取得了理想的治疗效果[2]。siRNA通过对肿瘤侵袭、转移以及传导起到抑制作用,从而达到治疗的目的。其治疗原理为在特定细胞中导入RNA后,诱导目标基因沉默,从而降低基因活性[3]。由于siRNA能够特异性下调特定基因表达,该技术也逐渐应用于治疗恶性肿瘤疾病中,尤其是肿瘤、艾滋病等疾病的治疗中,可达到理想的治疗效果[4]。目前研发siRNA药物遇到了输送系统的难题,在siRNA药物中普遍应用阳离子聚合物作为给药系统。但是这类载体很难改善疗效,由于阳离子聚合物联合siRNA所携带的纳米颗粒会和血清蛋白发生相互作用,造成颗粒聚集,被免疫系统清除,很难作用于目标癌症细胞[5]。很多研究提出,对纳米颗粒进行稳定化处理,避免受到免疫系统的清除,有助于延长纳米颗粒循环时间,在EPR效应的作用下,能够富集在肿瘤部位,造成靶基因效率降低,对肿瘤生长效果产生负面影响[6]。大部分肿瘤细胞生存在微酸性缺氧环境中,有研究提出,在pH低于8.0的环境中,纳米细胞PEG层脱掉,带正电表面被重新暴露,在肿瘤环境中,纳米颗粒脱掉PEG层,可以大量聚集在肿瘤部位,实现大量被肿瘤细胞摄取。
对siRNA和阳离子聚合物包裹PEG化高分子,到达病灶位置脱去高分子层,暴露siRNA以及阳离子聚合物构成的纳米颗粒,可有效避免RNA干扰,提高肿瘤细胞摄取率[7]。在这一给药体系下,通过静脉给药,在PEG的修饰作用下,能够减少血清蛋白的相互作用,让药物在患者体内的时间延长,能够聚集在肿瘤病变位置,进而达到理想的治疗效果[8]。在EPR效应作用下,纳米颗粒可以大量在肿瘤部位聚集,肿瘤微酸性环境,能够促进脱落PEG壳,让纳米颗粒充分暴露,实现大量查杀肿瘤细胞,实现更高的靶向表达,对肿瘤细胞的繁殖和生长起到抑制作用[9-10]。将纳米颗粒悬于胎牛血清培养基中,使用动态光散射方法对粒径以及分散度进行检查。经过观察发现纳米颗粒的粒径可在72h内保持稳定,代表颗粒PEG链段具有非特异性吸附阻止作用[11]。
癌症基因PLK1的过度表达形成了肿瘤,对PLK1表达抑制,能够阻碍癌症细胞有丝分裂,从而促进细胞凋亡。将siPlk1和HepG2细胞进行培养,经染色处理后使用流式细胞术,分析对癌细胞的影响[12]。将siPlk1输送至癌细胞中,可发现癌细胞大量凋亡,凋亡比例和输送剂量存在直接关联。未经包载的siPlk1颗粒未见癌细胞凋亡[13]。根据凋亡结果验证了siPlk1能够结合癌症细胞表面受体,内吞纳米颗粒,促进纳米颗粒的摄取,增加纳米颗粒输送,促进siPlk1沉默[14]。在此基础上促进癌症细胞凋亡,对癌症细胞增值起到抑制作用。
利用小鼠乳腺癌细胞模型,向小鼠静脉注射siPlk1纳米颗粒,并未观测到肿瘤细胞的生长。包载siPlk1纳米颗粒具有抑制肿瘤生长的作用,而裸siPlk1、空白纳米颗粒均无法达到抑制肿瘤生长的作用,组间差异显著(P<0.05)。研究证实除包载siPlk1纳米颗粒组外,其他两组均不能对肿瘤细胞生长起到抑制作用[15]。靶向纳米颗粒在EPR作用下,在肿瘤部位富集,肿瘤细胞表面高表达的受体能够和纳米颗粒抗体结合,内吞纳米颗粒,增加摄取量,从而将有效药物成分输送至癌症细胞中,造成siPlk1沉默,达到抑制细胞增殖的作用,控制肿瘤生长。
综上所述,通过PEG化规避和蛋白互相发生作用,避免受到免疫系统的清除,能够大量聚集在肿瘤位置,实现靶向治疗,对肿瘤细胞生长起到抑制作用。纳米颗粒聚集在肿瘤位置后,纳米颗粒克服PEG表面修饰,能够促进肿瘤细胞摄取纳米颗粒,达到良好的抑制作用,提高药物疗效。
参考文献
[1] 孙雅静,王一斌,刘艳杰,等.聚合物纳米药物用于治疗脑胶质瘤的最新研究进展[J/OL].中国科学:生命科学:1-17[2020-05-16].
[2] 張滨旋,于涛.纳米药物递送系统协同光热疗法治疗肿瘤多药耐药的研究进展[J].肿瘤,2020(4):299-304.
[3] 周厚妊,张月,辛莹,等.基于超声靶向微泡破坏技术的纳米给药系统的研究进展[J].临床超声医学杂志,2020(3):208-211.
[4] 张敏娜,钟鸣,王光辉.多柔比星纳米递药系统在三阴性乳腺癌靶向治疗中的应用[J].中国药理学通报,2020(3):313-316.
[5] 武聪,史宏灿.细胞-纳米药物载体递送系统在肿瘤诊疗中的应用[J].中国肿瘤生物治疗杂志,2020(1):86-90.
[6] 郭惠婕,姜文姣,缪明星,等.抗肿瘤纳米药物的靶向递送及药代动力学模型研究进展[J].中南药学,2020(1):74-79.
[7] 张换乐,朱丹丹,林舒婷,等.酸敏感响应型纳米药物递送系统在肿瘤治疗中应用的研究进展[J].中南药学,2019(12):2091-2099.
[8] 董丽娜,蔡璐璐,赵明明,等.生物大分子载体在肿瘤纳米靶向药物研发中的应用研究进展[J].山东医药,2019(35):83-87.
[9] 张长梅,陈重,唐雪枫,等.表面修饰糖类化合物的纳米粒子主动靶向肿瘤的研究进展[J].中国医药导报,2019(34):61-64.
[10] 李晨,祁迎秋,王亚洲,等.基于靶向调控肿瘤微环境的多肽纳米药物系统研究进展[J].功能高分子学报,2019(5):567-581.
[11] 罗尧尧,石金凤,陈梁,等.雷公藤甲素功能化纳米递药系统用于抗肿瘤的研究进展[J].中国中药杂志,2019(21):4566-4572.
[12] 魏恺言,付旭东,王新军,等.仿生型纳米红细胞靶向药物递送系统的制备及体内外抗肿瘤效果评价[J].安徽医科大学学报,2019(7):1016-1022.
[13]宋颖,杨琛擘,申培红,等.siRNA沉默乳腺癌特异基因1及核酸药物递送系统的研究进展[J].河南医学研究,2019(6):1147-1149.
[14]吴鸣,张钰,韩立冬,等.聚酰胺-胺树状聚合物用于肿瘤靶向纳米药物递送的研究进展[J].药学进展,2018(8):608-614.
[15]曹晓孚,孟路华,刘振,等.纳米药物载体介导的联合给药逆转肿瘤多药耐药的研究进展[J].中国药房,2018(5):716-720.
收稿日期:2020-03-06
作者简介:左佑,男,河南许昌人,本科,研究方向:高分子siRNA 纳米药物的制备及脑胶质瘤治疗。
