一株高产δ-ALA的酿酒酵母菌株的固态发酵条件优化及其代谢产物检测方法
2020-09-02陈泽田陆凌雪白静文梁子豪
陈泽田,陆凌雪,白静文,梁子豪,张 坤,潘 韵
(1.河南邑鸿善成生物技术有限公司,河南 焦作 454950;2.天津大学化工学院,天津 300072)
δ-氨基乙酰丙酸(δ-ALA)是生物体内四氢吡咯合成的前体,在各种生物中广泛存在,是合成叶绿素、血红素、维生素B12的必需因子,广泛存在于细菌、真菌、动物及植物等生物机体活细胞中的非蛋白质氨基酸,是动植物生命活动必需的、代谢活跃的生理活性物质,可以通过生物途径合成,也可以人工化学合成,没有毒副作用,易降解无残留。δ-ALA由于其独特的性质而被广泛应用在手术[1]以及癌症和其他疾病的治疗上[2-3]。在动物上的应用近年来也开始有报道。东京大学的Sato等在肉鸡上使用0.001%的δ-ALA,结果表明,其可以预防免疫刺激引起的分解代谢变化,鸡只在21日龄和50日龄的体重明显增加[4]。得克萨斯大学的Mateo等在21日龄断奶仔猪上使用0.05%的δ-ALA,结果发现,添加δ-ALA增加了红细胞计数,且对断奶仔猪无不良影响[5]。东京大学的Ivane等在凡纳对虾上使用15 mg/kg的δ-ALA,发现其促进了凡纳对虾对副溶血弧菌的免疫反应,上调了免疫和防御相关的基因表达,增强了有氧能量代谢[6]。而酵母菌是人类最早利用、公认安全且应用最广泛的微生物,是全球目前唯一年产量超过百万t的微生物。酵母类饲料是公认的优质饲料。
国内对于微生物发酵法生产δ-ALA的研究已有许多报道,但绝大多数均作为原料药物研究,且宿主基本都是细菌,如嗜酸红假单胞菌[7]、大肠杆菌[8]、谷氨酸棒状杆菌[9]、科氏葡萄球菌[10]等。本研究2018年通过基因工程方法对酵母菌进行改造,成功获得一株能大量积累δ-ALA的菌株PRS-416。在获得基因工程菌之后,对其固态发酵工艺进行深入研究,并针对酵母代谢产物δ-ALA的测定分析比较了分光光度法、高效液相色谱法及液相色谱-质谱法对结果的影响,确定了一种酵母代谢产物δ-ALA的测定方法,对酵母类饲料产品建立新的标准提供了一定的参考。
1 材料与方法
1.1 发酵原料与菌株
玉米,购自沁阳市金玉米种植专业合作社;玉米蛋白粉,购自内蒙古伊品生物科技有限公司;豆粕,购自焦作市三福饲料有限公司;大米粉,购买原阳大米粉碎制备;发酵前,所有原料均粉碎后过40目筛;菌株,酿酒酵母PRS-416,由天津大学构建。
1.2 测试样品
测试的4种酵母类产品分别为:(1)酿酒酵母培养物,河南邑鸿善成生物有限公司提供;(2)PRS-416酿酒酵母菌体,河南邑鸿善成生物有限公司提供;(3)市售高活性干酵母,产地湖北;(4)市售饲料用酵母水解物,产地广西。
1.3 仪器与试剂
仪器:高效液相色谱仪Agilent 1220,美国安捷伦公司;Waters ACQUITY-UPLC配置 ACQUITY SQ检测器,美国Waters公司;分光光度计UV-1100,上海美谱达仪器有限公司。
试剂:甲醇,色谱纯;丹磺酰氯、丙酮、冰乙酸、高氯酸、乙酰乙酸乙酯,分析纯;无水乙酸钠、对-二甲氨基苯甲醛、无水葡萄糖,分析纯;δ-ALA盐酸盐、YNB、Ura Dropout Powder、酵母浸粉(Yeast Extract)、胰蛋白胨(Trptone),BR级。
1.4 培养基
Sc-Ura选择培养基:无水葡萄糖20 g/L,YNB 0.067 g/L,Ura Dropout Powder 0.001 3 g/L,pH 5.6;YPD液体培养基:无水葡萄糖20 g/L,酵母浸10 g/L,胰蛋白胨20 g/L。
以上培养基均115℃灭菌30 min后使用。
1.5 酿酒酵母PRS-416的培养
将Sc-Ura选择培养基上长好的菌落挑取一环于YPD液体培养基中,30℃,220 r/min培养12 h后,再按照2%比例转接一次,同样条件培养12 h后制成种子液(显微镜计数≥2.0×108CFU/ml)用来进行固态发酵。
1.6 固态发酵条件优化
1.6.1固态发酵条件底物筛选
玉米、玉米蛋白粉、豆粕、大米粉以不同质量比(4∶1∶0∶0,2∶0∶1∶0,2∶1∶0∶1,3∶0∶2∶2)混匀并称取200 g,料水比为1∶0.5,菌液接种量50 ml/kg(与发酵底物的比例),葡萄糖0.25%(与发酵底物的比例),混匀后装入1 L烧杯中,放入30℃培养箱中,固体发酵36 h,70℃烘干30 min后用分光光度法测定其δ-ALA含量。
1.6.2固态发酵培养基筛选
发酵底物玉米、玉米蛋白粉(质量比4∶1)称取200 g于1 L烧杯,料水比为1∶0.5,菌液接种量50 ml/kg,放入30℃培养箱中,固体发酵36 h,70℃烘干30 min后用分光光度法测定其δ-ALA含量。考虑接种量(S)、葡萄糖(G)、丁二酸+甘氨酸(D)、酵母浸粉+胰蛋白胨(Y)这4个因素(将后2种组合成1个因素看待),试验方案按照表1设计。
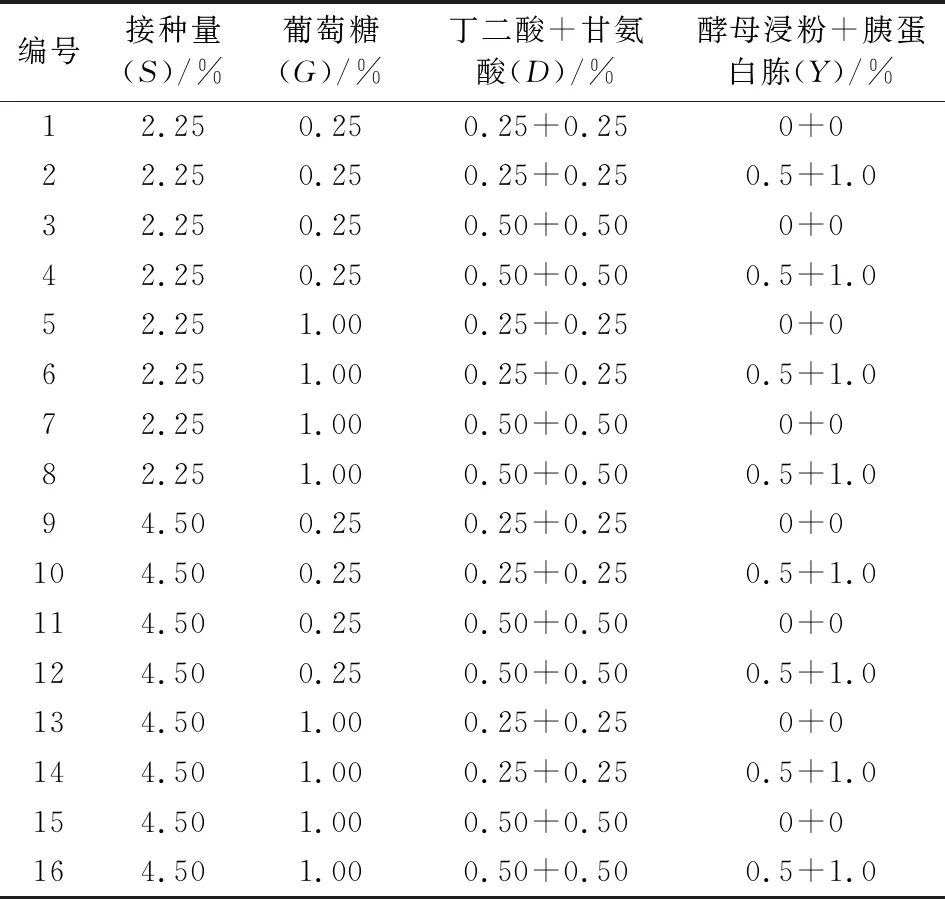
表1 固态发酵培养基筛选方案
1.6.3发酵时长的确定
发酵底物玉米、玉米蛋白粉(质量比4∶1)称取200 g于1 L烧杯,料水比为1∶0.5,菌液接种量22.5 ml/kg,葡萄糖0.25%,丁二酸0.5%,甘氨酸0.5%,在烧杯中搅拌均匀,放入30℃培养箱中,分别发酵24、36、48、60、72 h,70℃烘干30 min后用分光光度法测定其δ-ALA含量。
1.7 不同检测方法检测样品的δ-ALA含量
1.7.1样品前处理
称取样品1、2、3、4各1 g,加入5 ml去离子水震荡混悬2 min后,4℃ 10 000 r/min离心5 min。取上清1 ml,加入同体积40%三氯乙酸,震荡,混匀,10 000 r/min,4℃离心10 min,用0.22 μm滤膜过滤。
1.7.2分光光度法测定δ-ALA含量
标准曲线绘制:参考中华人民共和国卫生行业标准[11]配制δ-ALA标准溶液,绘制标准曲线如图1。得到δ-ALA回归方程为y=0.064x+0.006 7。

图1 分光光度法绘制的标准曲线
测定δ-ALA含量[11]:取样品1 ml置于10 ml离心管中,依次加入1 ml去离子水,2 ml乙酸盐缓冲液,0.4 ml乙酰乙酸乙酯,沸水浴12 min。冷却至室温后,加入4 ml乙酸乙酯萃取,震荡混匀后静置直至分层;取2 ml上层乙酸乙酯萃取液,加入2 ml显色液,混匀,反应10 min后,在554 nm处进行检测。
1.7.3高效液相柱前衍生法[12]测定δ-ALA含量
色谱条件:C18型色谱柱(250 mm×4.6 mm,5 μm),用流动相为0.05 mol/L乙酸钠水溶液与色谱纯甲醇以35∶65体积混合,分别使用2.5 mol/L柠檬酸调节pH值至目标值。流速1 ml/min,柱温30℃。
标准曲线绘制:按照上述的色谱条件,分别配制不同浓度(10、50、100、400 mg/L)的标准溶液进行分析,每个标准溶液重复3次。以峰面积为纵坐标,以δ-ALA的浓度为横坐标绘制标准曲线见图2,得到回归方程y=ax+b,其中,a=2.329 17×10-5,b=-120.648,回归系数R2为0.998 867。
测定方法:0.5 ml样品与0.45 ml饱和NaHCO3溶液混合,震荡均匀后加入丹磺酰氯丙酮溶液0.25 ml 90℃避光进行衍生反应,衍生结束后加入0.05 ml冰乙酸终止反应,0.22 μm膜过滤后进样进行检测。
1.7.4液相色谱-质谱法对样品中δ-ALA定性分析
样品处理方法除未用三氯乙酸处理外其余方法和1.7.1节样品前处理方法一样。样品上样前用甲醇稀释10倍,液相色谱条件为:Waters ACQUITY UPLC系统,色谱柱为ACQUITY UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm),流动相为100%甲醇,柱温:30℃,流速为0.5 ml/min。质谱条件为:Waters ACQUITY SQD;电离模式,(+)ESI;毛细管电压3.0 kV;锥孔电压20 V,离子源温度120℃;去溶剂化温度300℃;脱溶剂气体流速550 L/h;锥孔气体流速50 L/h。
2 结果与分析
2.1 不同发酵底物对发酵饲料中δ-ALA的影响
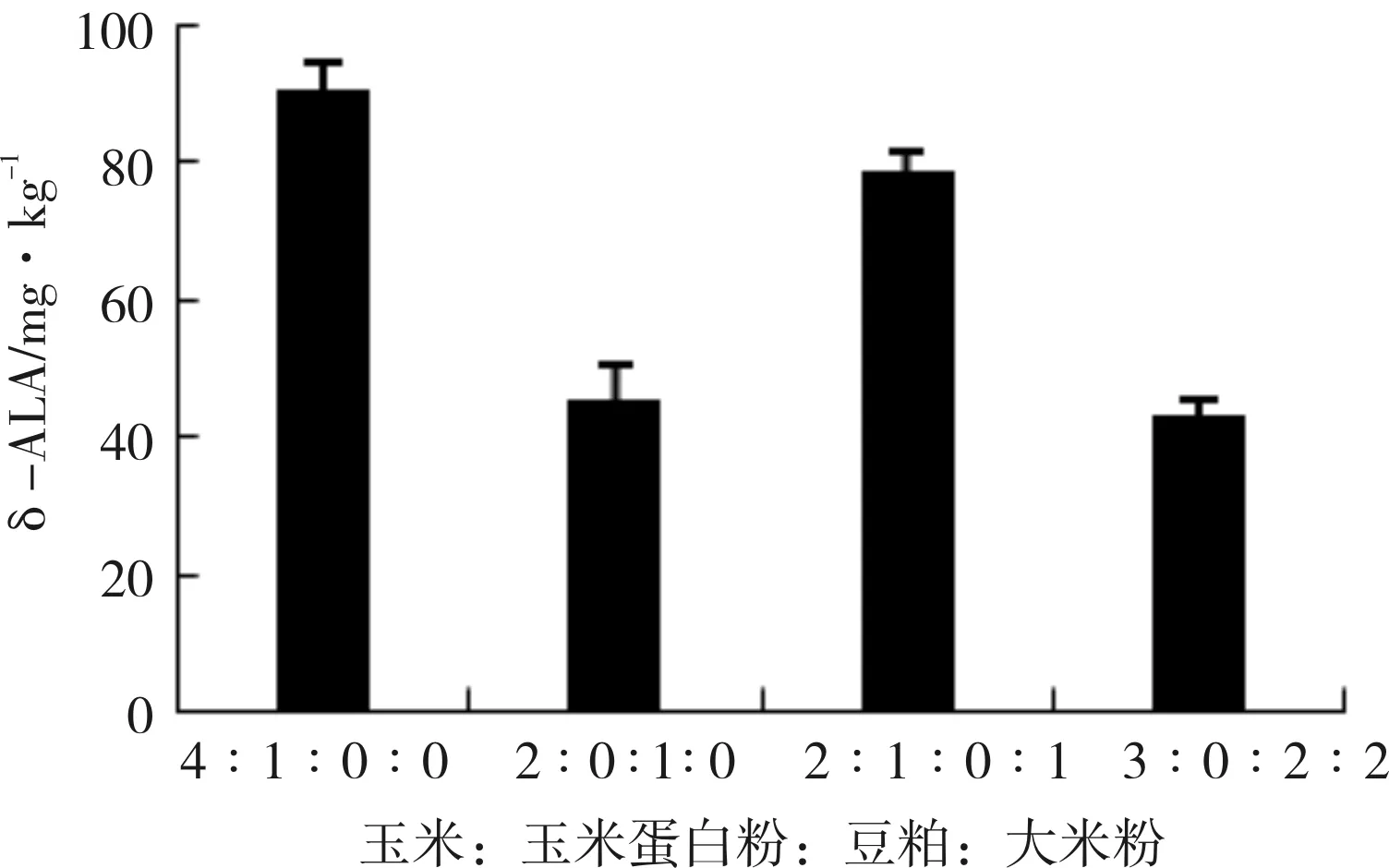
图3 不同发酵底物对发酵饲料中δ-ALA的影响
1.6.1节方法中的4个试验组,均是根据发酵饲料的粗蛋白质质量分数≥18%配比。以这4个配比发酵后可以看出,玉米∶玉米蛋白粉∶豆粕∶大米粉比例为4∶1∶0∶0和2∶1∶0∶1的试验组发酵24 h后其δ-ALA含量较高,分别为91.13和79.02 mg/kg。综合考虑,选取4∶1∶0∶0作为发酵底物的最佳比例。
2.2 不同固态发酵培养基对发酵饲料中δ-ALA的影响
固态发酵培养基的配方设计见表1,结果如图4所示。

图4 不同发酵培养基对发酵饲料中δ-ALA的影响
由图4可知,第11组δ-ALA含量最高。酵母粉和胰蛋白胨含量增加,反而会降低δ-ALA含量,所以在后续试验中不再添加酵母粉和胰蛋白胨;个别组菌液接种量由22.5 ml/kg增加到45 ml/kg,δ-ALA含量会有一定的提高,但不显著。综合考虑,后续试验中选取22.5 ml/kg作为菌液接种量的最佳比例;葡萄糖添加量由0.25%增加到1.00%,δ-ALA含量没有显著性差异,个别组甚至降低,后续试验选取0.25%作为葡萄糖添加的最佳比例;整体趋势上,增加丁二酸和甘氨酸的添加量会使发酵饲料中δ-ALA含量升高,所以,后续试验选取0.5%和0.5%作为丁二酸和甘氨酸添加的最佳比例。
2.3 不同发酵时长对发酵饲料中δ-ALA的影响
选择优化好的配方,玉米∶玉米蛋白粉4∶1,料水比为1∶0.5,菌液接种量22.5 ml/kg,葡萄糖0.25%,丁二酸0.5%,甘氨酸0.5%,探究不同发酵时长对发酵饲料中δ-ALA的影响,结果见图5。由图5可知,24~48 h,随发酵时长的增加,δ-ALA含量逐渐升高,48 h δ-ALA含量可达到338.87 mg/kg;48 h以后,δ-ALA含量增长趋于平稳,甚至到72 h会呈现略微下降的趋势。综合考虑,选择48 h作为固态发酵的最佳发酵时长。
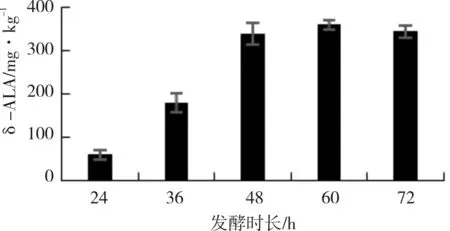
图5 不同发酵时长对发酵饲料中δ-ALA的影响
2.4 分光光度法测定δ-ALA
用分光光度法分别测定酿酒酵母培养物、PRS-416酿酒酵母菌体、高活性干酵母、饲料用酵母水解物中的δ-ALA含量,结果见表2。

表2 分光光度法测定样品结果
2.5 高效液相柱前衍生法测定δ-ALA
用高效液相柱前衍生法分别测定酿酒酵母培养物、PRS-416酿酒酵母菌体、高活性干酵母、饲料用酵母水解物中的δ-ALA含量,结果见图6和表3。

图6 4种样品的液相色谱图

表3 高效液相柱前衍生法测定样品结果
由图6可知,标准品和样品的出峰时间均在5.5 min。与分光光度法测定结果相比,1、2、3号样品测定结果比较相近,样品4用2种方法测定的结果相差较大。因此,继续将这4种样品用液相色谱-质谱法进行定性测定。
2.6 液相色谱-质谱法测定δ-ALA
用液相色谱-质谱法分别测定酿酒酵母培养物、PRS-416酿酒酵母菌体、高活性干酵母、饲料用酵母水解物中的δ-ALA含量,结果见图7。
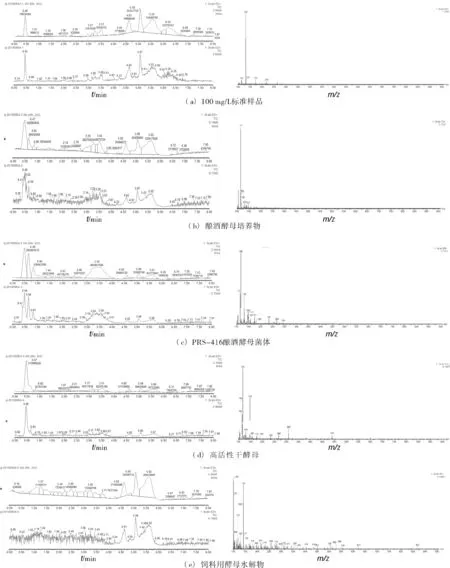
图7 4种样品的液相色谱-质谱图
由图7可知,(a)中标准溶液δ-ALA的出峰时间在0.45 min,分子量为132的信号最强,而标准溶液附近的115、133、173以及219等分子量的信号,推测是δ-ALA电离时产生的碎片。这和Drugbank中介绍δ-ALA时的液相色谱图(Drugbank ID:DB00855)结果一致。(b)、(c)中1、2号样品δ-ALA的出峰时间都在0.49 min,1号样品的132分子量的信号稍弱,但也能显示出该样品中含有δ-ALA,2号样品中132分子量的信号比较强,1号和2号样品液相色谱-质谱法的测定结果和前两种方法的结果也比较吻合;(d)中3号样品虽然在0.46 min出峰,但找不到132分子量的信号;(e)中4号样品δ-ALA没有出峰,在0.45~0.5 min时出现的是杂乱无章的峰,也找不到132分子量的信号。
3 讨论
3.1 固态发酵条件优化
对发酵底物优化时,发现玉米∶玉米蛋白粉∶豆粕∶大米粉比例为4∶1∶0∶0组效果更佳,可能是酵母更易利用玉米中的碳源及玉米蛋白粉的氮源供其自身生长及发酵。
固态发酵培养基中酵母浸粉和胰蛋白胨为酵母发酵补充有机氮源,并提供酵母生长所需的各种维生素、氨基酸和生长因子等,但添加量高反而降低δ-ALA合成,可能是由于发酵底物中玉米蛋白粉中的氮源足够其有效利用,额外增加有机氮源反而会抑制其自身的生长发酵。
培养基添加葡萄糖为酵母发酵补充碳源,不过葡萄糖添加量由0.25%增加到1.00%,没有显著性差异,甚至个别组增加葡萄糖添加量会降低δ-ALA含量,可能是发酵底物提供的碳源足够满足酵母生长发酵。
酵母合成δ-ALA的代谢途径是C4途径,δ-ALA合成的前体物质包括丁二酸和甘氨酸,所以在固态发酵当中适当添加这2种物质的量,可以提高产品中δ-ALA的产量。但随着前体物质增加,会反馈性抑制δ-ALA合成酶的活性,进而使δ-ALA的产量不再增加。故选取0.5%和0.5%作为丁二酸和甘氨酸添加的最佳比例。
3.2 酵母代谢产物的检测方法
自2007年农业部公告2038号将酿酒酵母培养物从《饲料添加剂品种目录》转入《饲料原料目录》以来,酵母培养物类产品与日俱增。笔者于2019年对市场上各种价格区间的酿酒酵母培养物产品测试发现,质量参差不齐[13],生物饲料产业技术创新战略联盟也因此于2018-09-07发布了《饲料原料 酿酒酵母培养物》团体标准,对重金属、霉菌毒素、有害菌等均作出推荐标准[14]。但对于酿酒酵母代谢产物的种类和含量仍无法作出统一的评价标准。本研究采用液相色谱-质谱法对酿酒酵母培养物进行测定,发现其中确含有酿酒酵母的代谢产物——δ-ALA,且可用分光光度法、液相色谱法等常规方法定量检测。虽然该代谢产物具有特异性(从其他酵母类产品的检测结果可看出),但对于酵母类产品的检测还是有一定的意义。如各生产商可以根据自身特点,找到一种特征代谢产物并提供其定量检测方法,对于包括酿酒酵母培养物在内的酵母类产品的质量评价有很大意义,对于客户选择、使用产品也有很大帮助。
目前针对δ-ALA检测方法有很多种,比如高效液相法、基于气液色谱的电子捕获检测方法,以及电泳耦合紫外检测法都有人尝试过,但是这些仪器在大多数实验室当中并不常用。目前,最常用的定量方法是分光光度法。本研究针对酿酒酵母培养物、酿酒酵母菌体、高活性干酵母、饲料用酵母水解物采用分光光度法和高效液相柱前衍生法进行测定,并用液相色谱-质谱法进行定性。结果发现,前2种方法测定的结果存在一定的差异。这4种样品用分光光度法和高效液相柱前衍生法测定的误差分别在45%、21%、3%和80%。且3、4号样品用液相色谱-质谱法进行定性从质谱图中发现,二者无法找到δ-ALA 132 分子量的信号,说明样品中也可能含有与δ-ALA结构类似的物质导致测定分光光度法结果产生假阳性。
分光光度法测定δ-ALA的原理是利用该过程依赖于5-氨基乙酰丙酸与乙酰乙酸乙酯缩合成吡咯化合物,该化合物用乙酸乙酯提取,后续与对二甲氨基苯甲醛作用生成红色化合物,在554 nm波长下比色测定[11]。虽然可以快速地检测出δ-ALA含量,但是产生的衍生物极不稳定,反应过后需要立即测定,否则会影响结果的准确性,另外该方法的缺点就是专一性不强,因为试剂很容易和其他化合物进行反应,比如吡咯、氨基酮类和吲哚衍生物会干扰衍生反应而造成结果假阳性[15]。所以,利用分光光度法测定δ-ALA含量,会存在一定的偏差,需要与高效液相柱前衍生法进行结合测定,并利用液相-质谱法对其进行定性,才能保证结果的准确性。但是在实验室条件有限的情况下,分光光度法因其测定成本低,操作简便,可以作为参考。
