固定化Pseudomonas citronellae SJTE-3菌剂对水中炔雌醇的去除作用
2020-09-02王雁秋彭万里梁如冰
王雁秋,彭万里,梁如冰
(上海交通大学生命科学技术学院,微生物代谢国家重点实验室,上海200240)
环境雌激素污染作为一个新兴的全球性环境问题,严重威胁着人类社会与生物圈的生存与繁衍。如何有效治理环境雌激素污染物和高效修复受污染环境已成为多个领域研究者关注的重点与热点问题[1-3]。雌激素物质是环境雌激素污染物中最重要的一类,可在极低浓度下(1.0 ng·L-1)对生物体产生明显的影响,致畸致癌作用严重,还可诱发雄性个体雌性化,引发女性肿瘤、癌症、男性不育和儿童性早熟等多种问题。因此,世界卫生组织已将雌激素列为一类致癌物和重要环境污染物[4-5]。雌激素类物质是一种类固醇衍生物,含有“6-6-6-5”四环碳骨架结构,包括天然内源性雌激素和人工合成的雌激素[6]。内源性雌激素主要是生物体内天然存在的雌激素,包括雌二醇(E2)、雌三醇(E3)和雌酮(E1)等。而人工合成雌激素大多作为药物使用,如口服避孕药的主要成分炔雌醇(17α-乙炔基雌二醇,17α-ethynylestradiol,EE2)。EE2 可用于治疗月经紊乱、绝经后体内雌激素的补充等;养殖业中加入的同化激素添加剂,可提高家畜的产量质量、控制动物性分化等。由于EE2结构中包含一个乙炔基(E2),相较于天然雌激素,其化学结构更稳定,雌激素效应更强,也更难被降解,环境积累严重。EE2 等雌激素物质可主要通过污水排放系统进入环境,会在污水中大量累积。对上海市3 个典型畜禽养殖场周边河流上下游地表水的检测发现,水体中均存在EE2 污染,EE2 检出率为99.44%,最高测出浓度可达19.42 ng·L-1[7]。在北京污水处理厂的出水中检出的EE2 浓度为39.8 ng·L-1,高于其他国家污水处理厂的检出浓度[8]。因此,早在2009 年,EE2已被认为是在中国城市污水处理厂应当优先控制的4 种污染物之一[9]。近年来,由于生产生活方式的变化,避孕药与激素添加剂等雌激素类药物的使用越来越广泛,其环境污染问题也日益严重,有关EE2 污染的有效治理也越来越被重视[10]。
目前,环境中雌激素污染物的有效去除方法是微生物降解法。相比于物理与化学方法,微生物降解法具有操作简单、成本低廉且无二次污染等优势[11-12]。已报道的雌激素降解菌株有近百株,包括红球菌(Rhodococcus)[13-14]、鞘氨醇单胞菌(Sphingomonas)[13]、欧洲亚硝化单胞菌(Nitrosomonas europaea)[15-16]、不动杆 菌(Acinetobacter)[12,17]和假单胞菌(Pseudomonas)[18-20]等。这些菌株对天然雌激素如E2 的降解效能较高,但大多不能代谢EE2。现仅发现鞘氨醇单胞菌、欧洲亚硝化单胞菌和假单胞菌可降解EE2。其中能同时降解天然雌激素与EE2 的菌株仍很少[12,14,18,21-22]。本实验室前期分离了一株可同时降解E2 和EE2 的香茅醇假单胞菌(Pseudomonas citronellolis)SJTE-3,生长速度快,降解效能高,24 h 内对10 mg·L-1E2 与10 mg·L-1EE2 的降解率达到100%与55.8%,具有很好的修复应用前景[18]。
但是,由于实际环境条件苛刻且成分复杂,游离降解菌的存活与生长会受到影响,可能难以与土著微生物竞争,最终导致降解菌株的降解效能下降,修复应用受限。研究表明,固定化菌剂具有易于回收、稳定性强、生物量高、菌种优势明显等优点,可弥补游离菌株应用的不足[22-23]。固定化菌剂现已应用于修复污水中氨氮[24-26]、磷酸盐[26]、间甲酚[22]、雌二醇和己烯雌酚[27]、苯酚[28]、2-羟基-1,4-萘醌[29]污染及土壤中的多环芳烃[30]污染等,处理效果较游离态菌剂好。现有固定化对象一般为整体细胞或关键酶,但固定化酶存在长期稳定性差与难回收再循环的问题,操作成本较高[31]。因此,固定化细胞方式在环境修复中应用更广泛。
利用高聚物形成凝胶将微生物包埋于其内部的方法,是目前常用的菌剂固定化方法,所用包埋剂有琼脂、丙烯酰胺、海藻酸钠、明胶、几丁质、聚乙烯醇(PVA)等。其中,海藻酸钙法与聚乙烯醇-海藻酸钙(PVA-SA)法都具有良好的生物可降解性、化学稳定性与传质性能[21,23,29]。但PVA-SA 固定化方法较海藻酸钙法传质性能较弱,结构易松散。近年来,研究者尝试应用固定化菌剂来去除环境雌激素物质。李欣等[27]采用海藻酸钙法固定降解菌株,可基本全部去除污水中的雌二醇和己烯雌酚;而以聚氨酯水凝胶为载体包埋硝化菌颗粒,对模拟污水中雌二醇的去除率可达94.4%[32];采用海藻酸钙法固定己烯雌酚降解沙雷氏菌,实验室条件下其对己烯雌酚去除率为83.1%[33]。本研究拟采用海藻酸钙法,对实验室已分离的雌激素高效降解菌株香茅醇假单胞菌SJTE-3进行固定,明确其有效固定化条件,制备高性能固定化菌剂,并确定固定化菌剂对环境中炔雌醇的降解效能,可为环境雌激素污染的修复应用奠定基础。
1 材料与方法
1.1 试验菌株
雌激素降解菌株香茅醇假单胞菌(P.citronellolis)SJTE-3 为本实验室分离,保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏编号为CGMCC No.12720)。
1.2 培养基与化学试剂
17α-乙炔基雌二醇(分子式:C20H24O2,分子量:296.41,纯度≥98%)购自西格玛奥德里奇(上海)贸易有限公司;无水氯化钙(分析纯)、海藻酸钠(化学纯)购自上海国药集团化学试剂有限公司;乙腈(分析纯)与乙酸乙酯(分析纯)等均购自上海阿拉丁生化科技股份有限公司。LB 培养液、Tris-HCl 缓冲液(pH=6.8)等培养基与试剂的配制参照《分子克隆实验指南》(第四版)。17α-乙炔基雌二醇母液为DMSO溶解后配制的1 mg·mL-1母液,0.22µm滤膜过滤除菌后备用。模拟污水:收集土壤100 g(土壤取自上海交通大学闵行校区草地)悬浮于100 mL 蒸馏水,取土壤浸出液,加入终浓度为10µg·mL-1的EE2模拟雌激素污染的污水。
1.3 固定化菌剂制备
以海藻酸钠质量分数、氯化钙质量分数和菌液量作为试验因素,采用正交试验法,设计3因素3水平正交表L9(3)3;以EE2 去除率为指标,各因子水平取值见表1[27,31]。将菌株SJTE-3 接种于LB 培养基,37 ℃振荡培养至OD600=0.5,收菌洗涤后用无菌生理盐水调节OD600为10.0备用。配制好各质量分数的海藻酸钠溶液灭菌,冷却至室温后,将菌悬液加入100 mL 不同浓度的海藻酸钠溶胶中;充分搅拌混匀后,用注射器吸取并匀速滴入到匀速搅拌的不同质量分数的氯化钙溶液中造粒,速度1~2 粒·s-1。造粒完毕后,固定化小球继续在上述氯化钙溶液中于4 ℃中固定4 h。最后,对小球进行灭菌生理盐水洗涤、过滤、滤干后,即获得固定化菌剂,4 ℃储存备用。
1.4 固定化菌剂的基本性质测定
平均直径测定:取不同试验因素水平的固定化菌剂微球样品10 个,用游标卡尺测量总直径后,取平均值即为微球平均直径。
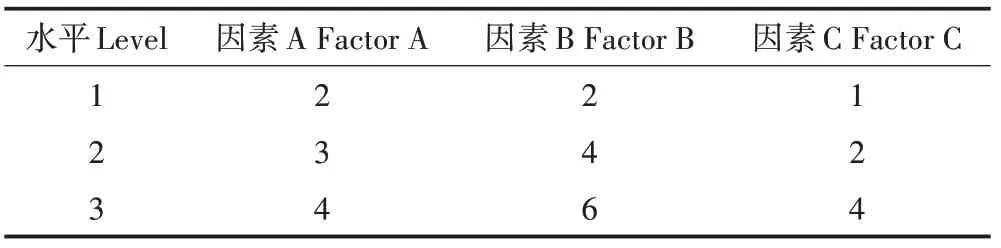
表1 正交试验因素水平Table 1 The levels of orthogonal experimental factors
强度测定:取不同试验因素水平的固定化菌剂微球样品4 g,于10 mL 小管中微微压实,记此时刻度为0。继续缓慢挤压固定化菌剂微球直至微球出现破裂,此时压缩距离(mm)记为固定化菌剂微球的大致强度。
1.5 固定化菌剂表面形态的扫描电镜观察
将固定化小球用无菌生理盐水清洗3 次后,用0.5%戊二醛在4 ℃固定30 min。无菌生理盐水清洗2次后,用2.5%戊二醛在4 ℃固定2 h。利用50%、70%、100%乙醇清洗2 遍后,用100µL 的无水乙醇将其悬浮。采用临界干燥法将样品干燥、喷金后在扫描电镜下观察。
1.6 固定化菌剂去除培养基中EE2的效能检测
在200 mL Tris-HCl 缓冲液基中加入初始浓度为10µg·mL-1的EE2,按照每100 mL 加入10 g菌剂的浓度加入20 g 固定化菌剂,于37 ℃、180 r·min-1摇床培养5 d。每日取样2 mL 测定溶液中残留EE2 浓度,计算EE2 的去除率。以不含菌的空白小球作为阴性对照,接入等量菌液的游离态菌剂作为阳性对照。向2 mL 取样溶液中加入20 µL 的1 mol·L-1盐酸酸化后,加入1 mL 乙酸乙酯后振荡萃取15 s,重复萃取3 次。收集有机相后于氮吹仪中吹干,复溶于200µL 乙腈。利用安捷伦荧光高效液相色谱(High performance liquid chromatography-fluorescence detector,HPLC/FLD,Agilent 1260,USA)进行检测。检测条件为:SB-C18柱(150 mm×4.6µm,5µm,Agilent,USA),流动相为乙腈∶水=55%∶45%,流速为1 mL·min-1,柱温30 ℃。激发光为280 nm,发射光为315 nm。以不同浓度的EE2标品做标准曲线,根据标准曲线计算EE2 的残留量。EE2 的去除率计算如下:EE2 去除率=(EE2 初始量-EE2残留量)/EE2初始量×100%。
1.7 固定化菌剂去除模拟污水中EE2的效能检测
在200 mL 不同浓度的模拟污水(5、10、15、30、50µg·mL-1)中,按照每100 mL 加入10 g 菌剂的浓度加入20 g 固定化菌剂,于37 ℃、180 r·min-1摇床培养5 d。每日取样2 mL 测定溶液中残留EE2 浓度,计算EE2的去除率。以不含菌的空白小球作为阴性对照,接入等量菌液的游离态菌剂作为阳性对照。利用HPLC/FLD 法检测EE2 的存留量,计算其去除率,方法同1.6。
1.8 固定化菌剂的重复使用性检测
当固定化菌剂在含10 µg·mL-1EE2 的Tris-HCl缓冲液中培养1 d后,取出固定化菌剂,用无菌生理盐水洗涤,再加入到新的含10µg·mL-1EE2 的Tris-HCl缓冲液中,进行重复利用,重复10 次。每次均观察固定化菌剂的形态,如1.5 所示;同时,测定溶液中EE2的去除效率,检测方法同1.6。
2 结果与讨论
2.1 海藻酸钙法制备固定化菌剂的最佳条件
以海藻酸钠质量分数、氯化钙质量分数和菌液量作为试验因素的3 因素3 水平正交试验结果显示,当3 因素分别都在水平2 时,EE2 的去除率最高(表2)。因此,海藻酸钙法制备固定化菌剂的最佳条件为:A2B2C2,即3%海藻酸钠溶液、4% CaCl2溶液、2 mL 的OD600为10.0的菌液量。
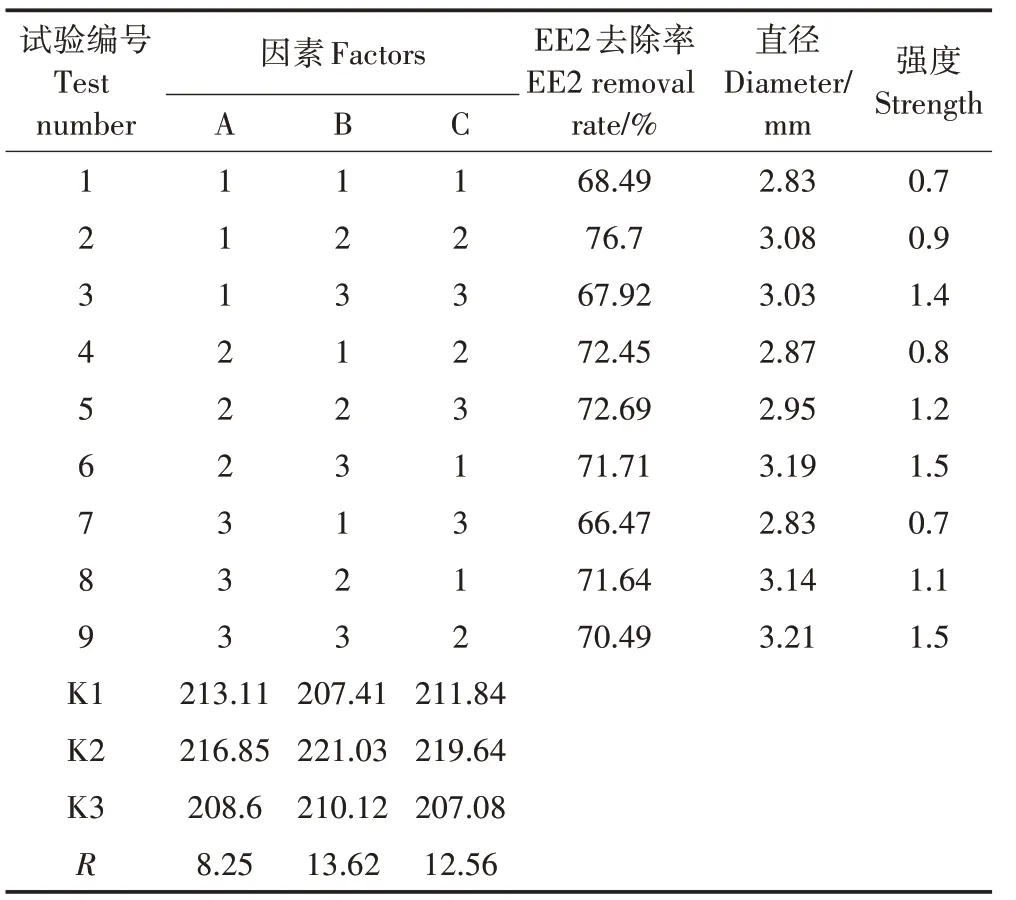
表2 固定化菌剂去除EE2的正交试验结果Table 2 The orthogonal experiment results of the EE2 removal efficiency by the immobilized bacteria agents
2.2 最佳条件制备的固定化菌剂的形态
利用最佳条件制备获得固定化菌剂后,利用扫描电镜观察新制的固定化菌剂形态和培养5 d后的表面形态。结果显示,最佳制备条件下获得的固定化菌剂平均直径约为2.92 mm,外形圆润无拖尾(图1)。新制固定化菌剂的表面平整较规则,培养5 d后,菌剂表面会出现鼓泡与少量破损(图2)。
2.3 固定化菌剂对培养基中EE2的去除效果

图1 最佳制备条件下获得的固定化菌剂形态图Figure 1 The immobilized bacterial agents under the optimal preparation condition

图2 培养前后固定化菌剂表面形态的扫描电镜图Figure 2 Scanning electron microscope(SEM)images of the surface of the immobilized bacterial agents before and after 5-day cultivation
利用HPLC-FLD方法检测了固定化菌剂、游离态菌剂和空白小球对培养基中10 µg·mL-1的EE2 的去除效果。结果显示,24 h 后,固定化菌剂基本达到最大去除率,游离态菌剂在48 h也可达到EE2的去除稳态。5 d 后,固定化菌剂、空白小球、游离态菌剂对培养基中的EE2 的终末去除率分别为78.8%、34.1%和55.8%(图3)。由此可见,菌株SJTE-3 去除EE2 的时间短,固定化菌剂对EE2 的去除率显著高于游离态菌剂。

图3 固定化菌剂与游离态菌剂对培养基中EE2的去除效率Figure 3 The removal efficiency of EE2 in medium by the immobilized bacteria agent and the free state bacteria
2.4 固定化菌剂对模拟污水中EE2的去除效果
利用HPLC-FLD方法检测了固定化菌剂、空白小球、游离态菌剂对模拟污水中不同浓度(5、10、15、30、50µg·mL-1)EE2的去除效果。结果显示,固定化菌剂在含不同EE2浓度的模拟污水中,其EE2的去除率均可达到78%;对高浓度EE2(50µg·mL-1)的去除仍保持稳定(图4)。游离态菌剂在模拟污水中对EE2 的去除率约为48%,相较于培养基中55.8%的去除率稍有下降;对高浓度的EE2(50 µg·mL-1)的去除率较低。同样,空白小球对EE2去除率也会随EE2浓度升高而略微降低(图4)。由此可见,固定化菌剂可提高菌株SJTE-3 的环境适应性,保持稳定高效的EE2 降解效能。
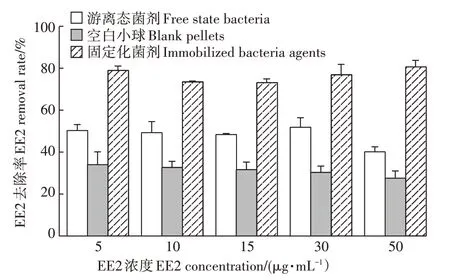
图4 固定化菌剂与游离态菌剂对模拟污水中不同浓度EE2的去除效率Figure 4 The removal efficiency of EE2 of different concentrations in the simulated wastewater by the immobilized bacteria agent and the free state bacteria
2.5 固定化菌剂的重复使用效果
固定化菌剂的可重复使用次数对实际应用十分重要。对固定化菌剂的重复使用测定结果显示,随着重复使用次数增加,固定化菌剂对溶液中EE2的去除率逐渐下降;重复使用10 次后,其对溶液中EE2 的去除率由最初的78%下降至53%(图5)。重复使用4次后,固定化菌剂结构开始松散,溶液开始浑浊,但90%以上菌剂仍可保持完整球形结构,且仍有68%以上的EE2去除率。随后,固定化菌剂的破损程度逐渐增大,至第10次重复使用结束,约80%的固定化菌剂出现较大破损,对EE2 的去除率降至53%,与游离态菌剂对EE2 的去除率大致相当(图5)。由此可见,该固定化菌剂的结构与降解效能稳定,可重复使用多次。
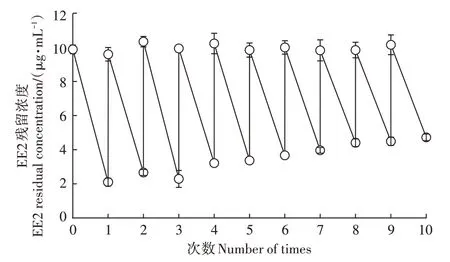
图5 固定化菌剂重复使用的降解效能Figure 5 The EE2 removal efficiency of the re-used immobilized bacteria agent
3 讨论
炔雌醇结构稳定,使用广泛,常规方法难以将其有效去除,引发环境蓄积,导致严重的环境污染。目前有关EE2有效去除的研究仍较少,主要有物理吸附法、光降解法、化学氧化法和微生物降解法,其中微生物降解是去除EE2的有效方法。但是,这些方法仍不能高效去除EE2 或仍有较高的EE2 残留,如72 h 内,溶解性有机质介导的光降解法对EE2 的去除仅能达到约10%[34]。因此,如何高效简便地去除EE2,消除其环境污染,是目前研究的热点问题。本研究利用海藻酸钙法,制备了雌激素降解菌株SJTE-3 的固定化菌剂,其对水溶液中10µg·mL-1EE2去除率可达78.8%,其EE2去除效能和稳定性均高于游离态菌剂,且性质稳定,可重复使用,具有较好的应用前景。
本研究中固定化菌剂的EE2 去除率显著高于游离态菌剂,可能是由于固定化菌剂同时具备了物理吸附与生物降解的双重作用,从而提高了EE2的整体去除效率[21,26]。海藻酸钙固定化小球内部为交联结构,雌激素污染物可自由通过这些孔径,从外部环境中进入到球体内部。在一定程度上,固定化小球可将溶液中的雌激素富集在球体内部的菌体周围,增加菌体与雌激素的接触效率。在物理吸附去除的基础上,固定化小球中的降解菌通过生物降解作用,对雌激素进行转化和利用,从而进一步降低雌激素浓度,最终实现较高的去除效率。由于物理吸附作用,空白小球也具有一定的EE2去除效率。根据试验结果,固定化菌剂对EE2 的去除率为空白小球的2.3 倍以上,说明固定化菌剂对EE2的去除依然是以微生物降解作用为主,物理吸附作用为辅。但是,固定化菌剂的去除效率低于空白小球与游离态菌剂的去除率之和,未达到1+1≥2 的效果。可能的原因有:(1)在制备海藻酸钙小球过程中,海藻酸钠溶液与氯化钙溶液中没有菌体所需的营养,细菌处于饥饿状态,可能会影响细菌活性或导致部分菌体死亡;(2)随培养时间增加,菌体在固定化小球球体内部增殖,可能会堵塞球体内部孔径,影响整个固定化小球的传质性能[22,28];同时,位于球体内部的菌体,可能也因生长空间受到挤压,从而影响整体的去除效率。
在模拟污水中,固定化菌剂对不同浓度EE2去除效率均显著高于游离态菌剂,说明其可适当隔绝污水的复杂环境,使菌株可以正常生长与有效降解,维持复杂环境中EE2 去除的稳定性。但污水中存在的磷酸盐会与固定化菌剂反应生成少量磷酸钙沉淀,破坏固定化菌剂的结构,造成其机械强度下降易松散,导致一定程度的去除率波动。尽管如此,该固定化菌剂在多次重复使用后,仍可保持较高的EE2 去除率,显示了其较好的实际应用前景。
然而,本研究中的固定化菌剂仍存在一定缺陷。如海藻酸钙吸附能力与固定化菌剂包菌量等会影响固定化菌剂的效果。本研究中,空白海藻酸钙小球对EE2 吸附率为34.1%,为进一步增强固定化菌剂去除效率,可尝试加入高吸附性能的吸附剂。钱林波等[35]发现高吸附性能材料可促进污染物由土壤有机质向固定化载体迁移,实现污染物的富集-降解一体化。Chen等[36]采用吸附包埋法,以植物残体和生物碳为吸附载体材料,海藻酸钠包埋固定化多环芳烃降解菌株,对多环芳烃的去除比不添加吸附材料的海藻酸钠固定化多环芳烃降解菌株增加了6%~29%。此外,本研究中的固定化菌剂的包菌量尚未进行最优化试验,最适宜的包菌量尚需进一步研究。研究发现,当包菌量增加时,由于菌体对氧气和营养物的需求增多、氧气扩散速率减慢、细胞生长空间减小等问题,阻碍了细胞增殖,反而会导致固定化菌剂对污染物的去除率不增反降[37-38]。因此,本文中开发的固定化菌剂的吸附效能提升与包菌量等仍需进一步优化。
综上所述,本文利用海藻酸钙法固定化雌激素降解菌株SJTE-3 制备的固定化菌剂,可高效去除不同水体中的炔雌醇,具有结构稳定、去除效果好、可多次重复应用、处理效果优于游离态菌剂等优点,具有实际应用的潜能。本研究可为高效无害的环境雌激素污染处理研究奠定基础,推进实际应用进程。
4 结论
(1)明确了海藻酸钙法固定化菌株香茅醇假单胞菌SJTE-3 的最佳方案:3%海藻酸钠溶液、4% CaCl2溶液、2 mL的OD600为10.0的菌液量。
(2)该固定化菌剂在37 ℃对培养基中炔雌醇(10µg·mL-1)的去除率可达到78.8%,较游离态菌剂去除效率提高23.0%。在模拟污水条件下,固定化菌剂对不同浓度的EE2(5~50 µg·mL-1)均可达到约78%的去除率,显著高于游离态菌剂。
(3)该固定化菌剂降解效能与球体结构稳定,重复使用10 次后,其炔雌醇去除率仍可达53%,具有较强的重复利用性。
