木薯种茎劣变的蛋白质组学分析
2020-08-28刘子凡陈晨黄洁魏云霞廖道龙
刘子凡,陈晨,黄洁,魏云霞,廖道龙
木薯种茎劣变的蛋白质组学分析
刘子凡1,陈晨1,黄洁2,3*,魏云霞2,3,廖道龙4
(1.海南大学热带作物学院,海南 海口 570228;2.中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737;3.农业农村部木薯种质资源保护与利用重点实验室,海南 儋州 571737;4.海南省农业科学院蔬菜研究所,海南 海口 571100)
以华南8号(SC8)和南植199(NZ199)种茎为试验材料,分析其在老化0、2、4、6 d的蛋白质表达差异。与老化0 d的种茎相比,老化2、4、6 d的种茎,SC8的差异表达蛋白质总数分别为38、64和68个,上调表达的差异蛋白质数分别为11、18和25个,下调表达的差异蛋白质数分别为27、46和43个;NZ199的差异表达蛋白质总数分别为55、63和84个,上调表达的差异蛋白质数分别为17、23和43个,下调表达的差异蛋白质数分别为38、40和41个。与老化0、2、4 d凝胶相比,老化6 d种茎的凝胶中,SC8、NZ199分别检测到19、36个共有差异蛋白质点,且分别有17、30个被成功匹配;2个品种种茎差异蛋白点功能基本相似,主要涉及分子伴侣、碳水化合物和能量代谢、转移、防御、解毒和抗氧化等相关蛋白质。在成功匹配的差异蛋白质中,D–3–磷酸甘油脱氢酶、磷酸甘油酸激酶、类壳三糖苷酶–1蛋白、苹果酸酶、拟定肉桂醇脱氢酸、1–脱氧–D–木酮糖–5–磷酸还原异构酶等差异蛋白质下调表达;拟定谷胱甘肽硫–转移酶parC、类异黄酮还原酶、病程相关蛋白Bet v I家族、热激蛋白、GPN60蛋白、α–淀粉酶、ATP 合成酶β亚基和烯醇化酶等差异蛋白质上调表达。差异表达蛋白质主要参与对氧化应激反应、毒素分解、谷胱甘肽代谢、蛋白质折叠和糖酵解等生物过程,分布于线粒体、叶绿体、溶质、细胞质、细胞壁等位置,主要发挥结合功能、催化活性和氧化还原功能。
木薯;种茎;劣变;蛋白质组学
木薯(Crantz)是世界三大薯类作物之一,主要用于食用及加工淀粉、乙醇等。木薯主要以种茎种植,常因贮藏技术欠佳,导致种茎质量变差。为了提高木薯种茎质量,前人在改良种茎贮藏方法[1–4]和优选种茎处理方法[5–9]上进行了研究,但均需在种茎出苗后或测定产量后方可确定最终效果,所需时间长,期间又因环境因素不稳定,导致重复性差。生产上,有通过观察种茎老熟程度或种茎切口乳汁多少来判断种茎质量的方法,但经验性和主观性成分大,容易误判。
蛋白质是生命现象最直接的体现者,蛋白质的种类、数量及存在形式都会在种子老化过程中发生变化[10]。研究人员对不同作物种子劣变的蛋白质组学机制进行了研究[11–13],但对木薯种茎的劣变机制研究尚少。本研究中,通过分析不同老化程度木薯种茎的蛋白质表达差异,旨在为改进种茎贮藏与处理的技术、揭示木薯种茎劣变的分子机理提供依据。
1 材料与方法
1.1 材料的获取与处理
供试木薯品种为华南8号(SC8)和南植199 (NZ199),由中国热带农业科学院热带作物品种资源研究所提供。2017年3月24日,种植于中国热带农业科学院热带作物品种资源研究所六坡基地。株行距均为80 cm。2018年2月25日收获。收获时在离地10 cm处砍断种茎,去除20 cm顶梢及所有叶片,获得种茎材料。
取上述种茎材料进行人工加速老化,设0、2、4、6 d 4个老化时间(分别用A0、A2、A4和A6表示)。3次重复。参照文献[14]的方法进行老化,获得4种不同活力的种茎材料,去除髓部,液氮冷冻后,于粉碎机中粉碎。粉末保存于–80 ℃的冰箱中,备用。
1.2 方法
1.2.1种茎蛋白质的提取与分离
采用苯酚甲醇醋酸铵法提取蛋白质。加800 µL裂解液至蛋白样品中,参照文献[15]的方法配置溶解液,室温下溶解1 h,13 000 r/min离心5 min;分装,每管50 µL,用于蛋白定量和SDS–PAGE。参照文献[16]的方法进行蛋白定量;参照文献[17]的方法进行单向SDS–PAGE凝胶电泳检测和蛋白质双向电泳分离。
1.2.2凝胶图像扫描
用Image Scanner Ⅲ 扫描仪(GE healthcare)扫描脱色后的双向电泳凝胶并保存图像。运用AlphaEaseFC(ChemiImager 4400)进行图片数据转换。
1.2.3差异表达蛋白的选取
运用Delta2D 4.1双向电泳软件,对全蛋白质图谱进行蛋白质点统计和定量分析,以蛋白点归一化体积表示其相对表达丰度,以A0的蛋白质双向电泳图谱作为对照,分别与A2、A4和A6的图谱进行两两比对,找出差异蛋白点,编号。再从A6凝胶中选择与A0、A2、A4凝胶共有的、清晰的差异点。重复3次,进行T检验。差异表达量在2.0倍以上的为差异表达蛋白质点[18],包括老化途中彻底消失或新生成的差异蛋白质点。选取清晰的点,用特制的挖点枪头挖点,重新编号,放入预先灭菌并装有60 µL去离子水的1.5 mL离心管内。
1.2.4差异表达蛋白的鉴定及GO分析
将差异表达蛋白质送至深圳华大基因公司进行检测,检测结果通过Mascot软件,从NCBInr、SwissProt和EST数据库分析其名称、功能、亚细胞定位、登录号等信息;通过Uniprot及TargetP 1.1 Server网站对鉴定的蛋白质进行GO分析,获得差异表达蛋白质的功能分类、生物学过程分析和亚细胞定位的注释。
2 结果与分析
2.1 差异表达蛋白质图谱分析
经pH值4.0~7.0的线性IPG胶条和12%SDS– PAGE凝胶,对A0、A2、A4、A6 种茎蛋白质进行IEF和SDS–PAGE双向分离、考马斯亮蓝G250染色及扫描后,获得的种茎全蛋白质电泳图图谱较清晰,点较多,蛋白分离情况良好,蛋白质点基本为圆形,无明显拖尾现象,说明已成功分离出木薯种茎全蛋白质。
比较木薯种茎差异表达蛋白总数发现,与A0种茎相比,SC8种茎A2、A4、A6的差异表达蛋白质总数分别为38、64和68个,NZ199种茎A2、A4、A6的差异表达蛋白质总数分别为55、63和84个。说明木薯种茎老化程度越高,差异表达蛋白质总数越多。SC8种茎差异表达蛋白质总数呈先快速增加后趋于平缓的变化趋势,而NZ199种茎一直呈快速增加的变化趋势。
比较木薯种茎上调、下调表达蛋白质,发现与A0种茎相比,SC8种茎A2、A4、A6的上调表达蛋白质数分别为11、18和25个,NZ199种茎A2、A4、A6的上调表达蛋白质分别为17、23和43个;SC8种茎A2、A4、A6的下调表达蛋白质分别为27、46和43个,NZ199种茎A2、A4、A6的下调表达蛋白分别为38、40和41个。总体上看,种茎下调表达蛋白质数高于上调表达蛋白质数,这与种茎老化程度加深以及蛋白质的合成、修饰、分泌受到影响有关。与A0相比,NZ199种茎A6的下调表达差异蛋白质数小于上调表达差异蛋白质数,这可能与NZ199种茎的抗老化能力较强有关。
2.2 差异表达蛋白质的鉴定
检测A6凝胶中与A0、A2、A4凝胶共有的、清晰的差异蛋白质点,发现SC8种茎和NZ199种茎分别有19、36个差异蛋白质点。将上述差异蛋白质点进行质谱鉴定与分析,分别成功匹配到17、30个差异蛋白质点,具体信息分别见表1和表2。
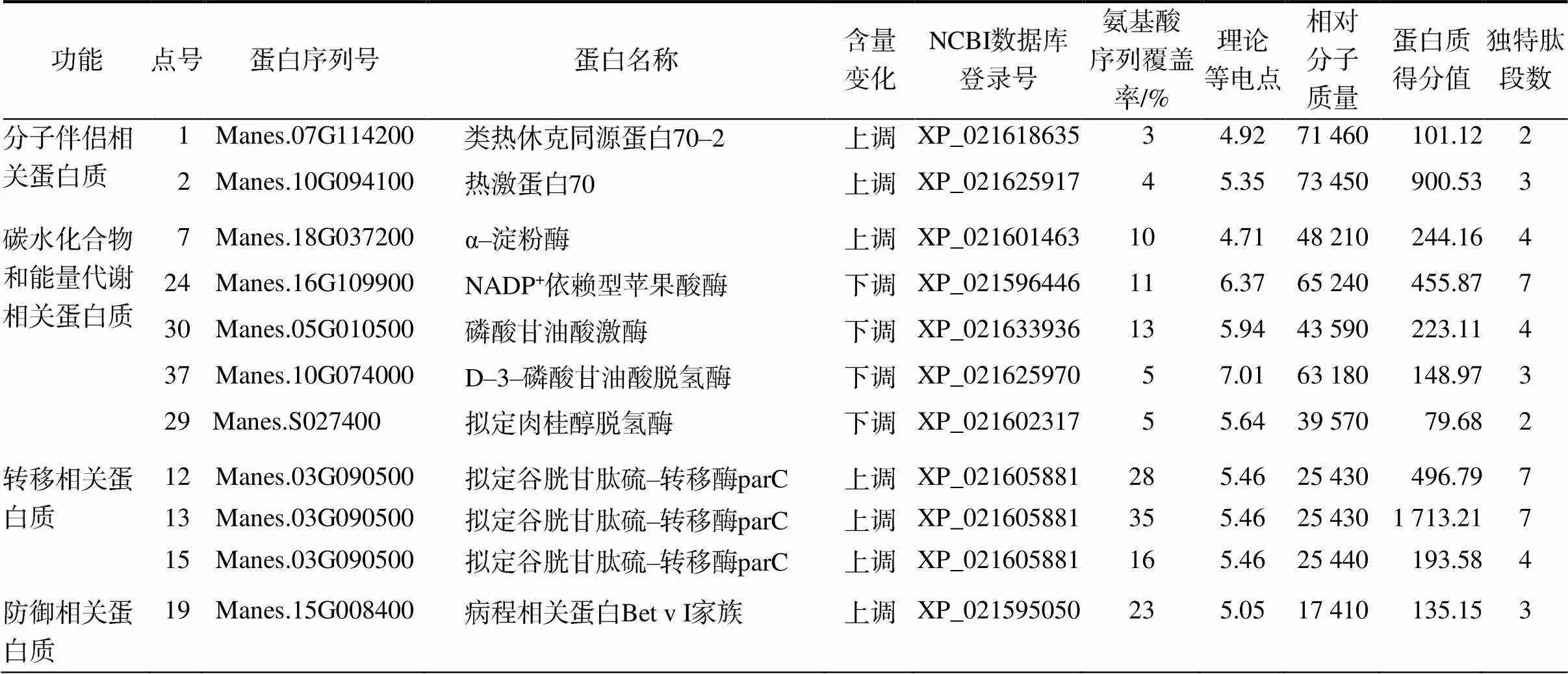
表1 从SC8种茎鉴定的17个差异表达蛋白质的相关信息

表1(续)

表2 从NZ199种茎鉴定出的30个差异表达蛋白质的相关信息
从表1和表2可知,2个品种种茎均存在不同的蛋白质点鉴定为同一蛋白质的情况,例如:SC8种茎中点号为12、13、15的蛋白质点,NZ199种茎中点号为6和9的蛋白质点,这可能是由蛋白质的降解或者甲基化、磷酸化修饰等造成的[19]。另外,2个品种木薯种茎的差异蛋白质点功能也基本相似,均含有分子伴侣、碳水化合物和能量代谢、转移、防御及解毒和抗氧化5类相关蛋白质,且在其功能蛋白质中均存在着许多共同的蛋白。2个品种共同的差异蛋白质相对分子质量值为17 000~55 000,理论等电点为5~7。说明木薯种茎劣变时,主要是这几类小分子质量的弱酸性蛋白质发生了较大变化。
从表1和表2还可以看出,差异蛋白质中碳水化合物和能量代谢相关蛋白质,SC8种茎中,NADP+依赖型苹果酸酶(NADP–ME)、磷酸甘油酸激酶(PGK)、D–3–磷酸甘油酸脱氢酶、拟定肉桂醇脱氢酶下调表达,α–淀粉酶上调表达;NZ199种茎中,苹果酸酶、磷酸甘油酸激酶、拟定甘露醇脱氢酶和类壳三糖苷酶–1蛋白下调表达,烯醇化酶和ATP合成酶β亚基上调表达。差异蛋白质中转移相关蛋白质,SC8种茎中均为拟定谷胱甘肽硫–转移酶parC(GSTs),NZ199种茎中有2个GSTs、1个S–甲酰谷胱甘肽水解酶均上调表达。差异蛋白质中防御相关蛋白质,SC8种茎中均为病程相关蛋白Bet v I家族;NZ199种茎中,2个病程相关蛋白Bet v I家族和1个脱水蛋白均上调表达。差异蛋白质中解毒和抗氧化相关蛋白质,SC8种茎中均为胞浆亚型2 L–抗坏血酸过氧化物酶(APX),且下调表达;NZ199种茎中拟定核氧化还原蛋白1和类异黄酮还原酶上调表达,APX和1–脱氧–D–木酮糖–5–磷酸还原异构酶蛋白(DXR)下调表达。分子伴侣相关蛋白质,SC8种茎中类热休克同源蛋白70–2和热激蛋白70,NZ199种茎中线粒体亚型X2热激蛋白90–6、热休克同源蛋白70、I型类热激蛋白17.3、线粒体型热激蛋白23.6和CPN60蛋白,均上调表达。说明种茎劣变会导致种茎细胞受到损伤,种茎为维持自身活力,会启动应激机制进行自身修复。
2.3 差异表达蛋白质的GO分析
根据UniprotKB(http://www.uniprot.org/uniprot/)网站上每个蛋白质的注释及其参与的生化途径,进行功能分类、生物学过程分析和亚细胞定位。
从图1可以看出,SC8种茎的17个差异蛋白质中,参与结合功能的蛋白质有9个,参与催化活性的蛋白质7个(催化α淀粉酶活性1个、磷酸甘油酸脱氢酶活性1个、放氧活动1个、氧化还原酶活性4个),参与氧化还原的蛋白质7个(过氧化物酶3个、转移酶4个);NZ199种茎的30个差异蛋白质中,参与结合功能的蛋白质19个,参与催化活性的蛋白质7个,参与氧化还原的蛋白质8个(氧化还原酶5个、过氧化物酶3个)。

图1 木薯种茎差异表达蛋白质的GO分子功能分类
从图2可以看出,SC8种茎差异蛋白质中,参与对氧化应激反应过程的占22%,参与毒素分解过程的占22%,参与谷胱甘肽代谢过程的占21%;NZ199种茎差异蛋白质中,参与蛋白质折叠过程的占22%,参与对氧化应激反应过程的占16%,参与糖酵解过程的占16%。说明木薯种茎的劣变是由于结合功能的蛋白质、氧化还原清除活性氧自由基的蛋白质和催化某些酶活性的蛋白质的上调或下调表达所致。

图2 木薯种茎差异表达蛋白质的功能归类分析结果
从图3可以看出,木薯种茎差异蛋白质主要位于线粒体、叶绿体、溶质、细胞质、膜的整体组成部分、细胞壁、胞液和分泌蛋白质上,SC8种茎和NZ199种茎中分别有47%、33%的差异蛋白质分布在其他位置。说明种茎发生老化劣变时,差异蛋白质分布多样化,这有利于各类生理功能的发挥。

图3 木薯种茎差异表达蛋白质的亚细胞定位分析结果
3 结论与讨论
营养缺乏、激素代谢紊乱、高温、菌类感染等多种因素会导致植物细胞内活性氧(ROS)浓度的增加,形成氧化胁迫[20]。对木薯种茎来说,高温胁迫可导致种茎ROS浓度增加,最终导致种茎发生劣变。劣变的种茎细胞内由于ROS积累形成二硫键,导致D–3–磷酸甘油酸脱氢酶的下调表达[21];劣变的种茎防御能力下降,其大分子物质变性,合成酶活性下降,生理活性物质被破坏与失衡。刘兴晖等[22]的研究结果表明,壳三糖苷酶与防御能力呈正相关。苹果酸酶的催化产物能够促进多种抗逆物质的合成;肉桂醇脱氢酶与植物木质素生物合成有关,木质素可阻止各种病原菌的侵入,增强植物环境胁迫的应对能力[23]。D–3–磷酸甘油酸脱氢酶将3–磷酸甘油酸氧化为3–磷酸羟基丙酮酸,形成合成蛋白质所需的丝氨酸、甘氨酸和半胱氨酸;1–脱氧–D–木酮糖–5–磷酸还原异构酶蛋白可能影响赤霉素的合成[24]。说明上述酶下调表达与种茎细胞受到胁迫有关。
种茎发生劣变时,自身修复的应激机制会即刻启动,以维持或恢复种茎活力。自身修复方式主要是抗衰老保护系统和去毒系统。GSTs参与细胞内的毒素分解过程和谷胱甘肽代谢过程,清除有毒化合物[25];类异黄酮还原酶与植物中多种抗毒素的合成密切相关[26];防御相关蛋白质中病程相关蛋白在细胞内参与防御反应,抵御不良环境的影响[27–29];分子伴侣蛋白质中的热激蛋白HSP保护细胞膜和相关蛋白,以防种茎细胞脱水[30];CPN60蛋白与各种配体和细菌作用,参与抑制细胞凋亡[31–32],增强抗胁迫能力。种茎劣变时,种茎细胞上述差异蛋白质的上调表达有助于清除种茎细胞ROS,维持种茎的活力,这与前人的研究结论一致[33]。α–淀粉酶能促进催化淀粉水解成可溶性糖,为有氧呼吸提供原料;ATP合成酶β亚基的活性下降影响细胞内pH值和线粒体膜电位[34];烯醇化酶与呼吸作用密切相关,在细胞能量代谢过程中具有重要作用[35]。α–淀粉酶、ATP合成酶β亚基和烯醇化酶的上调表达为种茎自身修复的运转提供了能量,这也是种茎活力自身修复应激机制的一种表现。本试验中,SC8种茎α–淀粉酶上调表达,与陈晨等[33]的研究结果一致。
NADP–ME上调表达可维持膜的流动性[36];APX的过量表达可提高植物的抗逆能力[37];PGK是糖酵解的关键酶,该酶的缺乏可引起生物体代谢等功能的紊乱;防御相关蛋白质中的脱水蛋白可清除细胞中的ROS,维持细胞膜的稳定性[38]。上述蛋白质上调表达有利于种茎活力的自身修复。本试验中,NADP–ME、APX和PGK均下调表达,这是否与这些蛋白对逆境较敏感有关,有待进一步研究。
[1] 张树河,李海明,李和平,等.不同摆放方式对木薯种茎贮藏效果的影响[J].福建热作科技,2016,41(3):16–18. ZHANG S H,LI H M,LI H P,et al.Effects of different setting patterns on cassava stem storage[J].Fujian Science & Technology of Tropical Crops,2016,41(3):16–18.
[2] 陆灿升.如何选留及贮藏木薯种茎[J].农家之友,2001(12):29. LU C S.How to select and store cassava stem[J].Friends of Farmers,2001(12):29.
[3] 刘斌,申章佑,甘秀芹,等.中国木薯种茎越冬贮藏区域划分及其安全贮藏方法[J].南方农业学报,2013,44(12):1992–1996. LIU B,SHEN Z Y,GAN X Q,et al.Overwintering safe storage methods and region division of seedstem of cassava in China[J].Journal of Southern Agriculture,2013,44(12):1992–1996.
[4] 樊吴静,罗兴录,阮榆.不同贮藏方式对木薯种茎发芽及其相关生理特性影响研究[J].中国农学通报,2012,28(33):65–70. FAN W J,LUO X L,RUAN Y.Effects of different storage methods on germination and physiological indexes of seed-stem of cassava[J].Chinese Agricultural Science Bulletin,2012,28(33):65–70.
[5] 陆小静,刘子凡,柳红娟,等.含钙药剂浸种对木薯产量和品质的影响[J].湖南农业大学学报(自然科学版),2014,40(4):349–352. LU X J,LIU Z F,LIU H J,et al.Effect of seedling soaking by some sorts of medicaments upon the yield and quality of cassava[J].Journal of Hunan Agricultural University(Natural Sciences),2014,40(4):349–352.
[6] 李天,魏云霞,黄洁,等.石灰种茎处理对木薯萌发和幼苗生长的影响[J].江西农业学报,2018,30(5):1–6. LI T,WEI Y X,HUANG J,et al.Effects of treating seed stem with lime on seed stem germination and seedling growth of cassava[J].Acta Agriculturae Jiangxi,2018,30(5):1–6.
[7] 罗兴录.云大–120浸种对木薯的增产效应[J].西南农业学报,2001,14(1):87–90. LUO X L.Studies on the effects of increasing cassava yield by soaking the seed-stems with homobrassino-lide[J]. Southwest China Journal of Agricultural Sciences,2001,14(1):87–90.
[8] 刘海刚,黄洁,罗会英,等.种茎覆膜、浸水和蜡封对木薯抗旱性的影响[J].热带作物学报,2014,35(4):668–672. LIU H G,HUANG J,LUO H Y,et al.The drought resistance effect of mulching film,soaking water and sealing wax for cassava cutting[J].Chinese Journal of Tropical Crops,2014,35(4):668–672.
[9] 苏必孟,刘子凡,黄洁,等.基于主成分分析的木薯抗旱栽培措施的综合评价[J].热带作物学报,2017,38(2):189–193. SU B M,LIU Z F,HUANG J,et al.Assessment on drought resistance cultivation of cassava based on principal component analysis[J].Chinese Journal of Tropical Crops,2017,38(2):189–193.
[10] KONG L Q,HUO H Q,MAO P S.Antioxidant response and related gene expression in aged oat seed[J].Frontiers in Plant Science,2015,6:158.
[11] 王志军,叶春秀,李有忠,等.棉花种子活力劣变的差异蛋白质组学研究[J].西北植物学报,2017,37(11):2204–2213. WANG Z J,YE C X,LI Y Z,et al.Differential proteomics analysis of seed deterioration in cotton[J]. Acta Botanica Boreali-Occidentalia Sinica,2017,37(11):2204–2213.
[12] 宋利茹,王爽,牛娟,等.春大豆种子田间劣变性和劣变抗性的差异蛋白质组学研究[J].中国农业科学,2015,48(1):23–32. SONG L R,WANG S,NIU J,et al.Differentially proteomics analysis of pre-harvest seed deterioration and deterioration resistance in spring soybean[J].Scientia Agricultura Sinica,2015,48(1):23–32.
[13] 孔令琪.不同老化处理对燕麦种子生理、蛋白质及抗氧化基因的影响[D].北京:中国农业大学,2015. KONG L Q.Physiological changes,protein and related antioxidant gene expression responses ofL. seed under different aging treatment[D].Beijing:China Agricultural University,2015.
[14] 陈晨,黄洁,刘子凡,等.木薯种茎活力的生理生化鉴评指标研究[J].生态科学,2019,38(3):125–132. CHEN C,HUANG J,LIU Z F,et al.Study on physiological and biochemical evaluation indices of cassava(Crantz) stem vigor[J]. Ecological Science,2019,38(3):125–132.
[15] 林杨杰,赵明,杨生超,等.大豆种子蛋白质组样品制备方法研究[J].大豆科学,2016,35(5):810–817. LIN Y J,ZHAO M,YANG S C,et al.A study on sample preparations for proteomics of soybean seeds[J].Soybean Science,2016,35(5):810–817.
[16] SHAW M M,RIEDERER B M.Sample preparation for two-dimensional gel electrophoresis[J].Proteomics,2003,3(8):1408–1417.
[17] 宋雁超.嫁接影响木薯块根产量变化的蛋白质组学分析[D].海口:海南大学,2017. SONG Y C.The proteomic analysis regarding the effects of grafting on the yield of cassava storage roots[D]. Haikou:Hainan University,2017.
[18] CHEN S B,GLAZER I,GOLLOP N,et al.Proteomic analysis of the entomopathogenic nematodeIS-6 IJs under evaporative and osmotic stresses[J]. Molecular and Biochemical Parasitology,2006,145(2):195–204.
[19] 王莹慧,孙萌萌,汪育文,等.高产杂交水稻两优培九衰老进程中剑叶差异蛋白质组学分析[J].江苏农业学报,2018,34(6):1207–1216.WANG Y H,SUN M M,WANG Y W,et al. Comparative flag leaf proteomic profiling of high-yielding hybrid rice Liangyoupeijiu during senescence[J].Jiangsu Journal of Agricultural Sciences,2018,34(6):1207–1216.
[20] FOYER C H,NOCTOR G.Oxidant and antioxidant signalling in plants:a re-evaluation of the concept of oxidative stress in a physiological context[J].Plant,Cell & Environment,2005,28(8):1056–1071.
[21] 王三根,宗学凤.植物抗性生物学[M].重庆:西南师范大学出版社,2015. WANG S G,ZONG X F.Plant resistance biology[M]. Chongqing:Southwest China Normal University Press,2015.
[22] 刘兴晖,赵磊,周新.壳三糖苷酶研究进展[J].医学综述,2006,12(11):700–701. LIU X H,ZHAO L,ZHOU X.Progress in research of chitotriosidase[J].Medical Recapitulate,2006,12(11):700–701.
[23] BOERJAN W,RALPH J,BAUCHER M.Lignin biosynthesis[J].Annual Review of Plant Biology,2003,54(1):519–546.
[24] XING S F,MIAO J,LI S,et al.Disruption of the 1-deoxy-D-xylulose-5-phosphate reductoisomerase (DXR) gene results in albino,dwarf and defects in trichome initiation and stomata closure in[J].Cell Research,2010,20(6):688–700.
[25] 张雪,陶磊,乔晟,等.谷胱甘肽转移酶在植物抵抗非生物胁迫方面的角色[J].中国生物工程杂志,2017,37(3):92–98. ZHANG X,TAO L,QIAO S,et al.Roles of glutathione S-transferase in plant tolerance to abiotic stresses[J]. China Biotechnology,2017,37(3):92–98.
[26] BRANDALISE M,SEVERINO F E,MALUF M P,et al. The promoter of a gene encoding an isoflavone reductase-like protein in coffee() drives a stress-responsive expression in leaves[J].Plant Cell Reports,2009,28(11):1699–1708.
[27] VAN LOON L C,REP M,PIETERSE C M J. Significance of inducible defense-related proteins in infected plants[J].Annual Review of Phytopathology,2006,44:135–162.
[28] LIU J J,STURROCK R,EKRAMODDOULLAH A K M.The superfamily of thaumatin-like proteins:its origin,evolution,and expression towards biological function[J]. Plant Cell Reports,2010,29(5):419–436.
[29] JAIN D,KHURANA J P.Role of pathogenesis-related (PR) proteins in plant defense mechanism[J].Molecular Aspects of Plant-Pathogen Interaction,2018:265–281.
[30] GHOSH S,PAL A.Identification of differential proteins of mungbean cotyledons during seed germination:a proteomic approach[J].Acta Physiologiae Plantarum,2012,34(6):2379–2391.
[31] ZANIN-ZHOROV A,BRUCK R,TAL G,et al.Heat shock protein 60 inhibits Th1-mediated hepatitis model via innate regulation of Th1/Th2 transcription factors and cytokines[J].Journal of Immunology,2005,174(6):3227–3236.
[32] ZANIN-ZHOROV A,TAL G,SHIVTIEL S,et al.Heat shock protein 60 activates cytokine-associated negative regulator suppressor of cytokine signaling 3 in T cells:effects on signaling,chemotaxis,and inflammation[J]. Journal of Immunology,2005,175(1):276–285.
[33] 陈晨,刘子凡,黄洁,等.木薯种茎活力的评价指标研究[J].云南农业大学学报(自然科学),2019,34(4):583–589. CHEN C,LIU Z F,HUANG J,et al.Study on the index of cassava seed stem vigor[J].Journal of Yunnan Agricultural University (Natural Science),2019,34(4):583–589.
[34] 朱智耀,高彦彬,刘静,等.糖脂平对胰岛素抵抗大鼠PGC–1α、细胞色素C、ATP合成酶β亚基基因表达影响[J].世界中西医结合杂志,2016,11(12):1656–1658. ZHU Z Y,GAO Y B,LIU J,et al.Impacts of tangzhiping on genetic expressions of PGC-1α,cytochrome C and ATP synthases β subunit in the rats of insulin resistance[J].World Journal of Integrated Traditional and Western Medicine,2016,11(12):1656–1658.
[35] 杨亚平.水稻种子劣变的生理生化机制及其相关蛋白质研究[D].长沙:湖南师范大学,2008. YANG Y P.Studies on the physiological and biochemical mechanisms and the proteins relative to deterioration of rice seeds[D].Changsha:Hunan Normal University,2008.
[36] 刘增辉,邵宏波,初立业,等.干旱、盐、温度对植物体NADP–苹果酸酶的影响与机理[J].生态学报,2010,30(12):3334–3339. LIU Z H,SHAO H B,CHU L Y,et al.The effect and the mechanism of drought,salt and temperature on NADP-malic enzymes in plants[J].Acta Ecologica Sinica,2010,30(12):3334–3339.
[37] DAVLETOVA S,RIZHSKY L,LIANG H J,et al. Cytosolic ascorbate peroxidase 1 is a central component of the reactive oxygen gene network of[J]. The Plant Cell,2005,17(1):268–281.
[38] HARA M,FUJINAGA M,KUBOI T.Radical scavenging activity and oxidative modification of citrus dehydrin[J].Plant Physiology and Biochemistry,2004,42(7/8):657–662.
Proteomics profiling of the deteriorated cassava(Crantz) stem
LIU Zifan1, CHEN Chen1, HUANG Jie2,3*, WEI Yunxia2,3,LIAO Daolong4
(1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Danzhou, Hainan 571737, China; 3.Keys Laboratory of Protection and Utilization of Cassava Germplasm Resources, Ministry of Agriculture and Rural Affairs, Danzhou, Hainan 571737, China; 4. Institute of Vegetables, Hainan Academy of Agricultural Sciences, Haikou, Hainan 571100, China)
To look into theoretical basis of the molecular mechanism of deterioration, we took cassava() stem, cassava stems of South China 8 (SC8) and Nanzhi 199 (NZ199) varieties at four aging degrees as materials and characterized the differentially expressed proteins(DEPs) in the stems responding to four aging degrees. The results showed that: 1) Compared to the non-aged stems, 38 DEPs of the stems of SC8 with two-day age were up-regulated by 11 and down-regulated by 27, 64 DEPs from the stems of SC8 with four-day age were up-regulated by 18 and down-regulated by 46, and 68 DEPs from the stems of SC8 at six-day age were up-regulated by 25 and down-regulated by 43. 2) Compared to the non-aged stems, 55 DEPs of the NZ199 at two-day age were up-regulated by 17 and down-regulated by 38, 63 DEPs from of NZ199 at four-day age were up-regulated by 23 and down-regulated by 40, and 84 DEPs of NZ199 at six-day age were up-regulated by 43 and down-regulated by 41. 3) Compared to the non-aged stems, two days aged and four days aged treatment, 17 of 19 common DEPs were identified from the age of six days for SC8 stems, while 30 of 36 common DEPs were identified from the age of six days for NZ199 stems. These 30 proteins were grouped into five functional categories, chaperone proteins, carbon metabolism and energy metabolism related proteins, transfer proteins, defense proteins, detoxification and antioxidant related proteins. 4) D-3-phosphoglycerate dehydrogenase, phosphoglycerate kinase, chitotriosidase-1-like, malic enzyme, probable cinnamyl alcohol dehydrogenase, 1-deoxy-D-xylulose-5-phosphate reductoisomerase were down-regulated, while probable glutathione S-transferase parC, isoflavone reductase-like, pathogenesis-related protein Bet v I family, heat shock protein, chaperonin CPN60, alpha amylase, ATP synthase subunit beta and enolase were up-regulated. 5) DEPs mainly participated in biological process, including response to oxidative stress, toxin catabolic process, glutathione metabolic process, protein folding and glycolytic process. The proteins were mainly located in mitochondria, chloroplasts, cytoplasm, cell wall, and etc, and played roles of binding, catalytic activity and oxidoreductase activity.
cassava; stem; deterioration; proteomics

S533.01
A
1007-1032(2020)04-0402-08
10.13331/j.cnki.jhau.2020.04.004
刘子凡,陈晨,黄洁,魏云霞,廖道龙.木薯种茎劣变的蛋白质组学分析[J].湖南农业大学学报(自然科学版),2020,46(4):402–409.
LIU Z F, CHEN C, HUANG J, WEI Y X,LIAO D L. Proteomics profiling of the deteriorated cassava(Crantz) stem[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(4): 402–409.
http://xb.hunau.edu.cn
2019–09–09
2019–10–05
农业农村部现代农业产业技术体系建设专项(CARS–11–hnhj);中国热带农业科学院热带作物品种资源研究所非营利性科研机构改革专项(pzsfyl–201807)
刘子凡(1975—),男,江西余干人,博士,副教授,主要从事热带作物高效栽培与种子科学研究,jiangxilaobiao@163.com;
,黄洁,硕士,研究员,主要从事木薯高产栽培研究,hnhjcn@163.com
责任编辑:毛友纯
英文编辑:柳正
