盐酸特比萘芬分散片在健康人体的药动学研究
2020-08-27王海英蒋学华
王海英,蒋学华,邹 琴,苏 旭,陈 卓#
(1.四川大学华西第二医院药物临床试验机构,四川 成都610041; 2.四川大学华西药学院,四川 成都 610041)
特比萘芬是瑞士Sandoz药厂生产的一种具有亲脂性、可外用又可口服的新型丙烯胺类抗真菌药,其能特异性干扰真菌固醇生物合成,引起麦角固醇的缺乏,并且抑制真菌细胞膜上的角鲨烯环氧化酶,使角鲨烯在细胞内积聚,从而导致真菌细胞死亡[1-3]。角鲨烯环氧化酶与细胞色素P450系统无关系,不影响激素或其他药物的代谢。本品与萘替芬同为丙烯胺衍生物,但其抗真菌活性比后者高30倍。特比萘芬是治疗真菌性皮肤病非常安全有效的药物,用于治疗足癣临床疗效较为理想,同时临床复发率较低[4-6];其对于头癣的疗效与灰黄霉素相当,但安全性更高,不良反应较少[7]。本试验在已有的文献报道基础上[8-11],用已建立的高效液相色谱法(high performance liquid chromatography,HPLC)测定24例健康受试者自身交叉对照口服两种特比萘芬片(分散片和普通片)后的经时血药浓度,采用液液萃取法对血样进行处理,专属性强,灵敏度高, 可用于特比萘芬片剂在健康人体的药动学和生物等效性研究,现报告如下。
1 材料
1.1 仪器
Alliance型高效液相色谱仪(美国沃特世公司);CP225D型电子天平(德国赛多利斯公司);艾本德单通道移液器(0.5~10 μl,20~200 μl,德国Eppendorf公司);IKA Votex Genius 3型涡漩混合仪(德国IKA公司);TGL-16C型台式高速离心机(上海市安亭科技仪器厂);THERMO型低温冰箱(美国THERMO公司)。
1.2 药品与试剂
受试制剂特比萘芬分散片(T,按C16H17N3O4S计算0.25 g/粒,批号为100501H,四川某药业有限责任公司),遮光、密封,在凉暗处(≤20 ℃)保存,有效期暂定为2年;参比制剂特比萘芬片(R,按C16H17N3O4S计算0.25 g/粒,批号为X0124,北京诺华制药有限公司),遮光、密封,在凉暗处(避光且≤20 ℃)保存,有效期3年;盐酸特比萘芬标准品(批号为100563-200301,中国食品药品检定研究院 )。内标海柯碱皂苷元标准品(批号为HDV01,纯度99%,东京化成工业株式会社);甲醇(色谱纯,批号为085884,美国Fisher公司);水为MILLIPORE去离子水。
1.3 试验对象
入组24例健康男性受试者,平均年龄(25.1±1.0)岁,平均体重(64.8±5.9) kg,平均身高(1.72±5.4) m。所有入组的受试者身体健康,无心血管、肝脏、肾脏、消化道、精神及神经等疾病史,试验前经病史询问、体格检查和实验室检查未发现有临床意义的异常。受试者在试验期间全程入住四川大学华西第二医院药物临床试验机构Ⅰ期病房,统一进食标准餐。本研究通过四川大学医学伦理委员会的批准,试验前受试者均签署知情同意书。
2 方法与结果
2.1 给药方法及样品采集
本试验采用开放、随机、两周期、双交叉试验设计,受试者于试验前2周至整个试验过程禁止服任何其他药物,禁烟酒,于每周期给药前1 d入住Ⅰ期病房,给药前禁食至少10 h以上,在空腹状态下用240 ml水送服受试制剂或参比制剂1粒。受试期间统一进食清淡、低脂肪且不辛辣饮食。周期间的清洗期为7 d。受试者给药前自上肢肘静脉取空白血约3 ml,给药后0.5、0.75、1、1.5、2、2.5、3、5、8、12、24及54 h由上肢肘静脉取含药血约3 ml,试验过程共设计13个取样点,每例受试者总取血约78 ml。血样置肝素化的离心管中离心分离血浆,置于 -70 ℃冰箱保存待测。
2.2 色谱条件
色谱柱为Sunfire C18柱(150 mm×4.6 mm,5 μm,Waters公司);流动相组成为甲醇-10 mmol/L磷酸二氢钾缓冲液(V∶V=90∶10),柱温为25 ℃;检测波长为224 nm;流速为1.0 ml/min。
2.3 血浆样品处理
精密量取血浆样品500 μl,置于7 ml塑料离心管中,分别加入系列浓度的待测物工作溶液100 μl,混匀1 min后,加入内标工作溶液100 μl,混匀1 min后加入0.1 mol/L盐酸溶液0.2 ml,涡旋振荡混合1 min,用正己烷3.5 ml涡旋提取7 min,12 000 r/min离心7 min,吸取上清液入进样瓶插管中,50 ℃氮气挥干。残渣用0.1 ml流动相溶解,依次放置于自动进样器样品盘,进样30 μl分析。记录待测物峰面积与内标峰面积。
2.4 统计学方法
根据血药浓度数据,采用DAS 3.0软件,按统计矩原理,计算药动学参数,并评价特比萘芬分散片和普通片剂的生物等效性。P<0.05表示差异有统计学意义。
2.5 方法学考察
2.5.1 标准溶液配制:精密称取盐酸特比萘芬对照品,用甲醇定量溶解并稀释至含特比萘芬 200 μg/ml,得特比萘芬储备液。取特比萘芬储备液适量,用甲醇分别稀释成质量浓度为78.125、156.25、312.5、625、1 250、2 500、5 000、10 000和20 000 ng/ml的特比萘芬标准系列溶液;同时,另外配制156.25、2 500和10 000 ng/ml的质量控制(qualitycontrol,QC)溶液,于4 ℃冷藏备用。此外,精密称取海柯碱皂苷元,用甲醇稀释定容,得到质量浓度约为100 μg/ml的内标工作溶液。
2.5.2 专属性考察:分别取6例受试者的空白血浆500 μl,除不加入内标溶液并另补加甲醇200 μl外,其余按“2.3”项下方法操作,获得空白血浆样品的色谱图,见图1(A);将一定浓度的特比萘芬标准溶液和内标溶液加入空白血浆中,依同法操作,得图1(B);取健康受试者给药后血浆样品,依同法操作,得图1(C)。结果显示,在此色谱质谱条件下内标、特比萘芬保留时间分别为4.6、7.2 min,峰形良好,血浆中的内源性物质不干扰特比萘芬和海柯碱皂苷元的测定。
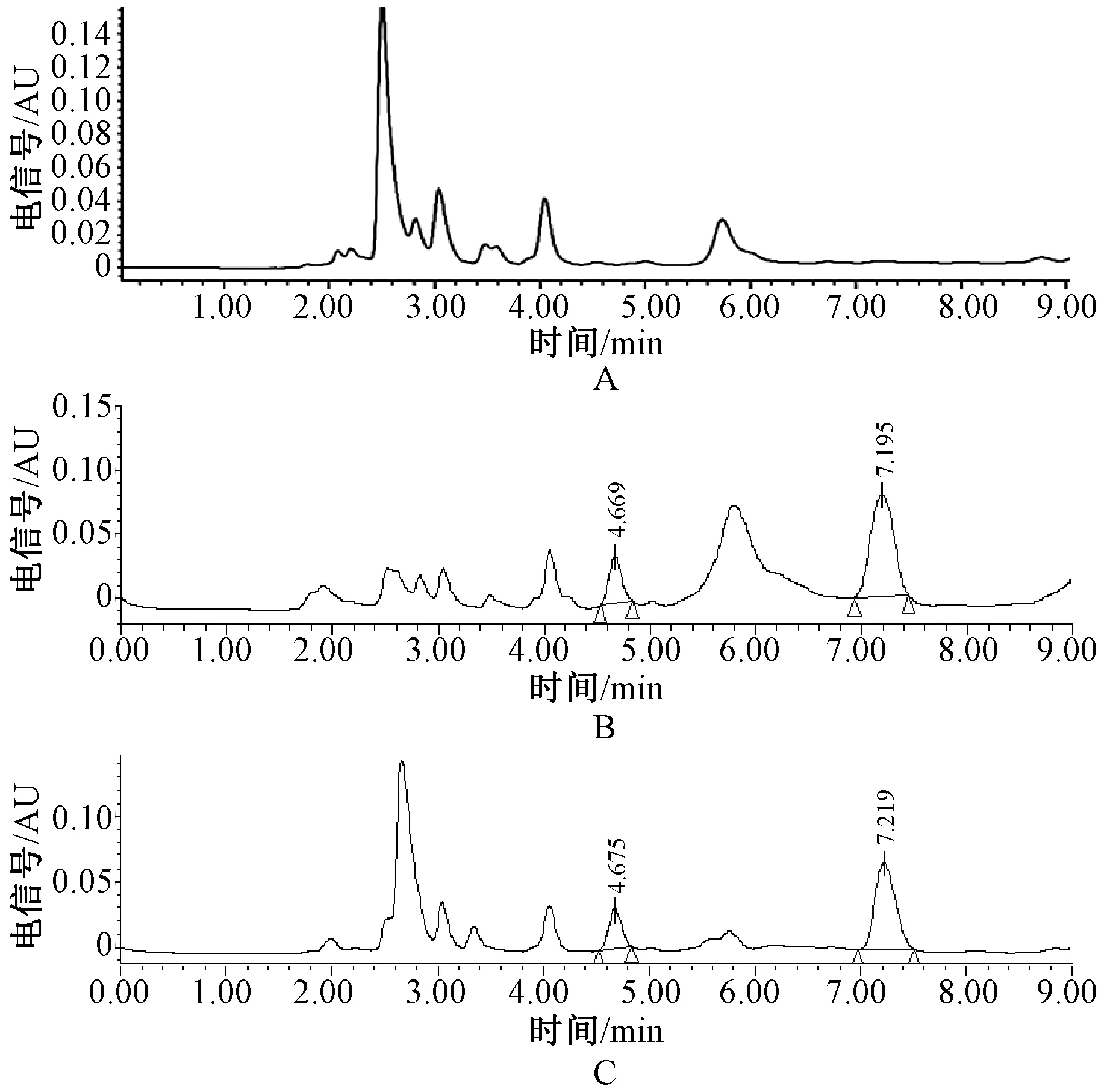
A.空白血浆;B.空白血浆中加入特比萘芬(500 ng/ml)、内标海柯碱皂苷元(500 ng/ml)(run 01);C.健康受试者口服参比制剂2 h后的血浆样品A.blank plasma; B.blank plasma with terbinafine (500 ng/ml) and internal standard haikoline saponin (500 ng/ml)(run 01); C.plasma sample of healthy volunteers after oral administration of reference preparation for 2 h图1 血浆中特比萘芬和内标海柯碱皂苷元的HPLC色谱图Fig 1 HPLC chromatogram of terbinafine and internal standard haikoline saponin in plasma
2.5.3 标准曲线制备与定量下限:精密量取空白血浆500 μl,分别加入特比萘芬标准系列溶液100 μl,配制成相当于血浆浓度为15.625、31.25、62.5、125、250、500、1 000、2 000和4 000 ng/ml的血浆样品,除不加甲醇100 μl外,其余按“2.3”项下操作,进行分析,记录色谱图。以特比萘芬浓度为横坐标(C),特比萘芬与内标的峰面积比值为纵坐标(R),用加权(W=1/c2)最小二乘法进行回归运算,求得直线回归方程为R=0.183C-0.006,r2=0.999。可见,血浆中特比萘芬的质量浓度在15.625~4 000 ng/ml范围时,线性关系良好,并且定量下限为15.625 ng/ml。
2.5.4 精密度与提取回收率:制备特比萘芬低、中及高3个质量浓度(156.25、2 500及10 000 ng/ml)的质量控制(QC)样品,每个质量浓度各6个样本,连续测定3 d。根据当日的随行标准曲线,计算QC样品的测定质量浓度,计算准确度与精密度,结果见表1。同时,另取空白血浆500 μl,按“2.3”项下操作,向提取后的上清液中加入相对应质量浓度的QC溶液和内标溶液,涡旋混合,经氮气吹干复溶后进样。以每个质量浓度2种处理方法的峰面积比值计算提取回收率,结果见表1。结果显示,药物和内标提取回收率稳定,结果精密可重现。
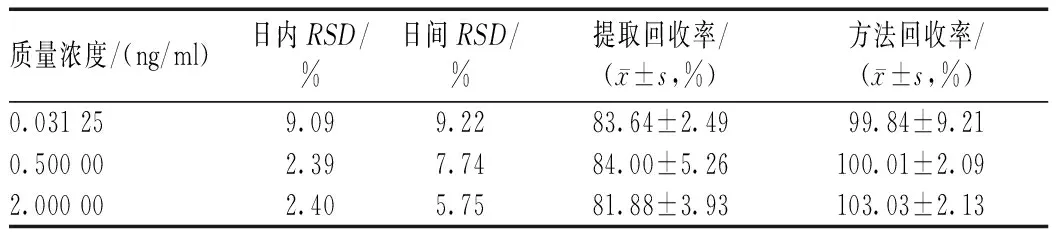
表1 HPLC法测定血浆中特比萘芬的精密度与回收率试验结果Tab 1 Precision and recovery test of terbinafine in plasma by HPLC method
2.5.5 稳定性试验:取特比萘芬低、中及高3个质量浓度(156.25、2 500及10 000 ng/ml)的QC样品,每个质量浓度3个样本,分别考察室温(15~25 ℃)条件下放置4 h、提取后室温条件下放置4 h、自动进样器环境放置24 h以及-80 ℃反复冻融循环3次和-80 ℃冷冻放置30 d的稳定性。结果显示,在上述条件下,特比萘芬和内标均稳定,质量浓度的相对误差均<(±15%)。
2.6 平均血药浓度-时间曲线
2例患者因临时有事退出试验。其余22例健康受试者口服特比萘芬受试制剂与参比制剂后的平均血药浓度-时间曲线见图 2。
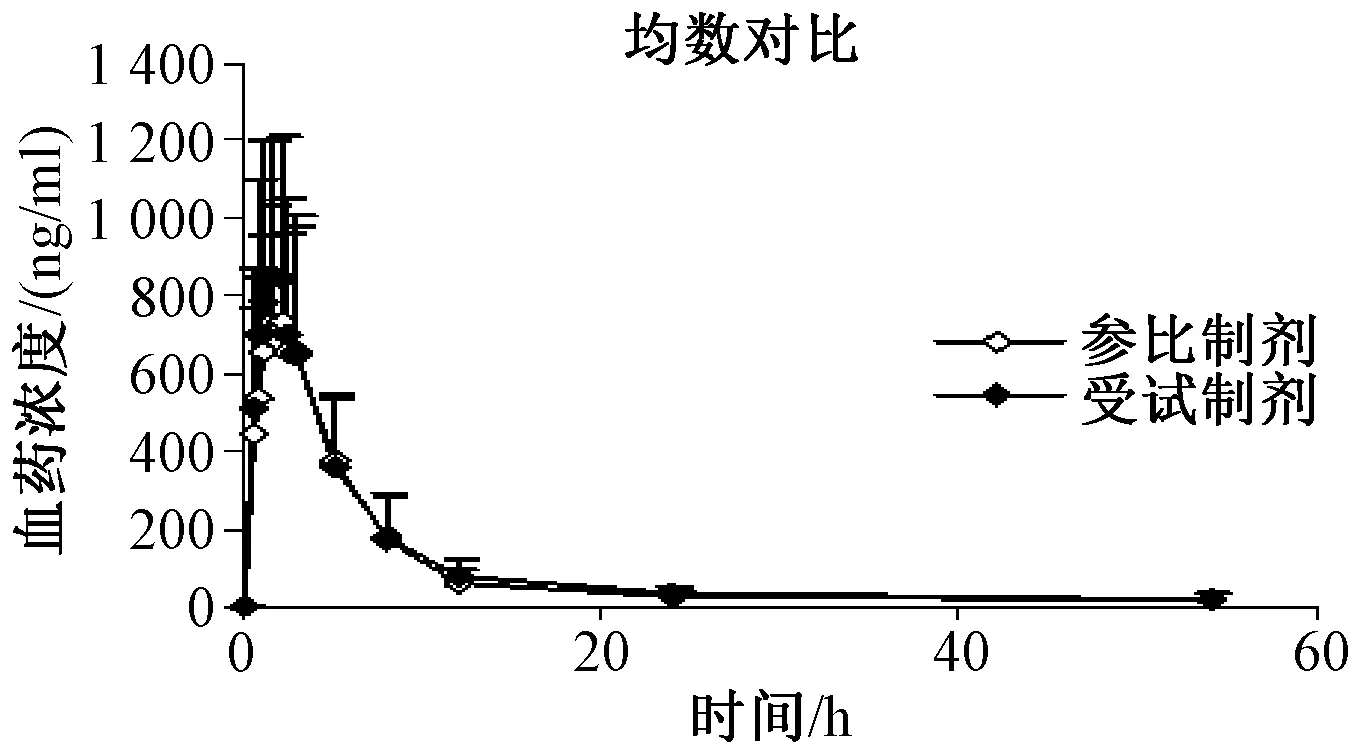
图2 22例受试者服用受试制剂和参比制剂后平均血药浓度-时间曲线Fig 2 Mean plasma concentration-time profile after oral administration of test and reference preparation in 22 healthy volunteers
2.7 药动学参数
22例受试者空腹给予特比萘芬受试制剂与参比制剂后血浆中特比萘芬的主要药动学参数见表2。
表2 22例受试者服用受试制剂和参比制剂后的主要药动学参数Tab 2 Pharmacokinetic parameters after oral administration of test and reference preparations in 22 healthy
2.8 生物等效性评价结果
特比萘芬受试制剂与参比制剂的AUC0-t、AUC0-∞及Cmax在药物和周期的差异无统计学意义(P<0.05)。结果显示,受试制剂AUC0-t、AUC0-∞及Cmax的90%CI分别为参比制剂相应参数的93.0%~103.4%、95.4%~102.8%及96.5%~115.1%,落在80%~125%区间,表明以健康受试者单剂量口服受试制剂和参比制剂后的AUC0-t、AUC0-∞和Cmax等参数为指标进行两种制剂生物等效性评价,受试制剂特比萘芬分散片与参比制剂特比萘芬片在健康中国人体内生物等效,受试制剂相对于参比片剂的生物利用度为(108.2±27.6)%。
3 讨论
根据Cmax、AUC0→t、Tmax3个用于生物等效性评价的主要药动学参数的统计分析结果,可认为两种制剂的吸收速度和吸收程度均无差异,提示特比萘芬受试制剂和参比制剂具有生物等效性。分散片的Tmax与普通片Tmax相比略有加快,但差异无统计学意义(P>0.05),未能体现分散片加快吸收的临床使用优越性,提示该剂型改变不是有价值的剂型改造。盐酸特比萘芬为脂溶性药物,其水溶性较差,为进一步提高其生物利用度,避免或减少口服带来的不良反应,同时最大限度地提高药物的临床疗效,有必要进一步研究盐酸特比萘芬新剂型、新载药制备工艺。随着现代药剂学制剂工艺的发展,近年来已有纳米乳[12]、固体脂质纳米粒[13]、二元醇质体[14]、醇类脂泡囊[15]及固体分散体微丸[16]等研究报道。
本研究采用液液萃取后HPLC法测定血样中的特比萘芬浓度,流动相用缓冲盐体系,在长时间进样过程中色谱峰形无拖尾、峰位漂移等现象;同时,样品与内标峰能够分离良好。本试验建立的方法简便、快速且灵敏,专属性强,并可以满足最低检测的要求及药动学研究的需要,适用于临床药动学研究。
