关于缬沙坦分散片的研制及含量测定方法的研究
2017-03-19于婷杨磊
于婷+杨磊
摘 要:目的 对缬沙坦分散片进行制备并且对其含量测定方法进行研究。方法 利用正交法筛选出最佳条件的制备处方。采用高效液相色谱法对3批缬沙坦分散片的含量进行测定。结果 检测样品在1.5 min内可完全崩解并且含量稳定。结论用筛选出的处方所制备的缬沙坦分散片具有分散均匀,崩解快并且含量符合限度要求的特点。
关键词:缬沙坦;分散片;正交法;高效液相色谱法
缬沙坦(Valsartan),化学名:N-(1-氧戊基)- N-4-2-(1H-4唑-5-基)苯基苄基-L-缬氨酸,是继钙离子通道阻滞剂和血管紧张素转化酶抑制剂(ACEI)之后又一新型抗高血压药,系一种血管紧张素Ⅱ(angiotensin Ⅱ) AT1受体拮抗剂,避免了钙拮抗和ACEI的不良反应[1]。分散片兼有片剂和液体制剂的优点,具有分散状态佳,崩解时间短,药物溶出迅速、吸收快、生物利用度高、不良反应少,服用方便等特点[2]。本文介绍了对缬沙坦分散片进行制备并且对其含量测定的方法。
1 试药与仪器
1.1 试药 缬沙坦原料药(珠海润都制药股份有限公司,批号20150813);缬沙坦对照品(丽珠集团常州康丽制药有限公司,批号20150522);缬沙坦分散片(自制,80 mg/片,批号20160415、20160416、20160417);所用辅料均为药用辅料;所用试剂均为分析纯。
1.2 仪器 电子天平(BSA224S赛多利斯);智能溶出试验仪 (ZRS-8天津大学无线电厂);片剂四用测定仪(78X上海黄海药检仪器厂);高效液相色谱仪(1100美国安捷伦公司);冲压片机(ZP-33 上海天祥-健台制药机械有限公司)。
2 制备
2.1 处方及制备工艺:缬沙坦和交联聚乙烯吡络烷酮(PVPP)、微晶纤维素(MCC)、微粉硅胶、十二烷基磺酸钠(SLS)及乳糖混合过100目筛,混匀后用PVP醇溶液湿法制粒,过40目筛,置于干燥箱内60℃干燥4 h,30目筛整粒,加入低取代羟基丙纤维素(L-HPC)和硬脂酸镁混合均匀,压片即可。
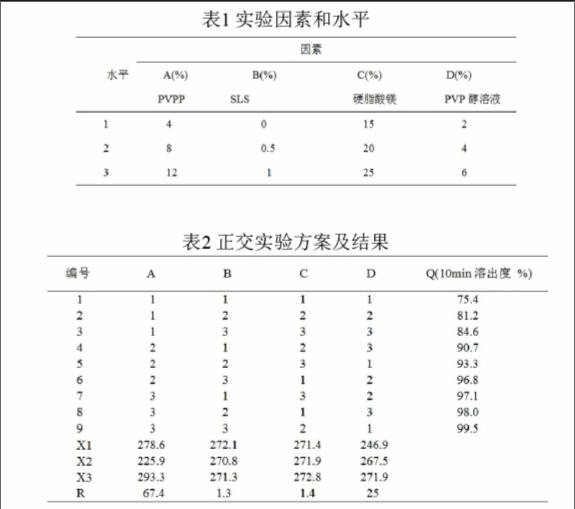
2.2 处方筛选:将崩解剂和溶胀性辅料比例通过正交实验确定最佳处方,以此进行筛选。将制备分散片的主要影响因素PVPP、 SLS 、硬脂酸镁以及PVP醇溶液浓度,各分成3个水平,按L9(34)正交实验表进线筛选,因素及水平见表1,以体外溶出度为考察指标。
体外溶出度正交实验方案和结果见表2:
表2中的极差R数据表明:PVPP和PVP醇溶对分散片的影响较大,而SLS和硬脂酸镁对分散片的影响不明显。考虑到药品辅料成本,最终确定的处方为:A2B1C2D3。选用硬脂酸镁作润滑剂易与颗粒混匀,压片后片面光滑美观[3]。根据筛选出的处方,制备了3批缬沙坦分散片样品,所制得的分散片溶出性好、外观平滑。
3含量测定
3.1 色谱条件:色谱柱为Diamonsil—Cl8柱(200 mm×4.6mm,5 μm),流动相为乙腈∶水(50∶50),流速为1.0 ml/min,检测波长为270 nm,柱温为室温。
3.2 线性实验:精密称取缬沙坦对照品80 mg,置于100 ml容量瓶中,加流动相溶解稀释至刻度,摇匀。然后精密量取1,2,4,6,8ml至10 ml量瓶中,加流動相稀释至刻度,摇匀。再各取上述溶液20 μl注入液相色谱仪中,最后以药物峰面积A对浓度C(μg/ml)进行线性回归。得到的回归方程:A=16150C-8 762.7,r=1.000,结果表明缬沙坦对照品浓度在7.5~62.3 μg/ml范围内与药物峰面呈线性关系。
3.3 回收率实验:分别精密称取缬沙坦对照品40,60,80 mg,共9份,分别置于100 ml容量瓶中,模拟缬沙坦分散片处方工艺制成样品,加流动相溶解稀释至刻度,摇匀。然后精密量取2ml置100ml容量瓶中,加流动相稀释至刻度,摇匀,作为供试品溶液;另外精密称取缬沙坦对照品10 mg,加流动相稀释制成浓度为10 μg/ml的溶液,作为对照品溶液;取供试品与对照品溶液各20μl注入液相色谱仪中,按外标法测定峰面积,并计算回收率。三种不同浓度的样品平均回收率分别为(99.26±1.53)%,(99.17±1.12)%,(99.22±1.28)%(n=9),三种不同浓度的缬沙坦样品的RSD分别为1.53%,1.12%,1.28%(n=9),回收率良好。
3.4 样品含量测定:取本品15片,精密称定,研细,精密称取适量(约相当于缬沙坦80 mg),置于100 ml容量瓶中,加适量流动相其使溶解,定容,摇匀。再精密量取2 ml溶液置于50 ml容量瓶中,加流动相稀释至刻度,摇匀。最后取20μl溶液注入液相色谱仪分析;另外精密称取缬沙坦对照品,用流动相溶解稀释成10 μg/ml的溶液,按外标法以峰面积计算分散片的含量。批号为20160415、20160416、20160417的缬沙坦分散片的检测含量分别为99.9%、100.6%、105.2%。结果表明:三批样品的百分含量均在90.0%—110.0%范围内。
3.5 崩解时间与分散均匀性[3-4]检测:根据《中国药典》2015版,崩解时限与分散均匀性检查法的规定:分散片崩解样品在温度为15—25℃时,崩解时限应小于3 min并且崩解后的颗粒应全部通过710 μm筛网。检测结果表明:3批样品完全崩解的时间均在1.5 min内,分散后的颗粒全部可以通过710 μm筛网,符合《中国药典》2015版的要求。
4讨论
为了筛选出制备缬沙坦分散片的最佳处方,本文在试验中对PVPP、 SLS 、硬脂酸镁以及PVP醇溶辅料进行正交筛选。分散片由至少1种崩解剂和遇水形成高黏度的溶胀性辅料而制成,改变处方辅料组成比例,可在一定范围内调节片剂的崩解时限,使之符合分散片的要求[5-6]。因此本实验筛选出最佳处方,并制备3批样品,样品的外观及溶出均符合要求。
通过最佳处方制备的3批样品采用高效液相进行含量测定,结果表明:回收率高,含量均在90.0%—110.0%内。3批样品的崩解时限性和分散均匀性均符合《中国药典》2015版的要求。
通过对缬沙坦分散片的制备方法和含量测定方法的研究,表明本次实验方法可行,所制备样品具备分散片特点。
参考文献
[1]贾庆忠, 马桂林. 抗高血压药缬沙坦的合成[J]. 中国医药工业杂志, 2001, 32(9):385-387.
[2]谢燕萍,吴杏梅.布南色林分散片的处方研究[J].中国药房,2011,22(13):11931196
[3]毕殿洲.药剂学[M]. 北京:人民卫生出版社,1999:325.
[4]国家药典委员会.中花人民共和国药典[S].一部.北京:化学工业出版社,2015.0101片剂:通则0921.
[5]李 莉,熊守军.羧甲司坦分散片的制备及其相关质量评价[J]. 中国生化药物杂志,2001,22(1):38.
[6]农聪. 缬沙坦分散片联合前列地尔注射液治疗慢性肾小球肾炎疗效观察[J]. 亚太传统医药, 2014, 10(2):200-200.
作者简介:于婷,哈尔滨三联药业股份有限公司,工程师,150025,本科,1990年08月27日,冻干粉针剂方向。
