干扰素-γ作用后的小鼠肺微血管内皮细胞对共培养T淋巴细胞增殖的影响及机制
2020-08-26徐金环尹琎李琳李赟张义成
徐金环,尹琎,李琳,李赟,张义成
华中科技大学同济医学院附属同济医院,武汉430030
血管内皮细胞是移植排斥过程中最先接触到反应性T淋巴细胞的异体细胞,而T淋巴细胞识别异型抗原对其后的异基因反应有至关重要的作用[1]。研究报道,将T淋巴细胞暴露于血管内皮细胞可导致T淋巴细胞无反应性[2]。在急性移植物抗宿主病(aGVHD)的发病过程中,Th1细胞通过干扰素-γ(IFN-γ)启动异体免疫反应后的炎症反应,且IFN-γ又可通过不同的途径来诱导免疫耐受及减轻异体免疫反应[3]。除公认的抑制性DC细胞外,血管内皮细胞可能在IFN-γ诱导的免疫耐受过程中也发挥重要作用,但目前相关研究较少。吲哚胺-2,3-加氧酶(IDO)是免疫反应中的一种重要调控酶,表达IDO的细胞能抑制T淋巴细胞反应和促进耐受形成[4]。研究表明,心脏移植大鼠移植心脏小血管IDO表达量及表达细胞数与移植物获得耐受的时间均呈正相关关系,且在aGVHD小鼠靶器官的血管内皮细胞可检测到IDO表达[5,6]。2017年1月~2018年12月,本研究将IFN-γ作用后的小鼠肺微血管内皮细胞(PMVECs)与T淋巴细胞共培养,观察其对T淋巴细胞增殖的影响,并探讨其机制是否与IDO有关。现报告如下。
1 材料与方法
1.1 材料 实验动物:健康8~10周龄雌性Balb/C小鼠16只,体质量18~20 g,购自北京华阜康生物科技股份有限公司。主要试剂:RPMI 1640培养液和胎牛血清(FBS)购自美国Gibco公司,小鼠IFN-γ和小鼠淋巴细胞分离液购自深圳达科为生物技术有限公司,蛋白Marker购自立陶宛Fermentas公司,Kyn和Trp标准品购自美国Sigma公司,BCA法蛋白定量试剂盒、SDS-PAGE凝胶制备试剂盒购自上海碧云天生物技术有限公司。主要仪器:0.4 μm孔径6孔Transwell板购自美国Corning公司,高效液相色谱仪、1525二元泵、2487紫外检测器、2475-荧光检测器、717自动进样器和色谱柱Atlantic C18 4.6 mm×150 mm购自美国Waters公司;凝胶成像分析系统购自英国Syngene公司。
1.2 小鼠PMVECs分离、培养及鉴定
1.2.1 小鼠PMVECs分离、培养 选择健康Balb/C小鼠10只,断髓处死后,浸泡于75%乙醇中5 min;用组织剪逐层剪开胸腔,切下肺组织,剪去表面的脏层胸膜,剪取胸膜下肺组织(厚度不超过1.5 mm)。将肺组织用锋利的手术刀切成1 mm×1 mm×1 mm大小的组织块,用弯头滴管吸取组织块接种到50 cm3培养瓶壁上,3~4块/cm2。种植壁用少量RPMI 1640培养液(含20%胎牛血清、100 U/mL青霉素、100 U/mL链霉素)预湿,以利于组织块贴壁。将植块后的培养瓶倒置,加入5 mL左右培养液,放入37 ℃、5% CO2培养箱中。组织块贴壁4 h后,轻轻翻正培养瓶,继续培养;6~8 h后在倒置显微镜下观察细胞迁出情况。植块后最先游出的是血细胞,翻正瓶后约24 h可见到明显的内皮细胞游出;约36 h后更换培养液,约60 h后轻轻吸掉组织块,更换培养液,继续培养。以后每两天换半液1次。待细胞融合90%以上时,加入适量胰酶消化细胞,以1∶3的比例进行传代,取第2~5代细胞用于后续实验。
1.2.2 小鼠PMVECs鉴定
1.2.2.1 形态学观察 ①倒置显微镜观察:在细胞培养的第7~10天,将孔板置于倒置显微镜下,分别用100、200倍倒置显微镜进行观察。结果显示,小鼠肺组织植块24 h后,可见少量PMVECs爬出,60 h后大量PMVECs爬出;原代培养后10 d,细胞融合成单层,呈典型的“鹅卵石”、“铺路石”样排列,形态为多边形、短梭形,边界清楚,细胞质丰富,细胞核为圆形或椭圆形(图1)。②透射电镜观察:取生长状态良好的第3代PMVECs,制成密度为1×105/mL的细胞悬液,1 200 r/min离心5 min,去上清;2%戊二醛固定液(pH为7.2~7.4)固定,4 ℃条件下保存,透射电镜下观察细胞结构。结果显示,PMVECs形态均一,细胞质表面有许多突起形成细绒毛,细胞质中有空泡;细胞器丰富,如线粒体、高尔基复合体、粗面内质网、溶酶体等,细胞质内可见Weibel-Pallade小体(图2)。

图1 倒置显微镜下观察PMVECs形态

注:箭头指示为Weibel-Pallade小体。
1.2.2.2 细胞表面抗原检测 采用间接免疫荧光法。将适量第3代PMVECs悬液滴到玻片上,待细胞贴壁融合50%左右,4%多聚甲醛固定25 min;PBS清洗3次,0.3% TritonX-100破膜10 min;PBS清洗,5% BSA封闭,37 ℃条件下孵育30 min。加入抗CD31大鼠抗小鼠抗体(稀释比例为1∶100,用PBS代替一抗作为对照),4 ℃条件下孵育过夜;PBS清洗3次,加入PE标记的羊抗大鼠荧光二抗,室温条件下孵育2 h;PBS清洗3次,使用10 nmol的DAPI常温复染3 min;PBS清洗3次,置于荧光显微镜下观察细胞表面荧光情况。结果显示,分离培养的PMVECs纯度>95%,细胞均表达内皮细胞表面标志CD31(PMVECs呈明亮的红色荧光,DAPI复染细胞核呈蓝色)。
1.3 不同浓度IFN-γ作用后的PMVECs对共培养T淋巴细胞增殖能力影响的观察
1.3.1 T淋巴细胞分离 将6只Balb/C小鼠断髓处死,无菌分离颈部、双侧腋窝、腹股沟浅、肠系膜淋巴结,去掉被膜;于200目尼龙网过滤,收集细胞,用预冷的PBS洗涤2次,1 500 r/min离心5 min。将CSFE(终浓度为4.5 μmol/L)加入含2% FBS的RPMI 1640培养液中,用配置好的培养液进行重悬,调整细胞密度为1×107/mL;37 ℃条件下孵育15 min,每隔5 min混匀1次;加入等体积的FBS终止5 min,1 000 r/min离心5 min,含2% FBS的RPMI 1640培养液洗涤2次,1 000 r/min离心5 min,收集下层沉淀细胞即为T淋巴细胞。
1.3.2 分组处理及T淋巴细胞增殖能力观察 采用流式细胞术。以2×105/孔将第3代PMVECs种植至Transwell板下层小室,随机分为空白对照组、10 ng/mL组、20 ng/mL组、50 ng/mL组、80 ng/mL组,分别在Transwell板中加入不同浓度IFN-γ,调整其终浓度分别为0、10、20、50、80 ng/mL,每组设置3个复孔。24 h后PMVECs铺满Transwell板底,弃上清,每孔用RPMI 1640洗两遍,弃上清。在Transwell板每孔上层小室中加入2×106个已染CFSE的T淋巴细胞,每孔总培养体系为2.5 mL,置于37 ℃、5% CO2孵箱中,培养72 h。收集Transwell板上层小室中的T淋巴细胞,PBS洗3次,10 g/L多聚甲醛PBS固定20 min。使用流式细胞仪检测淋巴细胞增殖情况,CellQuest软件分析结果并计算淋巴细胞增殖指数。
1.4 IFN-γ对PMVECs培养液上清色氨酸、犬尿氨酸水平及细胞IDO表达影响的观察
1.4.1 细胞分组处理 取生长状态良好的第3代PMVECs,以1×106/孔接种于6孔细胞培养板,随机分为观察组和对照组,观察组加入终浓度为80 ng/mL的IFN-γ,对照组加入等量PBS。
1.4.2 细胞培养上清中色氨酸、犬尿氨酸水平及IDO活性检测 采用反相高效液相色谱法。两组培养24 h,收集细胞培养液上清。取300 μL细胞培养上清,加入等体积5%高氯酸,在漩涡振荡器上充分混匀后,冰上放置10 min;4 ℃条件下12 000 r/min离心10 min,收集上清液500 μL,吸取上清20 μL进样。在C18反相柱上分离,流动相是含有27 mL/L乙腈的15 mmol 乙酸-乙酸钠(pH为3.6),在287 nm激发波长和357 nm发射波长下,采用荧光检测器检测色氨酸、紫外分光光度计检测犬尿氨酸在360 nm处具有最大吸收峰。因培养上清使用了等体积5%高氯酸沉淀蛋白,实际犬尿氨酸、色氨酸被对倍稀释,所以培养液中实际犬尿氨酸和色氨酸水平是测量结果的两倍。IDO活性=犬尿氨酸水平/色氨酸水平。
1.4.3 细胞IDO mRNA表达检测 采用RT-PCR法。两组培养24 h,使用TRIzol试剂分离总RNA,转录试剂盒将总RNA(2 μg)反转录为cDNA。IDO上游引物5′-CACTGAGCACGGACGGACTGAGA-3′、下游引物5′-TCCAATGCTTTCAGGTCTTGACGC-3′,GAPDH上游引物5′-CGTTGACATCCGTAAAGAC-3′、下游引物5′-TGGAAGGTGGACAGTGAG-3′。PCR反应体系:95 ℃、5 min;94 ℃、30 s,59 ℃、30 s,72 ℃、45 s,72 ℃、10 min,共35个循环。将PCR产物在2%溴化乙锭染色的琼脂糖凝胶上,ChemiImager 4400系统上可视化条带。以Image J软件分析条带灰度值,以IDO与GAPDH条带灰度值的比值计算IDO mRNA相对表达量。
1.4.4 细胞IDO蛋白表达检测 采用Western blotting法。两组培养24 h,加入组织裂解液提取蛋白并进行蛋白定量。取10 μg蛋白进行SDS-PAGE电泳,转印后,用5%脱脂奶粉封闭;加入兔抗小鼠IDO及β-actin一抗(稀释比例分别为1∶300、1∶1 000),4 ℃孵育过夜;TBST室温洗涤3次,每次10 min;加入辣根过氧化物酶标记羊抗兔二抗(稀释比例为1∶2 000),室温孵育45 min。使用凝胶成像分析仪分析条带灰度值,以IDO与β-actin条带灰度值的比值计算IDO蛋白相对表达量。
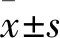
2 结果
2.1 各组T淋巴细胞增殖指数比较 空白对照组、10 ng/mL组、20 ng/mL组、50 ng/mL组、80 ng/mL组T淋巴细胞增殖指数分别为3.06±0.07、2.93±0.09、2.46±0.28、2.21±0.41、2.20±0.05,20 ng/mL组、50 ng/mL组、80 ng/mL组T淋巴细胞增殖指数均低于空白对照组(P均<0.01),20 ng/mL组、50 ng/mL组、80 ng/mL组T淋巴细胞增殖指数比较差异均无统计学差异(P均>0.05)。
2.2 观察组和对照组细胞培养上清中色氨酸、犬尿氨酸水平及IDO活性比较 观察组细胞培养上清中色氨酸水平低于对照组,犬尿氨酸水平及IDO活性均高于对照组(P均<0.01)。见表1。
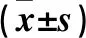
表1 观察组和对照组细胞培养上清中色氨酸、犬尿氨酸水平及IDO活性比较
2.3 观察组和对照组细胞IDO mRNA及蛋白表达比较 观察组和对照组细胞IDO mRNA相对表达量分别为0.68±0.02、0,IDO蛋白相对表达量分别为0.49±0.02、0;两组比较P均<0.01。
3 讨论
血管内皮细胞不仅可以使其与内皮下基质成分隔离,还可参与机体的炎症反应和免疫应答过程[2]。在异基因造血干细胞移植过程中,植入的活性淋巴细胞最先接触的是血管内皮细胞;一方面,血管内皮细胞作为非专职抗原呈递细胞,可发挥呈递抗原作用;另一方面,血管内皮细胞可参与机体的天然免疫调节过程。体外研究显示,IFN-γ可诱导人血管内皮细胞通过表达IDO而发挥抑制淋巴细胞增殖和病毒复制的作用[7~9]。在中枢神经系统感染时,IFN-γ能刺激脑微血管内皮细胞表达和IDO活化,从而发挥抗感染效应[10]。本研究通过组织块贴壁法培养小鼠PMVECs,并采用免疫荧光法及透射电镜进行鉴定,结果显示第3代PMVECs纯度可达95%以上,说明分离培养的PMVECs有较高纯度,适合后期实验。
IFN-γ可诱导血管内皮细胞的MHCⅡ类分子基因转录及蛋白合成,MHCⅡ类分子是抗原提呈细胞发挥抗原呈递作用的关键性效应分子,其表达使血管内皮细胞具备了作为抗原提呈细胞的潜能。血管内皮细胞以MHCⅡ类分子限制性方式将抗原肽呈递给淋巴细胞,并可通B7/CD28、CD40/CD40L CD58(LFA-3)/CD2(LFA-2)等途径向淋巴细胞提供共刺激信号,激活CD4+T淋巴细胞释放共同刺激信号,导致细胞毒性T淋巴细胞激活,从而促进免疫应答的进程[2,3]。血管内皮细胞表面均有MHCⅠ类分子,许多血管内皮细胞也持续表达MHCⅡ类分子,其中微血管和静脉血管内皮细胞更为显著,但大血管内皮细胞上无MHCⅡ类分子。为了避免PMVECs与T淋巴细胞接触后的相互作用,本研究采用Transwell板进行间接共培养。结果显示,20 ng/mL组、50 ng/mL组、80 ng/mL组T淋巴细胞增殖指数均低于空白对照组,说明IFN-γ作用后的PMVECs可抑制与其共培养的T淋巴细胞增殖;虽然20 ng/mL组、50 ng/mL组、80 ng/mL组T淋巴细胞增殖指数比较差异均无统计学差异,但80 ng/mL组T淋巴细胞增殖指数最低,因此选择该浓度进行后续实验。
IDO是一种含血红素酶,可催化色氨酸沿犬尿氨酸途径代谢的起始和限速步骤。在炎症反应中,炎症因子可以诱导IDO表达, 而IFN-γ是促进IDO表达的最强诱导剂[4]。色氨酸的缺乏和(或)其代谢产物的过度表达具有免疫调节作用,其可通过增加细胞凋亡敏感性和抑制T淋巴细胞活化而抑制附近的T淋巴细胞反应[4]。唐晓琼等[11]研究报道,IFN-γ可体外诱导骨髓间充质干细胞表达IDO,且IDO基因和蛋白表达均与IFN-γ浓度呈正相关关系。Liang等[12]研究报道,IFN-γ可刺激HUVEC诱导IDO表达,且具有时间和剂量依赖性。本研究结果显示,正常情况下PMVECs不表达IDO,而IFN-γ作用后可检测到IDO mRNA及蛋白表达;反相高效液相色谱法检测结果显示,80 ng/mL的IFN-γ诱导后,PMVECs细胞培养上清中色氨酸水平极低,而犬尿氨酸水平增加明显,提示色氨酸几乎完全代谢;表明IFN-γ能诱导PMVECs表达IDO,导致色氨酸消耗及其代谢产物的积累,即“色氨酸饥饿”及“色氨酸代谢产物累积”两种条件同时存在、相互促进,共同对T淋巴细胞产生增殖抑制作用[14,15]。
综上所述,IFN-γ作用后的PMVECs可对共培养的T淋巴细胞产生增殖抑制作用,其机制可能与促进色氨酸降解、犬尿氨酸累积及IDO表达有关。异基因造血干细胞输入后最先接触到血管内皮细胞,而且机体血管内皮细胞分布广泛,其数目远多于其他抗原呈递细胞;提示我们可通过保护血管内皮细胞,调节IFN-γ/血管内皮细胞途径来调控机体的免疫调节功能,从而达到诱导aGVHD免疫耐受的作用。
