北虫草CNZ虫草酸提取方法的筛选和优化
2020-08-19林爱华苗莉云王俊玲李惠宋发军张鹏
林爱华 苗莉云 王俊玲 李惠 宋发军 张鹏
摘要:为获得北虫草(Cordyceps miditaris)CNZ虫草酸最适的提取方法,比较了6种虫草酸提取方法,结果表明超声辅助醇提法虫草酸的得率最高,达113.31mg/g,可作为初始提取方法。进一步通过单因素试验和正交试验优化提取次数、固液比、超声时间、乙醇浓度等条件,获得北虫草CNZ虫草酸提取条件为:乙醉浓度20%体积分数),固液比1:10(g:mL),超声时间20min,提取次数3次;在优化的提取条件下,北虫草CNZ虫草酸得率为161.06mg/g,与初始提取条件相比提高了42.1%。
关键词:北虫草(Cordyceps militaris);虫草酸;提取方法;优化
中图分类号:S567.3+9 文献标识码:A
文章编号:0439-8114(2020)09-0141-04
DOI:10.14088/j.cnki:issn0439-8114.2020.09:030
北虫草(Cordyceps militaris)又称蛹虫草,属子囊菌亚门(Ascomycotina)麦角菌科(Clavicipitaceue)虫草属(Cordyceps)[1],经液体发酵得到的北虫草菌丝体的化学成分、药理作用与天然冬虫夏草非常相似,两者属于同属异种真菌[2]。虫草酸是虫草类真菌的主要有效成分之一,又名D-甘露醇,具有利尿、抗氧化、预防与治疗脑血栓等功效,其含量是虫草产品的质量评价指标之一[3]。
冬虫夏草是中国传统的滋补性中药材,然而野生虫草资源日益匮乏,市场需求却与日俱增[4,5]。利用北虫草发酵生产虫草酸等活性成分已成为替代野生虫草获得相关药物的主要途径[6,7],而高效的虫草酸提取方法是其关键技术之一。當前常用的虫草酸提取方法有水提法[8]、醇提法[9]、微波提取法[7,10]、超声辅提法[11]、热水浸提法[12]、超声-热水浸提协同法[13]等。北虫草菌CNZ是药用植物内生菌资源开发与应用团队新分离的一株虫草菌。本研究分别采用乙醇和去离子水2种提取剂,选用热浸法、超声辅提法、超声一热浸协同法3种提取技术,共组合了6种虫草酸提取方法,分别提取北虫草CNZ的虫草酸,筛选适用该菌株的初始虫草酸提取方法,并进一步通过优化提取次数、固液比、超声时间、乙醇浓度等条件,建立适合北虫草菌CNZ的虫草酸提取方法,为其大规模发酵应用研究奠定基础。
1 材料与方法
1.1 试验材料及试剂
北虫草CNZ采自山西省晋中市乌金山国家森林公园,并参照文献[14]报道的孢子分离法进行单克隆菌株的分离和纯化。虫草酸标准品和鼠李糖购自上海源叶生物科技有限公司。乙醇、乙酸铵、乙酞丙酮、冰醋酸、高碘酸钠等分析纯试剂购自国药集团化学试剂有限公司。Nash试剂、0.015mol/L高碘酸钠溶液、0.1%L-鼠李糖溶液的配制参照文献[11]。
1.2 北虫草CNZ的培养
发酵培养基参照文献[15],固体培养基为发酵培养基中添加2.0%的琼脂。将北虫草CNZ接种于固体培养基,27℃、避光培养一周后,光照培养2~3d至菌丝转色。采用直径6mm的打孔器截取转色后的菌块,按3菌块/250mL发酵培养基接种,27℃、175r/min培养12d。3层纱布过滤收集菌体,并于50℃烘干后研磨成粉,用于虫草酸的提取。
1.3 虫草酸含量的检测
1.3.1 虫草酸标准曲线的制作分别配制30、40、50、60、70、80、90mg/L的虫草酸标准品溶液,参照文献[16]和[17]报道的虫草酸检测方法,于412nm处测定各标准溶液的吸光值,并以质量浓度为横坐标、吸光值为纵坐标绘制虫草酸标准曲线。
1.3.2 虫草酸含量的检测及计算 参照文献[16]和[17]报道的虫草酸检测方法,检测1mL样品的吸光值,代入虫草酸标准曲线方程求得其虫草酸浓度,并利用公式:虫草酸得率(mg/g)=虫草酸浓度(mg/L)×稀释倍数×体积(mL)×10-3/菌粉质量(g),计算其虫草酸得率。
1.4 虫草酸提取方法的筛选
分别采用乙醇和去离子水2种提取剂,参照文献[18]选用热浸法、超声辅提法,并增加了超声-热浸协同法,共组合了6种虫草酸提取方法。
1.4.1 超声辅助水提法称取0.5g菌粉,与5mL去离子水充分混匀,超声辅提30min,8000r/min离心10min后,吸取上清液。再用5mL去离子水悬浮沉淀,并重复上述操作2次。合并上清,去离子水定容到100mL,取其中1mL,再定容到10mL作为待测样品。
1.4.2 超声辅助醇提法 采用50%(V/V,下同)乙醇替代“1.4.1”的去离子水,其余操作同“1.4.1”。
1.4.3 热浸水提法 采用90℃水浴60min代替“1.4.1”的超声辅提30min,其余操作同“1.4.1”。
1.4.4 热浸醇提法 采用50%乙醇代替“1.4.1”的去离子水,采用90℃水浴60min代替“1.4.1”的超声辅提30min,其余操作同“1.4.1”。
1.4.5 超声-热浸水提法 操作同“1.4.1”,但在超声辅提30min后,再90℃水浴60min。
1.4.6 超声-热浸醇提法 操作同“1.4.2”,但在超声辅提30min后,再90℃水浴60min。
1.5 虫草酸提取方法的优化
1.5.1 单因素优化试验 采用单因素试验分别考察不同提取次数(1、2、3次)、不同固液比(1:5、1:10、1:15、1:20、1:30,g:mL)、不同乙醇浓度(10%、20%、30%、40%、50%)和不同超声时间(5、8、10、15、20min)对北虫草CNZ虫草酸提取效率的影响。
1.5.2 正交优化试验 采用L9(34)正交试验分析提取次数(1、2、3次)、乙醇浓度(10%、20%、30%)、固液比(1:10、1:20、1:30,g:mL)和超声时间(10、15、20min)对北虫草CNZ的虫草酸提取效率的影响。
2 结果与分析
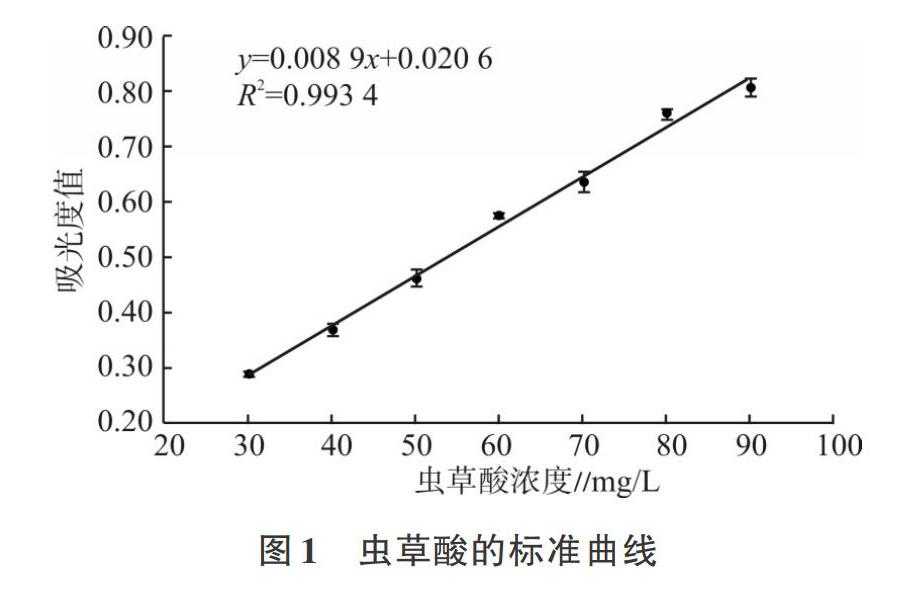
2.1 虫草酸标准曲线
以虫草酸浓度为横坐标、吸光值为纵坐标绘制其标准曲线见图1。由图1可见,在30~90mg/L范围内虫草酸浓度与其吸光值有较好的线性关系,回归方程为y=0.0089x+0.0206,R2=0.9934。
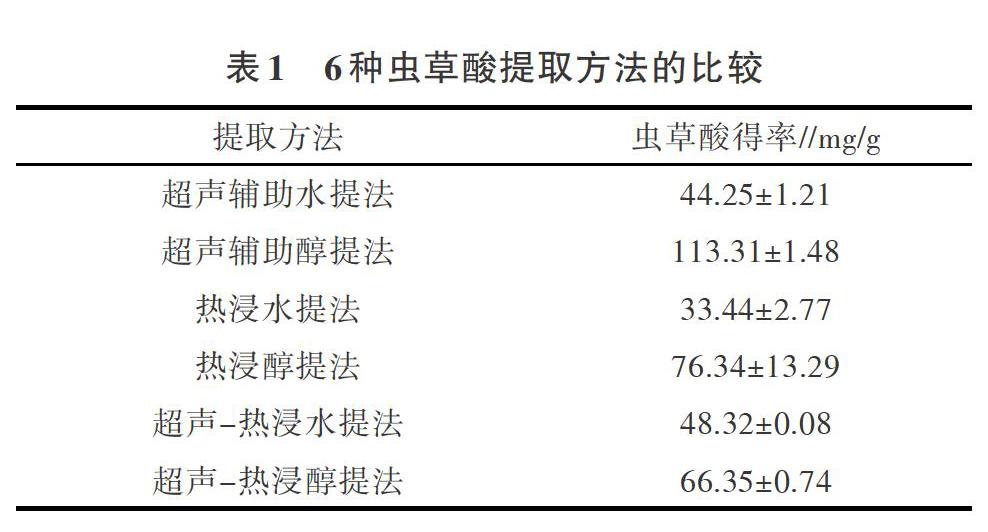
2.2 虫草酸提取方法的筛选
采用6种提取方法分别提取北虫草CNZ的虫草酸(表1),各提取方法的虫草酸得率为:超声辅助醇提法>热浸醇提法>超声-热浸醇提法>超声-热浸水提法>超声辅助水提法>热浸水提法。超声辅助醇提法的虫草酸得率最高,为113.31mg/g,是虫草酸得率次高的热浸醇提法的1.48倍,是虫草酸得率最低的热浸水提法的3.39倍。超声辅助醇提法较其他5种方法在虫草酸提取得率和时间效益上都有较大优势。因此,选择超声辅助醇提法为北虫草CNZ的初始虫草酸提取方法。
2.3 虫草酸提取方法的优化
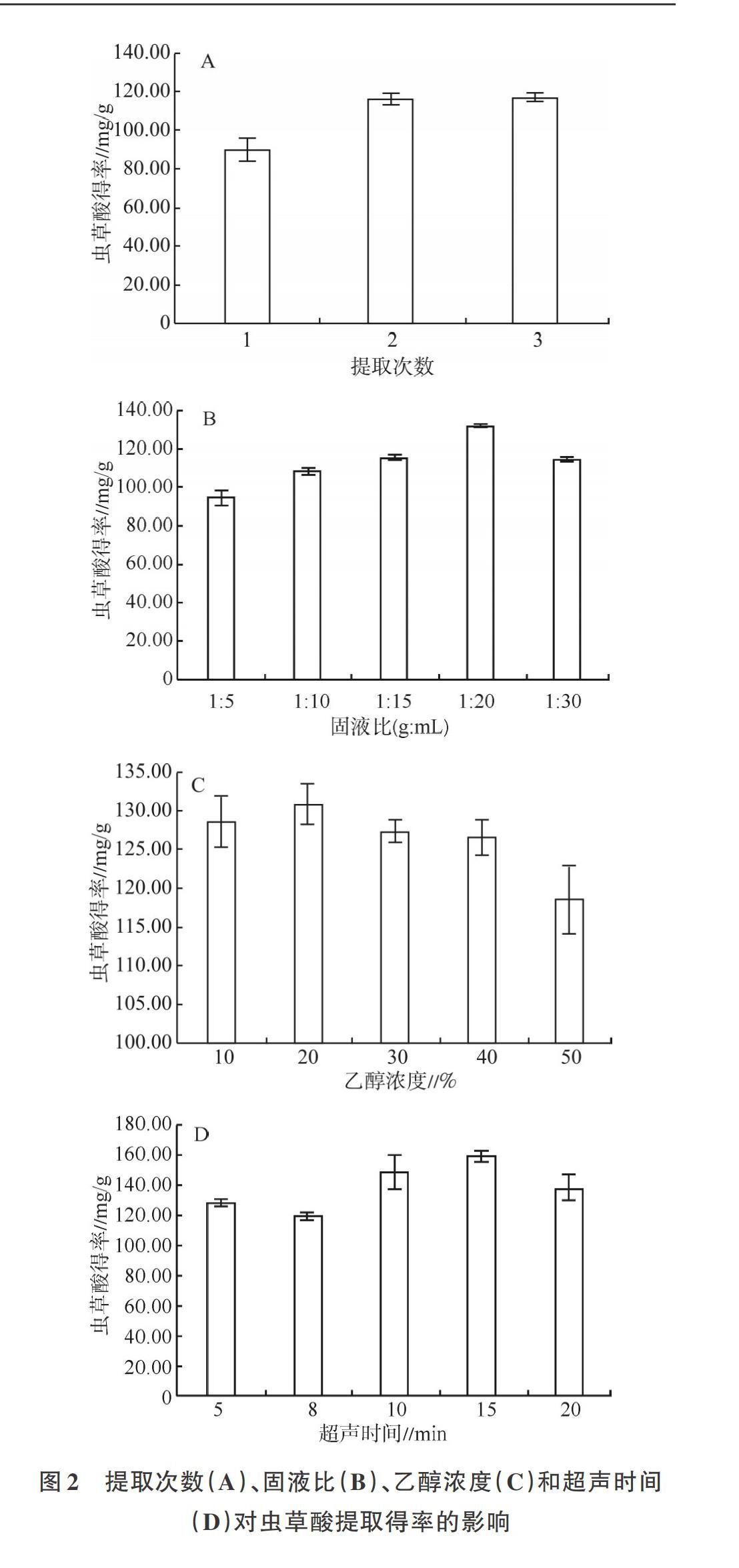
2.3.1 单因素优化试验 采用单因素法分析不同的提取次数、固液比、乙醇浓度和超声时间对北虫草cNz虫草酸提取得率的影响(图2),结果表明,提取3次的虫草酸得率最高,为117.32mg/g(图2A),比提取2次(116.12mg/g)的虫草酸得率高1.2mg/g;1:20固液比的虫草酸得率为132.34mg/g,高于其他固液比的得率(图2B);20%乙醇的虫草酸得率为130:88mg/g,高于其他浓度乙醇的得率(图2C);15min超声时间的虫草酸得率为159.56mg/g,高于其他超声时间(图2D)。
2.3.2 正交优化试验 进一步采用4因素3水平正交试验分析提取次数、乙醇浓度、固液比和超声时间对北虫草CNZ虫草酸提取效率的影响(表2),结果表明,最优的提取条件组合是A3B2C1D3,即提取次数为3次,乙醇浓度为20%,固液比为1:10(g:mL),超声时间为20min.该条件下,北虫草CNZ的虫草酸得率为161.06mg/g,与初始提取条件相比提高了42.1%。通过极差分析可知,4个因素对虫草酸得率的影响程度为提取次数>超声时间>乙醇浓度>固液比。
3 小结与讨论
分别以乙醇和蒸馏水做提取剂,采用热浸法、超声辅提法和超声-热浸协同法3种提取技术,共组合了6种虫草酸提取方法,分别提取北虫草CNZ的虫草酸,发现对于北虫草CNZ,超声辅提法比热浸法以及超声一热浸协同法的虫草酸得率高。而钟艳梅等[13]报道,对其研究的蛹虫草而言,超声一热浸协同法的虫草酸提取效率要优于超声辅提法和热浸法。不同虫草菌的虫草酸提取方法不一样,可能反映了菌株之间的差异。因此,针对新分离的北虫草CNZ,建立其特异的虫草酸提取方法是必要的。本研究也发现对于北虫草CNZ,乙醇提取剂比水提取剂的虫草酸得率高。这与张萍等[9]和闫文娟等[11]的报道一致,原因可能是乙醇具有较好的穿透细胞壁的能力,有助于破坏细胞膜,增加虫草酸的浸出[12]。因此,本研究选择超声辅助醇提法作为北虫草CNZ的初始虫草酸提取方法,并进一步通过优化提取次数、固液比、超声时间、乙醇浓度等条件,建立了较适宜的提取方法,相比初始提取条件,虫草酸得率提高了42.1%。
闫文娟等[11]报道广东虫草发酵菌丝的虫草酸含量为11.28%;林群英等[19]报道广东虫草的虫草酸含量为15.1%,高于冬虫夏草和蛹虫草;蔡友华礫[20]报道巴西虫草的虫草酸含量为12.05%。本研究报道的北虫草菌CNZ的虫草酸含量约为16.11%(161.06mg/g),属于虫草酸产量较高的菌株,具有潜在的应用价值。而本研究建立的北虫草CNZ的虫草酸提取方法,可为该菌株的大规模发酵及生产研究提供参考。
参考文献:
[1]钟石,计东风,陈诗,等.蛹虫草研究进展[J].蚕桑通报,2007,38(1):6-10.
[2]黄振峰,尹导群,陈丽,等.蛹虫草菌丝体胞内多糖提取方法的研究[J].华南师范大学学报(自然科学版),2018,50(6):69-74.
[3]李文庆,李文佳,董彩虹,等.冬虫夏草繁育品和野生品虫草酸含量比较[J].菌物研究,2018,16(2):102-105.
[4]丁浩,安超,薛文娇,等.一株冬虫夏草菌的鉴定及其抗氧化特性研究[J].湖北农业科学,2019,58(3):57-60.
[5]JANE S H,KIM SH,LEE H Y,et al.Immune-modulating activityof extract prepared from mycelial culture of Chinese caterpillarmushroom,Ophioeordyceps sinensis(Ascomycetes)[J].Internationaljournal of medicinal mushrooms,2015,17(12):1189-1199.
[6]周毓麟,李兰洲,胡文继,等.蝙蝠蛾拟青霉质量标准及免疫活性研究[J].中南民族大学学报(自然科学版),2017,36(1):24-27.
[7]陆秀华,刘琳.微波辅助乙醇硫/硫酸銨双水相提取分离蛹虫草发酵产物中虫草素和虫草酸的研究[J].食用菌学报,2017,24(4):71-77.
[8]蔡仲军,尹定华,秦松云_不同预处理对冬虫夏草甘露醇含量测定的影响[J].广西中医学院学报,2002,5(4):75-77.
[9]张萍,周玉春,杨明,等.HPLC-RID测定冬虫夏草及发酵虫草制剂中虫草酸的含量[J].药物分析杂志,2016,36(9):1671-1678.
[10]邓黎,韩涛,王晓虹,等.响应面法优化人工蛹虫草子实体中虫草酸微波提取工艺[J].天然产物研究与开发,2013,25(9):1249-1254.
[11]闫文娟,李泰辉,姜子德.比色法测定广东虫草虫草酸含量[J].食用菌,2010,32(5):73-74,78.
[12]蒋永红,张晓峰,韩萍,等.杂粮蛹虫草菌丝共生体中虫草酸的优化提取及含量测定[J].河南工业大学学报(自然科学版),2017,38(1):88-93.
[13]钟艳梅,高榆亮,曾宪录.超声波一浸提结合法提取蛹虫草培养残基甘露醇[J].广东农业科学,2011,38(15):70-72.
[14]杨玉红,刘芳,康宗利,等北虫草菌种人工分离的研究[J].中国食用菌,2012,31(1):11-12.
[15]赵润,郭成金.冬虫夏草菌丝体液体培养基的优化[J].天津师范大学学报(自然科学版),2008,28(1):8-11.
[16]程秀芳,杨军方,施安辉,等.紫外分光光度法测定冬虫夏草中D-甘露醇的含量[J].齐鲁药事,2006,25(5):286-287.
[17]蔡友华,范文霞,刘学铭,等.比色法测定巴西虫草菌丝体中虫草酸的含量[J].现代食品科技,2008,24(1):76-79.
[18]李建平,赵秋蓉,吴迪,等.冬虫夏草中虫草酸的提取条件优化与纯化研究[J].农产品加工·学刊,2012(7):49-51.
[19]林群英,李泰辉,宋斌,等.广东虫草与冬虫夏草及蛹虫草的成分比较[J].食用菌学报,2009,16(4):54-57.
[20]蔡友华,范文霞,刘学铭,等.超声-微波协同萃取巴西虫草菌丝体中甘露醇的研究[J].江西农业大学学报,2008,30(2):348-353.
收稿日期:2019-08-22
基金项目:国家自然科学基金(31370118;31770134);“武陵山区特色资源植物种质保护与利用湖北省重点实验室建设”基金项目(2018BFC360);中南民族大学基本科研业务费专项资金资助项目(CZT18005,18006,18007)。
作者简介:林爱华(1977-),女,山东烟台人,讲师,博士,主要从事应用生物化学研究,(电话)027-67842689(电子信箱)lah1999@163.com;通信作者,张鹏(1977-),男,副教授,博士,主要從事药用植物与药用微生物研究,(电话)027-67842689(电子信箱)zhangpenghust@126.com。
