miRNA-21 调控HER-2 阳性乳腺癌的血管生成
2020-08-12唐诗聪杨德春赵英竹刘德权王晓莉唐一吟
唐诗聪,陈 东,郭 瑢,杨德春,赵英竹,谢 吕,张 潜,刘德权,王晓莉,唐一吟
(1)云南省肿瘤医院,昆明医科大学第三附属医院乳腺外一科;2)超声医学科;3)乳腺外二科,云南昆明 650118;4)广西壮族自治区人民医院肝胆胰腺乳腺甲状腺外科,广西南宁 530021;5)云南省红河州妇幼保健院乳腺保健科,云南蒙自 661100;6)云南省肿瘤医院,昆明医科大学第三附属医院放射治疗科,云南昆明 650118)
乳腺癌是女性最常见恶性肿瘤之一,发病机制复杂,临床表现多样,肿瘤的侵袭和转移是导致乳腺癌患者死亡的主要原因[1]。HER-2 阳性乳腺癌是乳腺癌中的一种,该亚型乳腺癌增殖能力强,预后差[2]。约有25%~30%乳腺癌患者的癌组织表达HER-2[2]。抗HER-2 治疗能给患者带来较好的预后,但HER-2 阳性乳腺癌的生物学行为仍有未解之谜。
实体瘤与肿瘤血管新生关系密切,肿瘤会因为缺乏养分、生长因子以及氧气的供给而限制生长[3]。研究表明实体肿瘤在距离功能血管≥70 μm处便会出现缺氧现象,在不能诱导血管新生的肿瘤中,肿瘤大小不会超过1~2 mm[4]。恶性肿瘤自身强大的诱导血管生成能力是其不断增殖并远处转移的一个重要因素[5]。因此研究肿瘤的血管生成是肿瘤研究领域的一个热点问题。
MicroRNA (miRNA)是一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA 分子,它们在动植物中参与转录后基因表达调控[6]。miRNA 参与体内70%以上基因的调控,包括癌基因、编码血管新生相关蛋白的基因、编码降解细胞外基质分子的基因等[7]。miR-21 是miRNA 的一种,近年有研究报道[8]miR-21 在癌和癌旁组织中存在差役表达,并且其过表达可能和肿瘤生物学行为相关。也有研究[9]提示miR-21 可能有促进血管新生的作用。但miR-21 在HER-2 阳性乳腺癌中的作用则仍有未解之谜。本课题拟通过研究miR-21 在HER-2 阳性乳腺癌的表达,并探讨其对HER-2 阳性乳腺癌细胞血管新生的影响,与肿瘤侵袭和转移关系,为乳腺癌血管新生中的作用和机制提供新理论和实验依据。笔者通过研究,为防治乳腺癌细胞转移寻找新的分子标志物和潜在的重要靶点奠定基础。
1 材料与方法
1.1 材料
1.1.1 组织标本40 例肿瘤组织标本和癌旁正常组织标本取自云南省肿瘤医院乳腺外一科标本库。所有患者术前均未接受化疗并签署知情同意书。所有标本术后均经云南省肿瘤医院病理科诊断为HER-2 过表达型乳腺癌(ER 阴性、PR 阴性、HER-2 阳性)。标本获得年限均为2019 年。本次研究通过云南省肿瘤医院伦理审查委员会同意。
1.1.2 试剂及材料实验所用MCF-10A 和SKB-R3 细胞购自中科院上海细胞库。HBSS 缓冲液和胎牛血清(购自Invitrogen),TaKaRa Universal RNA Extraction Kit(云南泽浩商贸有限公司)、PrimeScript RT reagent Kit (云南泽浩商贸有限公司)、SYBRPremix Ex TaqTMII(云南泽浩商贸有限公司)、引物合成(广西科迪试剂公司)、miR-21 inhibitor 与阴性对照(广州锐博公司)、抗-VEGF (1:2000 稀释;Abcam,ab32152),二-抗羊抗兔IgG H&L (HRP)(1:1000 稀释;Abcam,ab205718)、Lipofectamine2000(Invitrogen)、蛋白裂解液(南京诺唯赞生物科技有限公司)、CCK8试剂(云南泽浩商贸有限公司)、Matrigel 胶(购自Corning)。免疫组化试剂由云南省肿瘤医院/昆明医科大学第三附属医院病理科提供。
1.2 实验方法
1.2.1 细胞培养在内含MCF-10A 或SKB-R3 细胞的培养瓶中加入含有RPMI-1640 的完全培养液(内含10 mL 的10%胎牛血清)之后放在细胞培养箱中培养,培养条件为5% CO2、37℃饱和湿度。每天观察细胞状态,2~3 d 进行传代。
1.2.2 miR-21 inhibitor 转染miR-21 抑制剂序列5'-UCAACAUCAGUCUGAUAAGCUA-3',阴性对照序列(Negative contro)l 5'-CAGUACUUUUGUG UAGUACAA-3'。细胞培养24 h 后根据说明,采用Lipofectamine2000 转染100 nM 的抑制剂或阴性对照序列至SKB-R3 细胞。之后确认转染效率。
1.2.3 RNA 提取以及荧光定量 PCR(qRT-PCR)将未行转染的SKB-R3 细胞、分别转染miR-21 抑制剂和阴性对照序列(Negative control)的细胞以及MCF-10A 培养24 h。使用TaKaRa Universal RNA Extraction Kit 提取RNA。再将组织剪碎之后同样方法提取组织RNA。再加入PrimeScript RT reagent Kit 试剂,在PCR 仪中37℃15 min 之后85℃5 s 处理完成逆转录。再加入SYBRPremix Ex TaqTMII 试剂以及引物完成荧光定量PCR。miR-21 上游引物:5'-ACGTTGTGTAGCT TATCAGACTG-3。下游引物:5'-AATGGTTGTTCT CCACACTCTC-3'。内参U6上游引物 :5'-ATTGGAACGATACAGAGAAGATT-3'下游引物:5'-GGAACGCTTCACGAATTTG-3。
1.2.4 蛋白质印迹(Western blotting)取培养瓶中对数期生长的细胞,去除培养液。PBS 洗涤后,再加入RIPA 与PMSF 混合的裂解液,混匀之后置于充分裂解20 min。把裂解下的细胞液转移至1.5 mL EP 管中。取干净玻璃板对齐夹紧于架子上,在玻璃板中制备分离胶和浓缩胶之后上样。置于电泳槽,浓缩胶80 V,分离胶120 V,开始电泳。备0.22 μm PVDF 膜,浸泡在甲醇中5 min,在PVDF膜上覆盖滤纸,置于夹子中夹好。再放入转膜槽,150 mA 转移2.5 h 开始转膜。时间到后取出PVDF膜,见PVDF 膜上已有Marker。PBS 漂洗后封闭。放入一抗稀释液中,4 ℃下置于摇床,孵育过夜。后取出PVDF 膜,室温放置,PBS 浸泡。将膜放入二抗稀释液中,置于摇床,室温条件下孵育2 h。之后Bio-rad 扫膜显影。
1.2.5 CCK8 实验取对数期生长的细胞,常规消化,重悬细胞,制备成细胞悬液,调整细胞浓度至4×105个/mL。取250 μL 上述细胞悬液稀释,调整总体积至5 000 μL,调整浓度为2 000 个细胞/100 μL,在96 孔板的每个孔滴加100 μL 细胞悬液,共设4 个时间节点(0 h,24 h,48 h,72 h),加CCK-8 试剂10 μL,孔板放在5% CO2、37℃的培养箱中继续培养,在酶标仪内检测在450 nm 吸光度。
1.2.6 Transwell 侵袭迁移实验把Matrigel 胶放置于4℃冰箱过夜,溶解Matrigel 胶。稀释Matrigel胶至终浓度为3 mg/mL。在每孔Transwell 小室的上层小室加入已稀释过的Matrigel 胶60 μL,平稳摇动,使其完全覆盖,把已铺基底膜的Transwell 小室24 孔板放入37℃培养箱培养30 min。去除基底膜并水化。取饥饿处理厚的对数细胞常,制备细胞悬液,控制细胞终浓度为5×105个/mL。在24孔板Traswell 小室下层小室加入完全培养液700 μL,清除上下层小室接触面气泡,培养24 h,条件为5%CO2、37 ℃。取出上层小室,去除培养液,PBS 洗涤,甲醇固定,用0.1%结晶紫染色,PBS洗涤。把Transwell 小室倒置,计数并拍照。
1.3 统计学处理
使用SPSS 软件进行统计学处理。患者基线特征的比较通过χ2检验完成。数据符合正态分布,2 组间比较采用单因素t检验完成。使用Kmplot 数据库(http://kmplot.com/)进行Kaplan-Meier 生存分析。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-21 在HER-2 阳性乳腺癌的表达
所有病例均是HER-2 过表达型乳腺癌(ER阴性、PR 阴性、HER-2 阳性)。超声诊断可见其边缘不整,血供丰富(见图1A);病理学免疫组化诊断可见HER-2 强阳性(见图1B);对于HER-2++患者,FISH 诊断提示HER-2 基因扩增(见图1C)。QPCR 实验结果提示miR-21 在乳腺癌组织中高表达,在癌旁组织中低表达(P<0.001,见图2A);Kmplot 数据库进行生存分析结果提示miR-21 在乳腺癌中过表达与低表达的预后差异无统计学意义(P=0.47,见图2B),在HER-2 阳性型乳腺癌中该现象仍然存在(P=0.26,见图2C)。之后,将miR-21 表达量分为高表达与低表达,并分析了其在HER-2 过表达乳腺癌患者中与临床基线特征的关系,见表1。
2.2 miR-21 对HER-2 阳性乳腺癌细胞增殖和侵袭的影响
miR-21 在乳腺癌正常细胞MCF-10A 中低表达,而在HER-2 过表达乳腺癌细胞SKB-R3 中高表达(P<0.01,见图3A)。之后分别转染miR-21抑制剂和阴性对照组序列至SKB-R3 细胞(见图3B)。之后GFP 荧光确认转染效率(见图3C)。通过CCK8 实验,发现抑制miR-21 表达之后细胞增殖能力下降(P<0.05,见图3D),Transwell 实验也证实抑制miR-21 表达之后细胞侵袭能力下降(P<0.001,见图3E)。
2.3 miR-21 对HER-2 阳性乳腺癌血管生成的影响
为了探讨miR-21 对HER-2 阳性乳腺癌血管生成的影响,笔者选择促血管生成的VEGF 作为研究对象,通过Western blotting 实验发现SKB-R3细胞转染miR-21 抑制剂后VEGF 表达下降,而转染阴性对照组序列的细胞VEGF 表达量未下降,见图4。miR-21 抑制剂使得VEGF 表达下降,阴性对照组序列不能下调VEGF 表达。
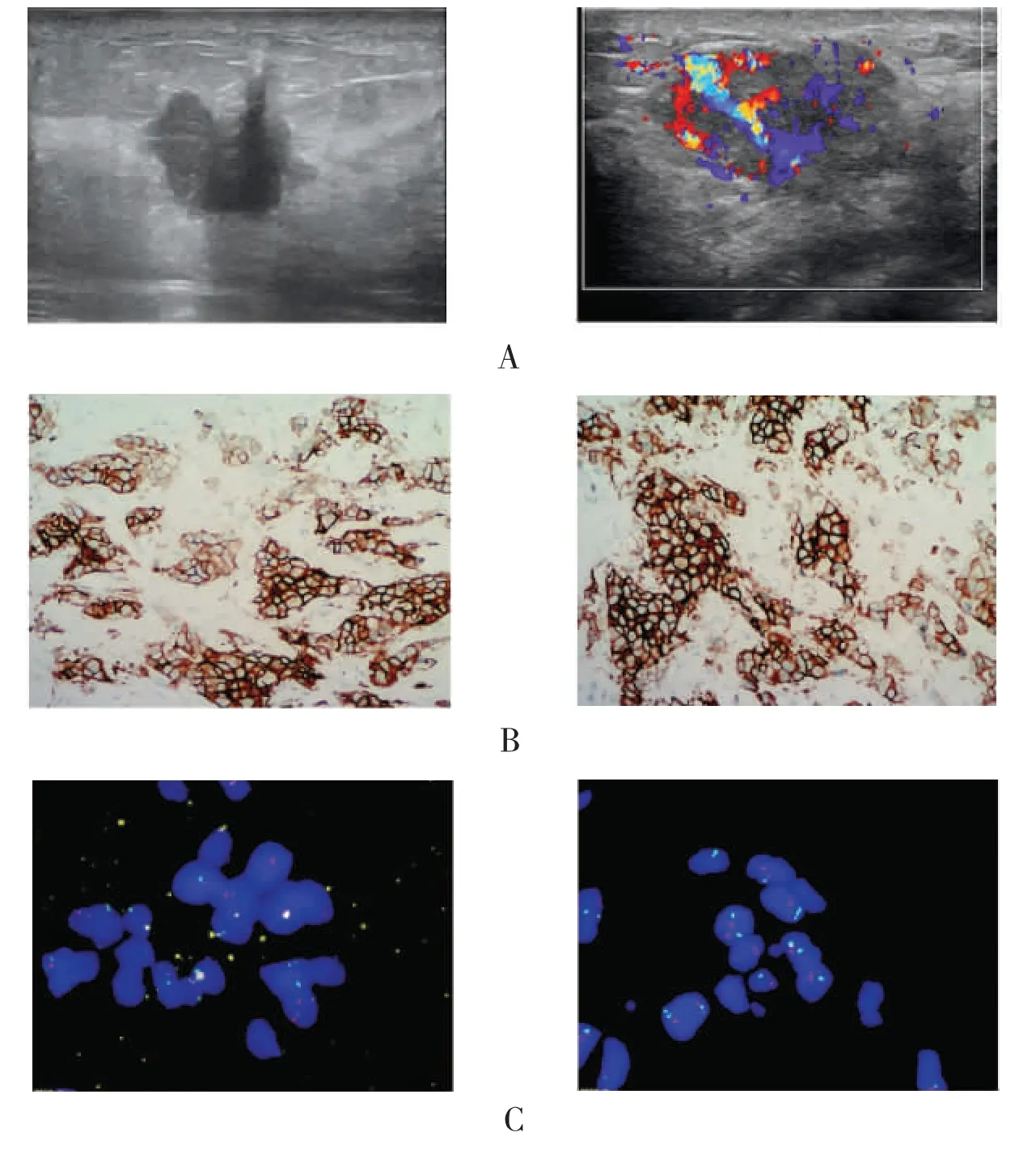
图1 HER-2 阳性乳腺癌的诊断(×100)Fig.1 The diagnosis of breast cancer with HER-2 positive (×100)
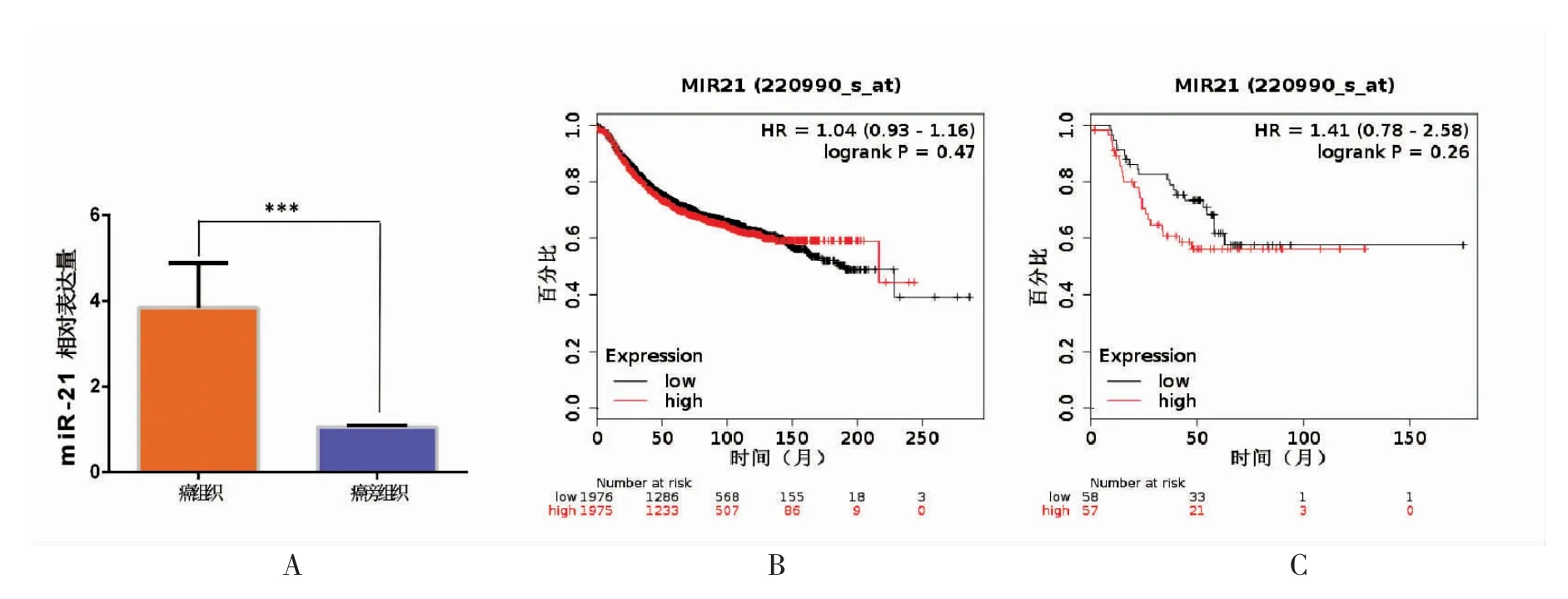
图2 miR-21 在组织的表达与预后Fig.2 The expression of miR-21 in tissues and its prognosis
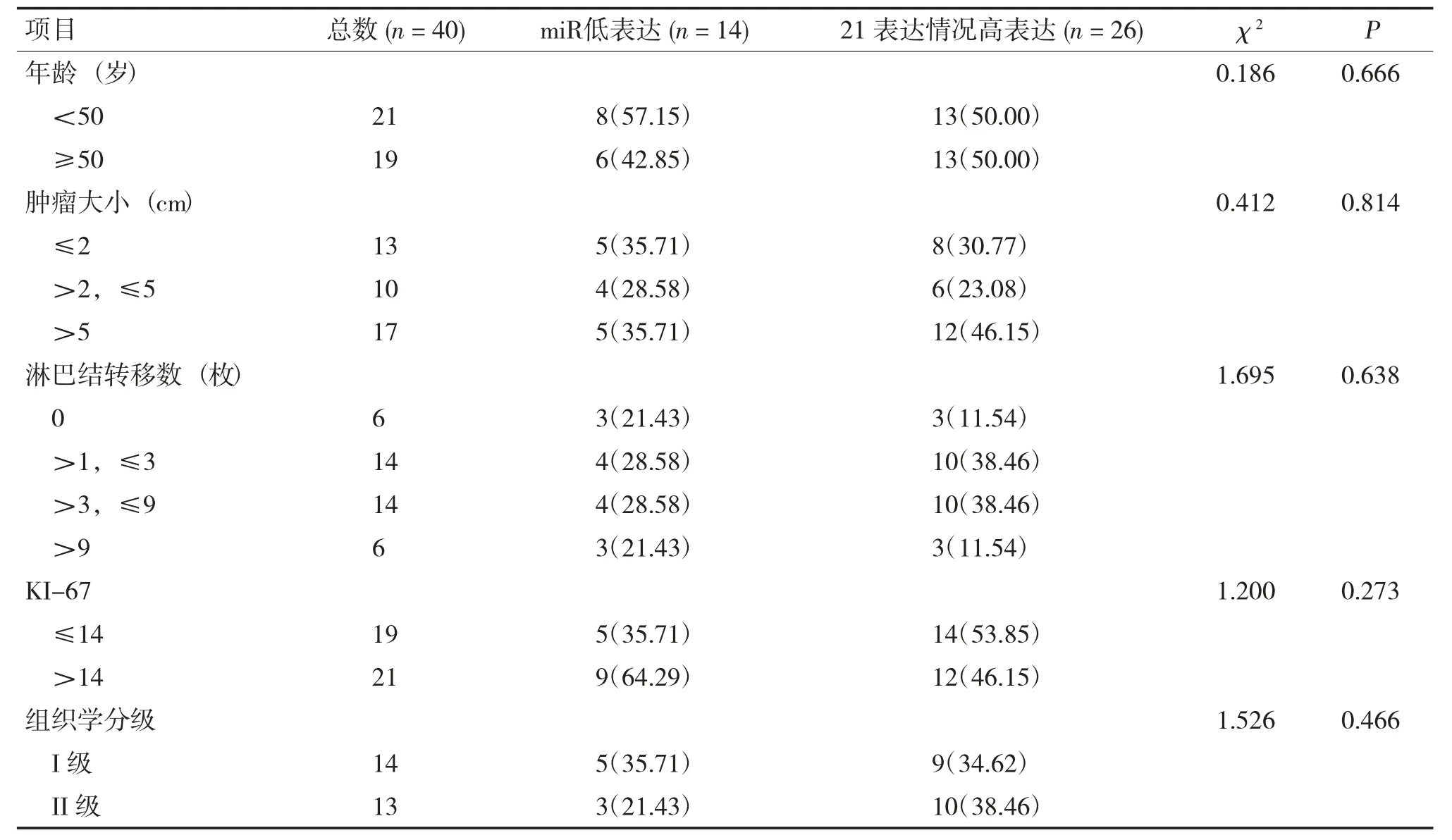
表1 miR-21 表达情况与40 例乳腺癌患者基线特征[n=40,n(%)]Tab.1 The correlation of expression of miR-21 and baseline with 40 breast cancer patients [n=40,n(%)]

图3 miR-21 对HER-2 阳性乳腺癌细胞增殖和侵袭的影响Fig.3 miR-21 influenced the proliferation and invasion of HER-2 positive breast cancer
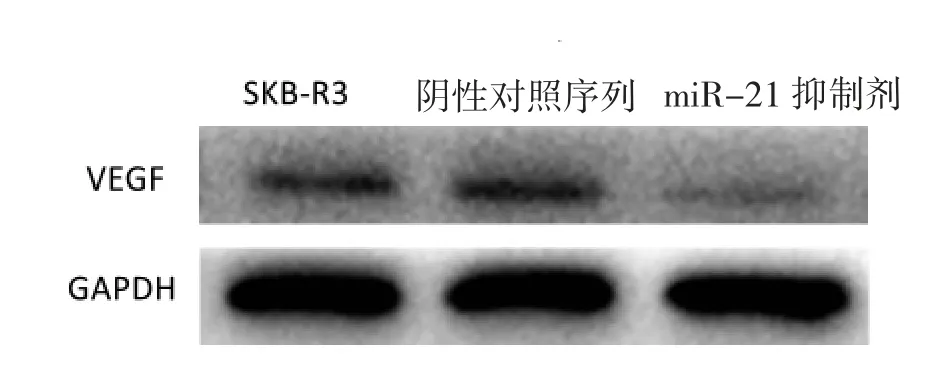
图4 miR-21 对HER-2 阳性乳腺癌血管生成的影响Fig.4 miR-21 influenced the angiogenesis of HER-2 positive breast cancer
3 讨论
MiRNA-21 在肿瘤的发生及转移方面起着十分重要作用,甚至成为某些肿瘤的标志分子[10-11]。miR-21 在多种癌中都存在差异表达:Deng 等[12]学者研究发现,结肠癌细胞株中miRNA-21 的含量低于正常细胞。Alanazi I O[13]等则发现miRNA-21在肺癌中过表达。Zhang C[14]等学者研究认为miRNA-21 在乳腺癌组织中高表达,而在癌旁组织中低表达。笔者通过实验发现miR-21 是一个癌基因,在HER-2 阳性型乳腺癌中过表达,在癌旁组织中低表达。该研究结论与Zhang C 等[14]相仿。因此笔者认为miR-21 在HER-2 阳性乳腺癌的表达由一定诊断价值。在进一步的生存分析中笔者发现,无论是在乳腺癌所有患者或者在HER-2 过表达患者中,OS 在miR-21 高低表达组中差异无统计学意义,因此认为miR-21 的过表达对预后并不能产生影响。
MiR-21 虽然不能对肿瘤预后产生影响,但是现在有不少研究认为miR-21 可对肿瘤生物学行为产生一定的影响。Wang T[15]等发现miR-21 可通过激活PI3K/AKT 通路促进结肠癌增殖并抑制凋亡。Zhang C[14]等则发现在乳腺癌细胞中,miR-21 可通过抑制STAT3 的表达进而促进乳腺癌的增殖和远处转移。笔者本次实验发现在高表达miR-21 的HER-2 阳性乳腺癌细胞株中抑制miR-21 表达后,细胞的增殖和侵袭能力均减弱。由此,笔者认为miR-21 过表达可促进HER-2 阳性乳腺癌的生长和转移,对其生物学行为的调控能发挥一定的作用。
恶性肿瘤自身诱导血管生成是其生长的重要部分[16]。血管内皮生长因子是目前已知的促进血管新生功能最为明确的一类细胞因子,包括VEGFA、VEGFB、VEGFC 等多种亚型[17]。恶性肿瘤中过表达这些因子能够通过与细胞膜上的受体VEGFR 结合来激活下游P13K、EKR、AKT 等信号通路,进而促进血管内皮细胞的生长,进而促进肿瘤的增殖、迁移[18]。目前关于miR-21 在HER-2 阳性乳腺癌中对血管生成的影响还未见文献报道。笔者通过体外实验发现抑制miR-21 表达,能够下调SKB-R3 细胞中VEGF 的表达。因此认为miR-21有潜在的调控HER-2 阳性乳腺癌血管生成的能力。在该科学问题的报道上,该研究具有较大的创新性和原创性。因为本次研究缺乏体内实验的研究,故数据有待在下一步研究中更加完善。
笔者通过本次研究发现了miR-21 是一种肿瘤基因,在HER-2 阳性乳腺癌中过表达,但其过表达不会影响预后。miR-21 可促进HER-2 阳性乳腺癌的增殖和侵袭,并且抑制miR-21 的表达可抑制血管生成因子VEGF 的表达,因此认为miR-21 对HER-2 阳性乳腺癌的血管生成有一定的调控作用。希望本次研究的结论能为鉴定防治乳腺癌细胞转移新的分子标志物和潜在的重要靶点奠定基础。
