siRNA 干扰胸腺基质淋巴细胞生成素对哮喘小鼠气道炎症的影响
2020-08-12李艳丽邢西迁刘艳红周玉山
李艳丽,邢西迁,刘艳红,周玉山,庄 敏,肖 谊
(1)昆明市延安医院,昆明医科大学附属延安医院,呼吸与危重症医学科一病区,云南昆明 650051;2)云南省第二人民医院呼吸与危重症医学科,云南昆明 650021)
支气管哮喘(简称哮喘)是一种全球范围内常见的呼吸道疾病,全球患病率急剧上升,经济负担重[1]。据统计,我国哮喘患者大约在3 000 万以上,且有逐年增高的趋势[2]。气道上皮细胞在启动和调节气道的固有免疫和适应性免疫中发挥重要作用[3]。胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)是一种由气道上皮分泌的细胞因子,大量的研究证实,TSLP 在哮喘中高表达[4]。研究证实,TSLP 通过激活树突状细胞诱导CD4+T 细胞向Th2 分化发育,从而加重哮喘气道炎症[5]。RNA 干扰技术是将外源性双链RNA 引入细胞内抑制同源基因表达,不同于传统的基因敲除,而是通过降解同源序列的靶mRNA 从而抑制基因的表达;该技术可特异性的沉默致病基因、阻止特定疾病的发生。因此,笔者构建小鼠哮喘模型,检测小鼠气道上皮细胞中TSLP mRNA 和蛋白的表达水平;并进一步观察TSLP siRNA 干预后对哮喘小鼠气道炎症的影响,以期为哮喘的治疗提供理论依据和新方向。
1 材料与方法
1.1 实验动物
24 只BALB/c 雌性小鼠,鼠龄6~8 周,体重18~22 g,购自成都达硕实验动物有限公司。
1.2 实验材料和试剂
24 只BALB/c 小鼠(雌性,6~8 周龄)购自成都达硕实验动物有限公司,卵白蛋白(OVA,Ⅳ级)Sigma 公司产品,ELlSA 试剂盒购自深圳晶美生物公司,Trizol 试剂、逆转录试剂盒及荧光定量试剂盒均购于Vazyme 公司;引物由上海捷瑞公司合成,RT-PCR 试剂盒购自天根公司,TSLP siRNA 购自SANTA 公司,DAB 显色试剂盒购自北京中衫金桥生物技术有限公司;Finepointe NAM 系统小鼠无创肺功能仪(BUXCO 公司,美国)。
1.3 实验方法
1.3.1 动物分组及模型的建立 24 只清洁级BALB/c 小鼠,体质量(18~22)g,分为对照组(Control)、模型组(Model)和模型+TSLP siRNA干预组(M+TSLP siRNA),每组8 只。模型组于第0、7、14 天腹腔内注射OVA-氢氧化铝混悬液(50 μg OVA+2 mg 氢氧化铝凝胶混合于200 μL PBS溶液中),在第21、22、23 天使用OVA 溶液(100 ug OVA 溶于40 μL PBS)滴鼻构建哮喘模型。TSLP siRNA 干预组则在第21~23 天激发前30 min给予腹腔注射TSLP siRNA 125 μL给予干预。对照组致敏与激发均以PBS 代替OVA。各组小鼠在末次激发后24 h 内行肺功能检测测定气道反应性,随即处死小鼠并取材。所有动物程序均按照“实验动物福利法”和“实验动物饲养管理和使用指南”进行[6]。
1.3.2 小鼠气道反应性的测定在最后一次OVA激发24 h 后进行,4%的戊巴比妥溶液(90 mg/kg)腹腔注射麻醉,分离暴露气管,插入套管,并与电脑控制的小动物肺功能仪相连。设定呼吸机参数,呼吸频率150 次/min,潮气量10 mL/kg,呼气末正压为2 cmH2O,接近小鼠自主呼吸时的平均肺容积。每只小鼠依次用PBS 溶液、6.25 mg/mL、12.5 mg/mL、25 mg/mL、50 mg/mL 浓度的 Mch(Methacholine,乙酰甲胆碱)进行激发,测定气道阻力的变化。
1.3.3 BALF 的收集及组织标本制备小鼠仰卧位固定麻醉后,气管插管,1 mL 冰磷酸盐缓冲液(PBS)灌洗右肺3 次,并回收灌洗液体,约2.5 mL/鼠,离心后取上清液,得到支气管肺泡灌洗液(BALF),离心收取上清液进一步行ELISA 检测。打开胸腔,取右肺中叶,4%多聚甲醛固定,待苏木精-伊红(hematoxylin-eosin staining,HE)染色病理检查,余肺组织-80℃冻存用于RT-qPCR 及Western blot 分析。
1.3.4 RT-qPCR 法检测TSLP mRNA 的表达水平按照Trizol 试剂说明书进行肺组织总RNA 提取,反转录cDNA,在PCR 仪上扩增。应用Primer Premier 5.0 软件进行引物设计。TSLP:上游引物5'-CGGATGGGGCTAACTTACAA-3',下游引物:5'-AAATGTTTTGTCGGGGAGTG -3'; β-actin:上游引物5'-AGCCATGTACGTACGTAGCCATCC-3',下游引物:5'-CTCTCAGCTGTGGTGGTGAA-3'。反应条件为:95℃预变性5 min;95℃变性15 s,60℃退火1 min,72 ℃延伸30 s,共40 个循环。记录TSLP 和β-actin 的荧光域值循环数(Ct)值,以β-actin 作为内参基因,以2-△△CT法计算TSLP mRNA 的相对表达量。
1.3.5 Western blot 检测肺组织中TSLP 蛋白的表达情况称取各组小鼠肺组织50 mg,加入RIPA蛋白裂解液500 μL。摇动、离心、取上清液,提取蛋白。将蛋白置于EP 管中,每管50 μg,10%SDS 聚丙烯酰胺凝胶电泳,转至硝酸纤维素膜。再用5%脱脂奶4℃室温封闭过夜,加一抗,水平摇床缓慢摇动2 h,TBS-Tween 洗膜3 次,加入二抗摇床平缓摇动2 h,TBS-Tween 洗膜3 次,ECL 发光剂在X 线光片上曝光、显影、定影。用水冲洗,晾干后,用Band-Scan 软件作灰度扫描分析,以β-actin 蛋白作为内参照,对结果进行分析。应用图像分析软件分析三组中TSLP 蛋白的灰度值,同时以扩增的β-actin 蛋白的表达强度作为基准,计算相对系数;表达强度=TSLP 蛋白/β-actin 蛋白的值。
1.4 统计学处理
应用SPSS 软件进行数据统计分析。计量资料数据服从正态分布,以()表示,多组间比较采用单因素方差分析,进一步两两比较用q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠气道反应性的测定
三组小鼠呼气阻力基础值之间无差异,Mch 激发后,模型组在Mch 剂量为25 mg/mL 和50 mg/mL时,AHR 较对照组增加;在Mch 剂量为25 mg/mL和50 mg/mL 时,使用TSLP siRNA 干预的小鼠气道阻力较模型组显著降低,见图1。
2.2 成功构建哮喘小鼠模型的鉴定
对照组小鼠在造模过程中无饮食、行为、呼吸节律异常改变;而模型组小鼠则出现烦躁不安、活动减少、呼吸节律不齐、急促等表现,甚至出现点头呼吸和口鼻紫绀表现。肺组织病理切片HE染色显示(图2):对照组肺组织结构清晰,肺泡壁结构完整,气道上皮结构完整,粘膜下少量炎症细胞浸润;模型组小鼠气道上皮脱落,粘膜下大量炎性细胞浸润和腺体增生,肺泡壁明显增厚,肺泡间隔断裂,肺泡融合增大,血管及支气管周围大量炎性细胞浸润(图中箭头标记处)。与模型组相比,TSLP siRNA 干预组肺泡壁增厚减轻,肺泡间隔断裂减少。
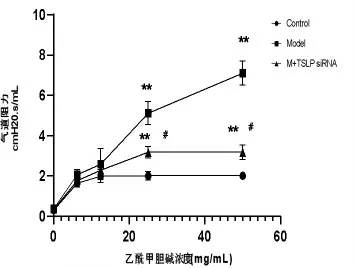
图1 小鼠气道反应性的变化Fig.1 Airway resistance to increasing concentrations of methacholine in mice
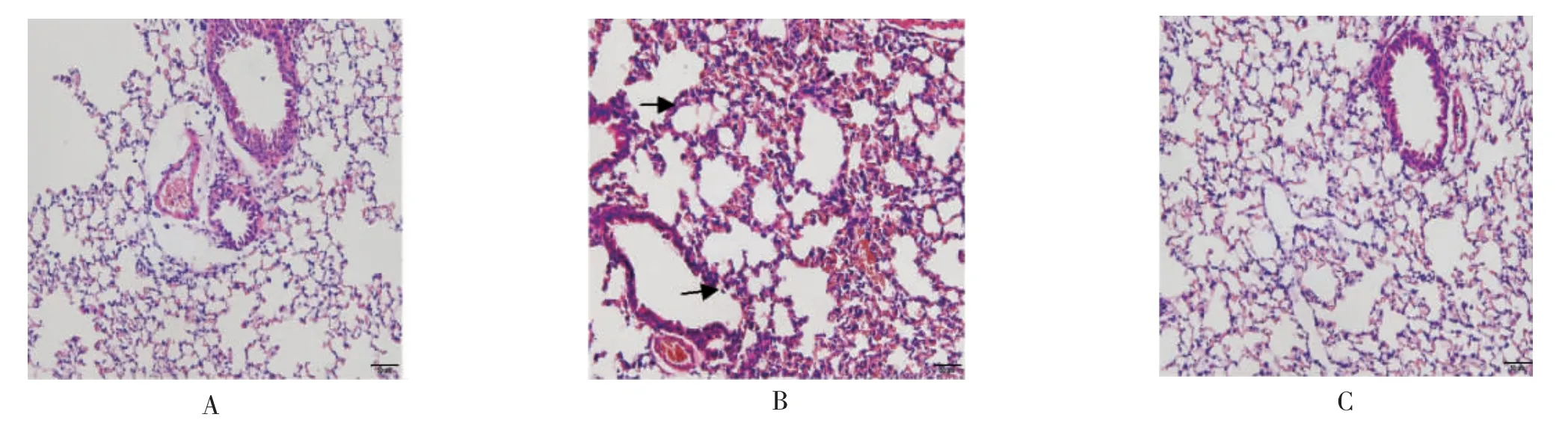
图2 肺组织病理切片HE 染色(10×20)Fig.2 Histopathological changes of lung tissue (HE staining 10×20)
2.3 肺泡灌洗液(BALF)ELISA 检测结果
与对照组相比,模型组BALF 中IL-4、IL-5和IL-13 的水平明显增高,差异有统计学意义(P<0.05);模型+TSLP siRNA 干预组BALF 中IL-4、IL-5 和IL-13 的水平较模型组下降,差异有统计学意义(P<0.05),见图3。
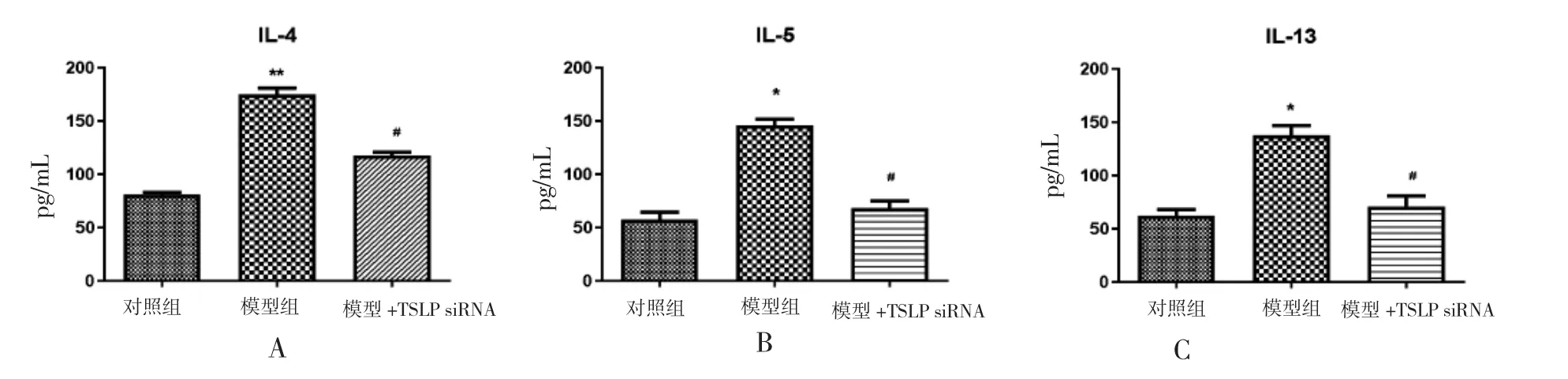
图3 肺泡灌洗液IL-4、IL-5、IL-13 ELISA 检测结果Fig.3 The concentration of IL-4、IL-5 and IL-13 in BALF by ELISA
2.4 各组小鼠肺组织TSLP mRNA 的表达
对照组与模型+TSLP siRNA 干预组TSLP 蛋白的表达水平均明显低于模型组(P<0.01),而模型+TSLP siRNA 干预组较对照组略高,两组间差异无统计学意义(P>0.05),见图4。
2.5 各组小鼠肺组织TSLP 蛋白的表达
与对照组相比,模型组肺组织中TSLP 表达明显增高,两组间差异有统计学意义(P< 0.001);而模型+TSLP siRNA 干预组TSLP 蛋白水平较模型组明显下降,两组间差异有统计学意义(P<0.001),见图5。
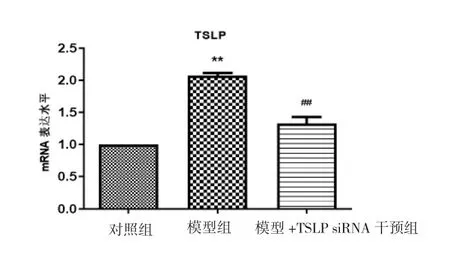
图4 肺组织TSLP mRNA 的表达Fig.4 Expressions of TSLP mRNA in the three groups

图5 Western Blot 检测结果Fig.5 Expressions of TSLP Protein by Western Blot
3 讨论
支气管哮喘是一种慢性气道炎症性疾病,涉及多种炎症细胞和气道结构细胞(气道上皮细胞、平滑肌细胞和成纤维细胞)以及各种细胞因子[7]。目前大量的研究证实[8-9],气道炎症和气道重塑为哮喘最重要的病理特征。而参与哮喘气道慢性炎症的细胞主要为嗜酸性粒细胞、淋巴细胞、中性粒细胞和气道上皮细胞等。实验中,笔者通过OVA 致敏与激发的方法建立哮喘小鼠模型,肺组织病理切片结果与既往报道一致,符合哮喘的病理学改变[10]:与对照组相比,模型组小鼠气道上皮脱落,粘膜下大量炎性细胞浸润和腺体增生,肺泡壁明显增厚,肺泡间隔断裂,肺泡融合增大;血管及支气管周围大量以嗜酸性粒细胞和淋巴细胞为主的炎性细胞浸润。
研究表明,气道上皮细胞在哮喘的病理生理过程中具有重要作用。一方面,它们通过紧密连接形成机械屏障抵御过敏原和其他有害物质的损伤,另一方面当气道上皮细胞受到各种刺激损伤后可释放多种炎性介质和细胞因子(如TSLP、IL-25 和IL-33),参与哮喘的发生和发展。而TSLP 是气道上皮细胞分泌的一种细胞因子,在气道上皮受到损伤时释放[11]。TSLP 对调节气道上皮细胞功能、诱导Th2 免疫应答等具有重要作用[12],且TSLP 可激活髓系树突状细胞增强Th2 型免疫应答和促进Th2 型炎症细胞因子的释放,从而加重炎症反应,在哮喘的发病中发挥重要作用[13]。在笔者的实验中,Real-time PCR 检测发现,模型组TSLP mRNA 的表达水平较对照组明显增高;同时Western blot 结果显示模型组中TSLP 蛋白的表达水平明显高于对照组。研究发现,哮喘模型小鼠TSLP mRNA 表达水平较正常小鼠显著升高,且TSLP 高水平表达可导致转基因小鼠气道出现超敏反应[14]。笔者的研究同样证实哮喘小鼠气道上皮中TSLP 表达水平明显增高。
Zhang 等[15]发现,应用siRNA 沉默CD4+T 细胞的SOCS3 的表达,能减轻哮喘小鼠炎性细胞的浸润、降低白细胞介素4(IL-4)的水平,从而阻止哮喘的发展。Th2 型细胞通过释放白细胞介素5(IL-5)等细胞因子来协调气道过敏性炎症反应。已有研究证实,应用TSLP 抗体可明显降低哮喘气道炎症。哮喘病理生理改变中的气道高反应性、粘液分泌过多和气道重塑,部分是由TSLP 通过其下游的促炎效应驱动的,其中涉及到IL-4、IL-5和IL-13 等细胞因子[16]。基于TSLP 位于炎性级联反应的顶端,使其成为一个具有吸引力的治疗靶点。本研究中采用siRNA 干预TSLP 基因的表达,观察其对气道炎症的影响。研究结果显示:模型组BALF 中Th2 型细胞因子(IL-4、IL-5、IL-13)的水平明显增高;而应用siRNA 干预后,TSLP mRNA 和蛋白的水平较模型组明显下降,同时BALF 中IL-4、IL-5、IL-13 的水平亦显著降低。Lee 等[17]的研究证实,应用TSLP 阻断剂可明显减轻哮喘的气道炎症、气道高反应性和Th2 型细胞因子的表达水平。以上结果说明抑制TSLP 基因表达可有效降低哮喘小鼠气道上皮TSLP 的表达水平,并降低Th2 型细胞因子的表达水平,提示特异性的对TSLP 基因进行抑制可减轻气道炎症。TSLP siRNA 对哮喘气道炎症的作用还需要进一步的研究,包括利用上皮细胞系进行的体外实验。
综上所述,本研究发现在OVA 诱导的小鼠哮喘模型中TSLP 表达水平明显增高,而TSLP siRNA干预可降低哮喘小鼠气道上皮细胞中TSLP 的表达水平,以及Th2 型细胞因子的表达水平,从而减轻哮喘气道炎症和气道高反应性、改善哮喘症状。总之,TSLP 在哮喘中高表达,并且在疾病的发生和发展中发挥重要作用,TSLP 拮抗剂为哮喘治疗的新靶点。而应用TSLP 阻断剂的长期安全性和有效性仍需进行临床研究证实。
