中重度OSAS儿童腺样体扁桃体切除术后持续残留的预测模型构建与鉴定
2020-08-10高淑蔚冯国双吴云肖郑莉郭永丽许志飞
高淑蔚,冯国双,吴云肖,郑莉,郭永丽,许志飞
首都医科大学附属北京儿童医院,北京100045
阻塞性睡眠呼吸暂停综合征(OSAS)是指睡眠过程中频繁发生部分或全部上气道阻塞,扰乱正常通气和睡眠结构而引起的一系列病理生理变化,多发生于2~8岁儿童[1]。OSAS主要临床表现为打鼾、张口呼吸、睡眠不安等,能够引起慢性夜间低氧血症和睡眠碎片化,并增加神经行为异常和心肺相关疾病的发病风险[2]。腺样体扁桃体切除术是OSAS患儿的一线治疗手段。大多数OSAS患儿在腺样体扁桃体切除术后,睡眠呼吸参数和生活质量明显改善[3]。但腺样体扁桃体切除不能使所有OSAS患儿阻塞性睡眠呼吸暂停症状完全恢复正常,术后持续性OSAS的发生率为10%~77%[4,5]。有研究报道,术前较高的呼吸暂停低通气指数(AHI)是影响腺样体扁桃体切除术治疗效果的重要因素之一。因此,中重度OSAS患儿更容易出现术后持续残留[6,7]。术后残留的OSAS症状仍然会引起反复缺氧和睡眠结构紊乱,从而导致神经、心脑血管系统严重并发症[8]。鉴于目前我国医疗资源现状,腺样体扁桃体切除术后无法实现对所有OSAS患儿监测随访。因此,尽早识别OSAS患儿腺样体扁桃体切除术后持续残留的危险因素,有助于临床筛选术后需要随访监测治疗患儿。本研究构建了中重度OSAS患儿腺样体扁桃体切除术后持续残留的预测模型,并鉴定其预测效能。现报告如下。
1 资料与方法
1.1 临床资料 选择2018年7月~2019年12月在首都医科大学附属北京儿童医院行腺样体扁桃体切除术的中重度OSAS患儿75例。纳入标准:①经整夜多导睡眠图(PSG)监测,阻塞性呼吸暂停低通气指数(OAHI)≥5次/h[2];②年龄2~14岁;③接受腺样体扁桃体切除术治疗。排除标准:①合并颅面发育异常、心血管疾病及神经功能紊乱者;②合并脑瘫、Prader-Willi综合征者;③入院前2周内有上呼吸道感染史者。以术后6个月时整夜PSG监测OAHI≥1次/h[9]定义为术后持续性OSAS,将患儿分为持续性OSAS组44例、非持续性OSAS组31例。持续性OSAS组男34例、女10例,年龄(6.2±1.9)岁;非持续性OSAS组男22例、女9例,年龄(5.9±2.6)岁。两组性别、年龄具有可比性。本研究经首都医科大学附属北京儿童医院医学伦理委员会批准,所有患儿监护人知情同意。
1.2 整夜PSG监测 分别于腺样体扁桃体切除术前和术后6个月时行整夜PSG监测。所有患者监测当日自然状态下入睡,入睡前禁止摄入咖啡、茶、可乐及镇静催眠药物,睡眠时间>7 h。采用多导睡眠监测仪监测夜间睡眠的脑电、眼电、肌电、心电及口鼻气流、鼾声、呼吸运动、血氧饱和度等,收集AHI、OAHI、混合性呼吸暂停指数(MAI)、快速动眼睡眠期氧减指数(ODIREM)、非快动眼睡眠期氧减指数(ODINREM)、平均血氧饱和度(mean SpO2)、觉醒指数、总睡眠时间(TST)、睡眠效率及各个睡眠时期占总睡眠时间的百分比等指标。依据美国睡眠医学会标准进行睡眠分期和呼吸事件判定[10]。

2 结果
2.1 OSAS术后持续残留的预测模型构建 以AHI、OAHI、MAI、ODIREM、ODINREM、mean SpO2、觉醒指数、TST、睡眠效率及各个睡眠时期占总睡眠时间的百分比等[3,6.9~11]PSG监测指标作为预测因素,构建分类树模型。该分类树模型共有5层、15个节点、4个终末节点,共筛选出MAI、min SpO2、AHI、ODINREM、睡眠效率、呼吸觉醒指数6个解释变量。在分类树模型中,首先将术后持续性OSAS与非持续性OSAS以MAI进行拆分,以MAI为2.5时作为临界值,划分为MAI≥2.5、MAI<2.5两个亚组,结果发现MAI≥2.5亚组发生持续性OSAS的概率高于MAI<2.5亚组(93.9% vs. 46.1%,P<0.01)。不同MAI水平患儿中筛选出的持续性OSAS预测因素为min SpO2,在MAI<2.5亚组中,以min SpO2为91%时作为临界值进行第2次分类,min SpO2≤91%亚组发生持续性OSAS的概率高于min SpO2>91%亚组(54.8% vs. 11.6%,P<0.01)。不同min SpO2水平患儿中筛选出的持续性OSAS预测因素为AHI,在min SpO2≤91%亚组中,以AHI为14.5时作为临界值再分为两个亚组,AHI<14.5亚组发生持续性OSAS的概率低于AHI≥14.5亚组(36.8% vs. 86.9%,P<0.05)。不同AHI水平患儿中筛选出的持续性OSAS预测因素为ODINREM、睡眠效率,在AHI<14.5亚组中,以ODINREM为4.6时作为临界值,ODINREM≥4.6亚组发生持续性OSAS的概率高于ODINREM<4.6亚组(96.7% vs. 59.1%,P<0.05);在AHI≥14.5亚组中,以睡眠效率为87.2%时作为临界值,睡眠效率<87.2%亚组发生持续性OSAS的概率高于睡眠效率≥87.2%亚组(67.8% vs. 16.7%,P<0.01)。不同睡眠效率水平患儿筛选出的持续性OSAS预测因素为觉醒指数、min SpO2,在睡眠效率<87.2%亚组中,以觉醒指数为6.3时作为临界值,觉醒指数≥6.3亚组发生持续性OSAS的概率高于觉醒指数<6.3亚组(93.9% vs. 35.9%,P<0.05);在睡眠效率≥87.2%亚组中,以min SpO2为74%时作为临界值,min SpO2<74%亚组发生持续性OSAS的概率高于min SpO2≥74%亚组(43.3% vs. 3.3%,P<0.05)。OSAS术后持续残留的分类树模型见图1,各节点高风险人群筛选结果见表2。
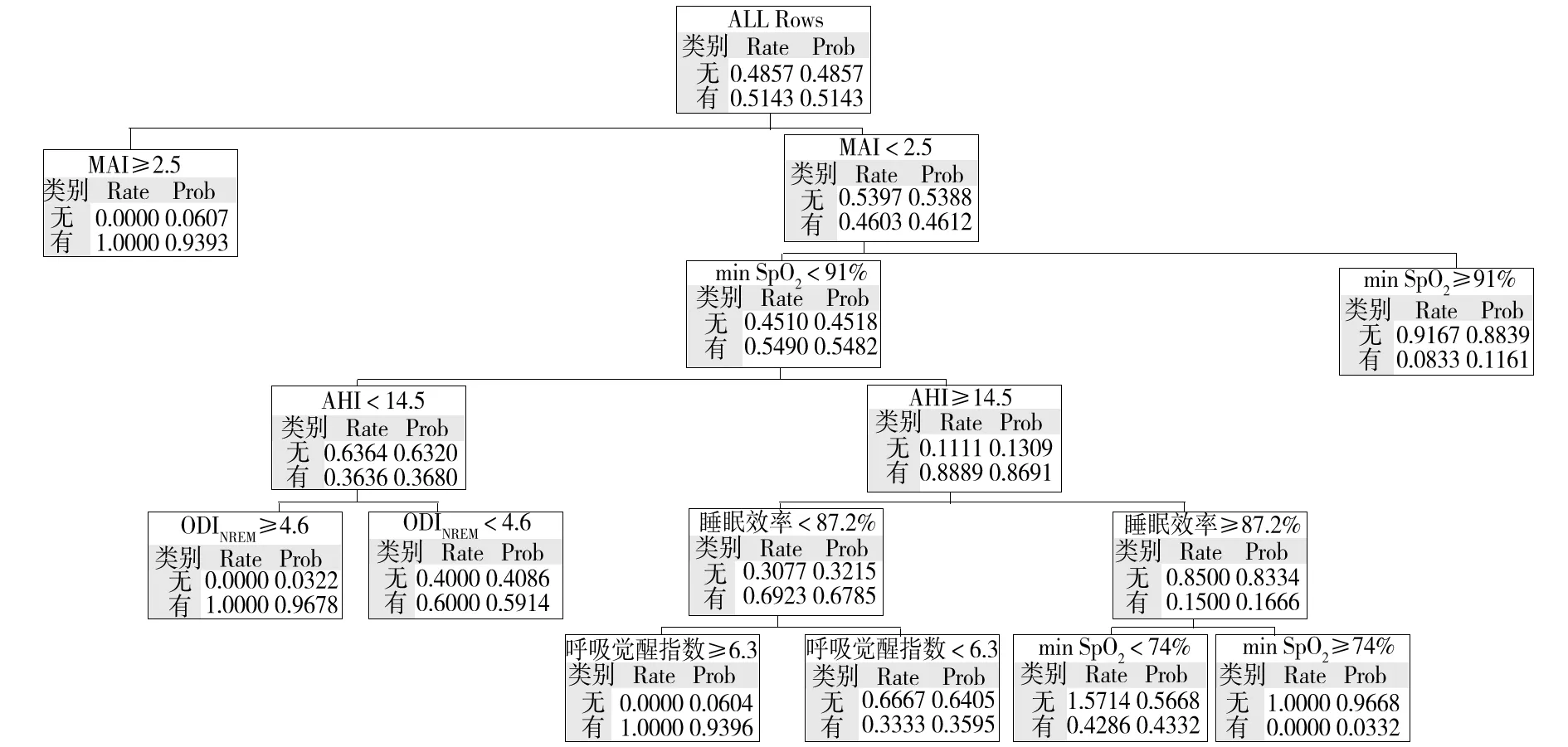
注:无为非持续性OSAS,有为持续性OSAS;Rate为实际观测数据中OSAS比例,Prob为根据分类树模型预测的OSAS比例。

表2 各节点高风险人群筛选结果
2.2 分类树模型预测持续性OSAS的效能分析 利用分类树模型所得的预测概率绘制ROC曲线,结果发现分类树模型预测持续性OSAS的曲线下面积为0.96(95%CI:0.90~0.98),其预测敏感性为83.3%、特异性为94.1%、准确性为88.6%。
3 讨论
OSAS是儿童睡眠呼吸障碍疾病中较为严重的一种类型,其特征是部分或全部上呼吸道阻塞,扰乱儿童正常通气和睡眠结构[1]。OSAS患儿若未经治疗或治疗不彻底,会导致生长发育落后、神经认知缺陷和心功能异常等。尽管腺样体扁桃体切除可有效治疗OSAS,但对于中重度患儿,术后发生持续性OSAS的概率仍然较高。因此,早期发现OSAS患儿腺样体扁桃体切除术后持续残留的危险因素,有助于确定需要长期监测随访患儿。
腺样体扁桃体切除虽然能够改善AHI,但并非所有患儿可恢复到正常水平,术后发生持续性OSAS的概率达到32.1%[6]。有研究报道,腺样体扁桃体切除能够明显改善OSAS患儿睡眠呼吸指数,然而部分患儿术后仍有残留症状,这些残留症状仍然会引起反复缺氧和睡眠结构紊乱,从而导致神经、心脑血管系统严重并发症[8]。本研究发现,腺样体扁桃体切除后能够明显改善中重度OSAS患儿整夜PSG监测相关指标,但并不能使所有患儿PSG监测相关指标恢复到正常水平,并且术后发生持续性OSAS的概率达到58.6%,高于既往报道[6],可能与本研究目标人群为中重度OSAS患儿有关。因此,要更加重视病情较重的OSAS患儿术后监测随访并进行相应治疗。
研究证实,术前AHI是决定腺样体扁桃体切除手术效果的重要因素,术前AHI越高,OSAS患儿术后发生持续残留的概率越高[3,7]。另有研究报道,术前SpO2和OAHI均可预测OSAS患儿腺样体扁桃体切除的手术效果[8]。Isaiah等[3]研究发现,重度OSAS患儿(OAHI>30次/h)基线高碳酸血症、低氧血症程度可用于预测腺样体扁桃体切除术后持续残留[3]。本研究结果亦证实,术前AHI、min SpO2可作为中重度OSAS患儿术后持续残留的预测因素。
腺样体扁桃体肥大的中重度OSAS患儿在切除腺样体和扁桃体后,仍有部分患者残留OSAS症状。本研究分类树模型预测结果显示,除术前min SpO2、AHI和睡眠效率外,术前MAI、ODINREM和觉醒指数亦与中重度OSAS患儿术后持续残留有关。提示除解剖因素外,腺样体扁桃体切除术后OSAS持续残留还与一些非解剖因素有关。OSAS发病机制复杂,PALM模型提出的病理生理模型理论阐释了参与OSAS发生的解剖因素和非解剖因素,包括4个要素:代表上气道结构因素的临界闭合压异常、低觉醒阈值,代表呼吸控制不稳定性的高环路增益及上气道扩张肌功能异常[9,10]。有研究证实,PSG监测中的一些指标能够在一定程度上反映OSAS发生的非解剖因素[11]。其中,CAI、MAI可能与衡量呼吸控制不稳定性的高环路增益有关[12],ODINREM可能与高环路增益及上气道扩张肌功能异常有关[13],而觉醒指数与低觉醒阈值密切相关[14]。
本研究分类树模型显示,MAI是中重度OSAS患儿腺样体扁桃体切除术后持续残留的预测因素之一。混合性睡眠呼吸暂停主要与通气控制的不稳定性有关[15]。当CO2气流略有变化时,通气控制的不稳定会引起呼吸中枢发生快速而强烈地反应,从而引起咽部气道闭合[16]。OSAS患儿术前MAI越高,其通气控制越不稳定[17],较小的血气变化即可引起较大的呼吸驱动波动,通气过度造成CO2呼出较多,继发引起呼吸驱动下降,降低气道扩张肌的张力和通气量。因此,在解除腺样体和扁桃体梗阻后,通气控制不稳定造成的通气不足持续出现可能是中重度OSAS患儿腺样体扁桃体切除术后持续残留的发生机制之一。
本研究分类树模型显示,ODINREM是中重度OSAS患儿腺样体扁桃体切除术后持续残留的预测因素之一。在REM期睡眠过程中,OSAS患儿上气道松弛与腺样体或扁桃体肥大等解剖因素的综合效应,在气道梗阻发生中占主导作用[11]。因此,通过切除腺样体和扁桃体引起的解剖结构梗阻能够治愈REM期的睡眠呼吸障碍。Landry等[17]研究发现,NREM期睡眠通气控制系统的敏感性明显高于REM期,故OSAS患儿NREM期通气控制不稳定性增加;另外,OSAS患儿的呼吸驱动在NREM期睡眠过程中降低,在该睡眠阶段,上呼吸道扩张肌的神经驱动降低,呼吸肌的肌肉反应性随之下降[18]。虽然腺样体扁桃体切除能够缓解气道阻塞的解剖结构因素,但对NREM期睡眠过程中通气控制不稳定、呼吸肌反应性降低引起的气道阻塞,腺样体扁桃体切除的效果不明显,这可能是中重度OSAS患儿腺样体扁桃体切除术后持续残留的重要原因。
Li等[11]研究发现,低觉醒阈值与OSAS患儿腺样体扁桃体切除术后持续残留的发生有关。通常情况下,阻塞性睡眠呼吸暂停患者气道关闭时,咽扩张肌的反射较弱,不足以打开气道,需要觉醒完成通气,但觉醒阈值较低导致气流恢复过早,限制了激活咽扩张肌所需呼吸刺激的积累[19]。另外,觉醒后短暂的过度通气能够加剧通气控制的不稳定性[20]。本研究分类树预测模型中,觉醒指数也是中重度OSAS患儿腺样体扁桃体切除术后持续残留的重要预测因素,与以往报道[11,19,20]基本一致。
本研究ROC曲线分析显示,分类树模型预测中重度OSAS患儿腺样体扁桃体切除术后持续残留的曲线下面积为0.96,其预测中重度OSAS患儿腺样体扁桃体切除术后持续残留的敏感性为83.3%、特异性为94.1%、准确性为88.6%。提示本研究分类树模型预测中重度OSAS患儿腺样体扁桃体切除术后持续残留的临床价值较高。
总之,本研究构建的分类树预测模型能够快速有效地筛选中重度OSAS患儿腺样体扁桃体切除术后持续残留的风险因素,并且具有较高的预测价值,能够为临床筛选术后需要随访治疗的人群提供依据。
