赤眼鳟Mx1基因的cDNA克隆及表达特性
2020-08-07王静安李耀国金生振陈开健肖调义
王静安 李耀国,2 赵 鑫 金生振 陈开健, 2 肖调义,2
(1.湖南农业大学湖南省特色水产资源利用工程技术研究中心,长沙 410128;2.水产高效健康生产湖南省协同创新中心,常德 415000)
当宿主细胞受到病毒感染时,机体会启动先天性免疫保护系统产生干扰素(IFN)来抵御病毒的入侵。IFN并不能直接与病毒相互作用,而是通过诱导一系列抗病毒基因的表达来行使抗病毒作用。在IFN诱导的众多抗病毒基因中,Mx基因就是具有直接抗病毒活性的重要因子之一[1]。Mx基因是由Ⅰ型干扰素(IFN-Ⅰ)通过IFNα/β和受体之间的结合,激活JAK-STATs信号转导途径而产生的最终效应因子,并通过自身GTP酶的水解作用降解病毒[2]。Mx基因首先是在1962年,Lindenmann等[3]在研究A2G小鼠对流感病毒耐受性这一现象时发现的。随后,Mx基因在人(Homo sapiens)[4],其他哺乳动物[5,6]、禽类[7,8]、鱼类[9]等相继被发现并克隆出来,并具有较强的抗病毒活性。
在鱼类中有多种Mx基因存在,如斑马鱼(Danio rerio)[10]存在7种Mx,被命名为MxA—MxG;斑点叉尾鮰(Ictalurus punctatus)[11]存在5种Mx;在虹鳟(On-corhynchus mykiss)[12]、大西洋鲑(Salmo salar)[13]和草鱼(Ctenopharyngodon idella)[14]等鱼类中发现3种Mx;在鲫(Carassius auratus)[15]、大比目鱼(Hippoglossus hippoglossus)[16]、大菱鲆(Scophthalmus maximus)[17]中发现2种Mx;在牙鲆(Paralichthys olivaceus)[18]、稀有鲫(Gobiocypris rarus)[19]、青鱼(Mylopharyngodon piceus)[20]等鱼类中也有报道,但鱼类Mx基因的不同亚型还没有系统分类。研究表明,鱼类Mx基因能够在IFN-I、多种病毒、细菌或干扰素诱生剂(poly I: C)等[21,22]的诱导下表达,反过来高表达的Mx基因也能够有效抑制病毒。大西洋鲑Mx1在大鳞大马哈鱼(Oncorhynchus tshawytscha)胚胎细胞系中过表达,能够显著降低传染性胰脏坏死病毒(Infectious Pancreatic Necrosis Virus,IPNV)复制[13];草鱼3个Mx在草鱼肾细胞系中过表达,均可显著减少草鱼呼肠孤病毒(Grass Carp Reovirus,GCRV)[14]转录。
赤眼鳟(Squaliobarbus curriculus)具有对环境较强的适应性和抗病力,是抗病育种研究的良好材料[23]。因此,本团队一直致力于赤眼鳟的抗病毒机理研究,希望能够在草鱼抗GCRV育种中得到应用[24,25]。此前,本团队已经在赤眼鳟体内克隆出1个Mx基因(ScMx),并证明了ScMx能够在抵抗GCRV感染中发挥重要作用[26]。鱼类存在多种Mx基因,是否暗示着赤眼鳟也存在其他Mx基因,也能发挥抗病毒作用? 因此,本研究以赤眼鳟为材料,克隆了赤眼鳟Mx同源基因,命名为ScMx1,并结合ScIFN-Ⅰ对其在GCRV感染条件下的表达特征进行了检测,为深入研究赤眼鳟抗病毒先天性免疫反应信号通路提供分子基础,也为后续进一步研究赤眼鳟2个Mx基因的抗病毒差异性及两者的抗病毒机制奠定基础。
1 材料与方法
1.1 实验材料
实验用1+龄(12.80±1.54) g赤眼鳟由浏阳乌龙渔场提供,实验前将其暂养于室内循环水养殖系统,设置水温为28℃,模拟昼夜规律定时光照,每天早晚投喂膨化饲料2次。实验用GCRV-106病毒毒株由中国水产科学研究院长江水产研究所曾令兵研究员提供,病毒滴度为1.78×107TCID50/mL。
1.2 总RNA提取和cDNA合成
参照E.Z.N.A.Total RNA Kit II (Omega,美国)用户手册,提取赤眼鳟总RNA;使用1%琼脂糖凝胶电泳和BioSpectrometer Basic核酸蛋白仪(Eppendorf,德国)检测RNA质量;参照Revert Aid First Strand cDNA Synthesis kit (Fermentas,美国)用户手册合成cDNA第一链,用于ScMx1中间序列克隆和荧光定量分析;参照SMARTer RACE 5′/3′ cDNA Kit Components (Clontech,美国)用户手册合成5′-RACE Ready cDNA和3′-RACE Ready cDNA,用于ScMx1 5′/3′末端序列克隆。
1.3 ScMx1全长cDNA克隆
首先参考草鱼Mx基因序列(GenBank登录号:HQ839769.1),利用primer premier 6.0软件设计引物Mx1-F和Mx-R,用于扩增ScMx1基因中间序列。PCR反应体系: 10×PCR Buffer 5.0 μL,dNTP Mixture (2.5 mmol/L) 4.0 μL,cDNA 2 μL,Mx1-F (20 μmol/L) 1 μL,Mx1-R (20 μmol/L) 1 μL,TaKaRaTaq(5 U/μL) 0.25 μL,加ddH2O补足至50 μL。反应程序: 94℃预变性5min;94℃ 30s,56℃ 30s,72℃2min,30个循环;72℃再延伸7min。再根据已获得的ScMx1中间序列,设计外引物Mx1-5W/3W和内引物Mx1-5N/3N,进行巢式PCR反应,用于扩增ScMx1基因5′/3′末端序列。第一轮PCR,以5′/3′-RACE-Ready cDNA为模板,以Mx1-5W/3W和UPM Long Primer为引物,退火温度为68℃。第二轮PCR,以第一轮PCR产物稀释50倍为模板,以Mx1-5N/3N和UPM Short Primer为引物,退火温度为62℃。巢式PCR反应体系和程序同中间序列克隆。PCR产物经1%琼脂糖凝胶电泳检测并纯化,使用pGEM-T载体进行TA克隆,送武汉奥科鼎盛生物科技有限公司进行测序验证。克隆得到的Mx1全长cDNA序列使用引物Mx1-OF/OR进行验证。引物如表1。
1.4 ScMx1生物信息学分析
ScMx1序列拼接使用DNASTAR软件下的子程序SeqMan,序列相似性使用BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,氨基酸序列翻译使用ExPASy-Translate tool (https://web.expasy.org/translate/),蛋白质相对分子质量和等电点计算使用ExPASy-Compute pI/Mw tool (https://web.expasy.org/compute_pi/),蛋白结构域预测使用SMART (https://www.predictprotein.org/),系统进化树构建使用MEGA 5.10软件(邻接法),三级结构同源建模使用I-TASSER (https://zhanglab.ccmb.med.umich.edu/ITASSER/)。

表 1 本研究所用到的引物Tab.1 Primer sequences used in the research
1.5 组织表达分析
ScMx1健康组织表达分析分别采集5尾赤眼鳟的鳃、肝脏、脾脏、体肾、头肾、肠、心脏、脑、肌肉、皮肤10个组织,并进行RNA提取和逆转录。选用β-actin和EF1α作为内参基因,各基因的荧光定量检测引物见表1。荧光定量PCR反应体系: SYBR Premix ExTaqII 5 μL,cDNA 1 μL,上、下游引物各0.4 μL,加ddH2O补足至10 μL。反应程序: 95℃ 30s;95℃ 5s,60℃ 40s,共40个循环。使用CFX manager software 3.1 (Bio-Rad,美国)软件收集和分析基因表达量数据(2-∆∆Ct法),采用SPSS 17.0软件进行单因素方差分析,计算每组(5个平行)基因表达量均值和标准误,通过GraphPad Prism 6.01软件作图,P<0.05表示各组之间具有显著性差异。
GCRV感染后ScMxⅠ和ScIFN-I的组织表达分析将赤眼鳟随机分为实验组和对照组,30尾/组。实验组每尾腹腔注射200 μL GCRV-106病毒悬液,对照组注射等量无菌PBS。处理后6h、12h、24h、72h和168h五个时间点,每组采集5尾赤眼鳟肝脏、脾脏、体肾和头肾4个组织。荧光定量PCR操作及数据分析同上。此外,将攻毒后ScMx1和ScIFN-Ⅰ的表达量进行Pearson相关性分析,P<0.05表示具有显著性意义。
2 结果
2.1 ScMx1基因cDNA全长序列及结构分析
ScMx1基因cDNA全长为3000 bp (GenBank登录号为MH016251),包括5′非编码区124 bp,开放阅读框(ORF) 1893 bp,3′非编码区983 bp,编码630个氨基酸。预测ScMx1蛋白相对分子质量为71.36 kD,理论等电点为5.26。SMART预测ScMx1蛋白存在3个典型结构: GTP酶结合区域(Dynamin GTPase domain: 13—256 aa)、中央核心结构域(Dynamin central domain: 226—513 aa)和GTP酶效应结构域(Dynamin GTPase effector domain,GED: 539—630 aa)(图1A)。此外,ScMx1在GTP酶结构域中含有一个三联体GTP结合区域(GDQSSGKS、DLPG和TKPD)和一个动力蛋白信号(LPRGSGIVTR),在GED的C端含有亮氨酸拉链结构,这些序列在其他物种Mx中均存在。I-TASSER构建的ScMx1蛋白3D模型存在19个α-螺旋和7个β-折叠,且β-折叠全部位于GTP酶结合区域内(图1B)。

图1 ScMx1蛋白结构域及3D结构预测图Fig.1 Schematic diagram and prediction for the 3D structure of ScMx1
2.2 ScMx1相似性比对及系统进化分析
将赤眼鳟Mx1氨基酸序列进行BLAST比对,结果显示: 赤眼鳟Mx1氨基酸序列与草鱼Mx3、青鱼Mx1的相似性最高(97%),其次是草鱼Mx1 (95%),与鲫Mx1、斑马鱼MxA/MxB的相似性在84%以上,与斑点叉尾鮰Mx1、日本鳗鲡Mx1、鳙鲽Mx等其他鱼类Mx的相似性为69%—74%,与人、小家鼠、牛的Mx1/Mx2的相似性为50%—55%,而赤眼鳟Mx1与赤眼鳟Mx、草鱼Mx2、鲫Mx2、斑马鱼MxC/MxE的相似性仅49%—50%。将ScMx1和其他物种Mx的氨基酸序列构建系统进化树,结果显示: 整个系统进化树分为两大支,鱼类单独聚为一支,爬行类、鸟类和哺乳类聚为一支;在鱼类中,又分为三个亚支,赤眼鳟Mx1和青鱼Mx1、草鱼Mx1/Mx2等鲤科鱼类Mx聚为一个亚支,大西洋鲑、虹鳟等其他鱼类Mx聚为一个亚支,而ScMx、鲫Mx2、草鱼Mx2等鲤科鱼类Mx单独分化为一个亚支(图2)。
2.3 ScMx1的组织表达
利用荧光定量PCR技术检测了ScMx1在赤眼鳟10个不同健康组织中的表达情况,结果显示: 赤眼鳟Mx1基因在脾脏中的相对表达量最高,其次是心脏,在肠和肝脏中的表达量较低,在肌肉、脑、鳃、体肾等组织中均有表达(图3)。

图2 ScMx1氨基酸序列与其他物种构建的系统进化树Fig.2 Phylogenetic relationship of ScMx1 with other species
2.4 GCRV感染后ScMx1和ScIFN-I的时序表达
ScMxⅠ和ScIFN-Ⅰ在肝脏中的时序表达 与
PBS组相比,感染GCRV后肝脏中ScMx1和ScIFN-Ⅰ基因表达量显著上调(P<0.05),但两者表达趋势不太一致。ScMxⅠ表达量在所检测的时间点内持续上调(图4A),而ScIFN-Ⅰ表达趋势表现为先升高后降低,在72h时达到峰值(图4B);此外,ScMx1表达量在72h时急速上升,而ScIFN-I表达量急速下降,两者呈相反的趋势。
ScMxⅠ和ScIFN-Ⅰ在脾脏中的时序表达与PBS组相比,感染GCRV后脾脏中ScMx1和ScIFN-Ⅰ的表达量显著上调(P<0.05),表达趋势呈现为先升高后降低,其表达量均在72h时达到峰值。但ScMx1(图5A)上调和下调表达趋势比ScIFN-Ⅰ (图5B)更显著,且ScMx1比ScIFN-Ⅰ的总体表达量明显要高。Pearson相关性分析结果表明攻毒后ScMx1和ScIFN-Ⅰ之间的表达量存在极强相关性(r=0.94,P=0.018)。
ScMxⅠ和ScIFN-Ⅰ在体肾中的时序表达与PBS组相比,感染GCRV后体肾中ScMx1和ScINF-Ⅰ的表达量显著上调(P<0.05),但两者表达趋势不太一致。ScMx1表达量在所检测的时间点内持续上调(图6A),而ScIFN-Ⅰ表达趋势表现为先升高后降低,在24h达到峰值(图6B),可见两者在24h后出现相反的表达趋势。此外,ScMx1比ScIFN-Ⅰ的总体表达量明显要高。
ScMxⅠ和ScIFN-Ⅰ在头肾中的时序表达与PBS组相比,感染GCRV后头肾中ScMxⅠ和ScIFNI的表达量显著上调(P<0.05),表达趋势呈现为先升高后降低,其表达量均在72h时达到峰值。但ScMxⅠ (图7A)上调表达趋势比ScIFN-Ⅰ (图7B)更显著,而且在168h时仍显著高于对照组(P<0.05)。此外,ScMx1比ScIFN-Ⅰ的总体表达量要高。

图3 ScMxⅠ在赤眼鱒10个健康组织中的表达Fig.3 The relative expressions of ScMxⅠ in 10 different tissues
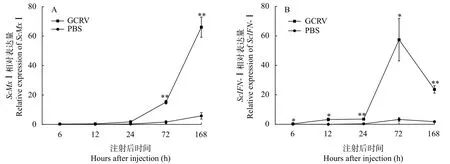
图4 GCRV感染后ScMxⅠ和ScIFN-Ⅰ在肝脏中的时序表达Fig.4 Expression analysis of ScMxⅠ and ScIFN-Ⅰ in liver after challenged with GCRV
3 讨论
在进化过程中,鱼类Mx基因可分化成多个分型。本研究克隆得到的赤眼鳟ScMx1与ScMx的相似性仅为50%,甚至低于ScMx1与哺乳动物Mx的相似性(50%—55%)。类似的结果也发生在草鱼的3个Mx基因(CiMx)间,CiMx1、CiMx3与CiMx2的相似性只有49.2%和49.5%[14]。鲫的2个Mx的相似性也很低,鲫Mx1与斑马鱼MxA有85%的相似性,而Mx2与斑马鱼MxE有80%的相似性[15]。根据氨基酸序列的同源性高低鲤科鱼类的Mx基因被分成2类,系统进化树也揭示鲤科鱼类Mx进化成2个亚支。在鲤科鱼类Mx基因的这种分类现象是否意味着同源性较低的Mx,其抵抗病毒的能力和专一性存在差异? 这是很有意思的现象,值得深入研究。此外,先天性免疫系统是鱼类重要的防御体系[27],鱼类中存在多个Mx基因,也可能是鱼类在进化过程中以适应复杂外界环境的体现。
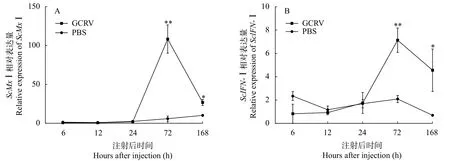
图5 GCRV感染后ScMxⅠ和ScIFN-Ⅰ在脾脏中的时序表达Fig.5 Expression analysis of ScMxⅠ and ScIFN-Ⅰ in spleen after challenged with GCRV

图6 GCRV感染后ScMxⅠ和ScIFN-Ⅰ在体肾中的时序表达Fig.6 Expression analysis of ScMxⅠ and ScIFN-Ⅰ in trunk kidney after challenged with GCRV

图7 GCRV感染后ScMxⅠ和ScIFN-Ⅰ在头肾中的时序表达Fig.7 Expression analysis of ScMxⅠ and ScIFN-Ⅰ in head kidney after challenged with GCRV
赤眼鳟Mx1基因编码的蛋白结构高度保守,与其他鱼类Mx蛋白结构一样,均具有动力蛋白超家族典型的结构特征: N端的GTP酶结合区域(含三联体GTP结合区域和动力蛋白信号)、中央核心结构域以及C端的GTP酶效应结构域(含亮氨酸拉链结构)。这些结构和位点均与Mx发挥抗病毒作用密切相关,三联体GTP结合区域已被证实是Mx蛋白发挥GTP酶水解作用和行使抗病毒功能所必须的结构[28];C端亮氨酸拉链结构能够介导Mx聚合形成二聚体或三聚体结构,与GTP酶效应区的活化和功能协调有关[29]。这些结构区域在ScMx1蛋白中高度保守,推测ScMx1蛋白同样具有抵抗病毒和发挥GTP酶水解的功能。
不同鱼类Mx或同种鱼类的不同Mx,其组织表达情况存在差异。Peng等[14]发现在所检测的草鱼的15个组织中,CiMx1、CiMx2和CiMx3在鳃和头肾中高表达,在眼睛和肌肉中少量表达,在皮肤中无表达。彭慧珍等[26]发现赤眼鳟ScMx在肝脏中高表达,脾脏次之,在肠中低表达。而本研究检测的ScMx1在脾脏中高表达,心脏次之,肠和肝脏中低表达。赤眼鳟2个Mx基因的组织表达分布情况有所差异,预示着两者发挥抗病毒功能的组织特异性。总的来说,Mx基因在脾脏和头肾等鱼类主要免疫组织[30]中都有较高表达,这也暗示Mx基因与鱼类免疫系统密切相关。鱼类Mx基因的抗病毒研究也有报道,Peng等[14]用GCRV感染草鱼后,3个CiMx和CiIFN-Ⅰ的表达量在脾脏、头肾和鳃中均显著上调。彭慧珍等[26]用GCRV感染赤眼鳟后,ScMx表达量在肝和肾中也显著高于对照组,呈现为先上升后下降的表达趋势,在48h时达到峰值。在本研究中,GCRV感染赤眼鳟,同样能够检测到ScMx1和ScIFN-Ⅰ在肝脏、脾脏、体肾和头肾4个组织中的上调表达。以上结果符合病毒刺激下由IFN-Ⅰ诱导Mx表达的抗病毒机理[2]。本研究在脾脏和头肾中,ScMx1和ScIFN-Ⅰ均在感染后72h时出现峰值,并且脾脏中两者的表达量存在显著相关性,推测ScMx1受ScIFN-Ⅰ调节。但在肝脏和体肾中,ScMx1与ScIFN-Ⅰ的表达趋势不同,ScMx1持续上调,ScIFN-Ⅰ则在感染后72h后下调表达,推测ScMx1与ScIFN-Ⅰ之间可能存在负反馈调节。在不同的组织中,ScMx1和ScIFN-Ⅰ具有不同的表达特征,这表明ScMx1和ScIFN-Ⅰ之间的相互作用可能存在组织特异性。总之,赤眼鳟ScMx1与ScIFN-Ⅰ基因可能参与了抗GCRV免疫应答反应,但ScMx1和ScIFN-Ⅰ之间的作用机制还需进一步研究。
