2016—2018 年广西玉林市部分规模猪场猪繁殖与呼吸综合征病原检测与混合感染分析
2020-08-07段振华胡明英刘香林梁俊武甘甲忠甘一波
段振华,黄 宇,胡明英,刘香林,李 苗,梁俊武,甘甲忠,何 颖,甘一波,黎 军
(1.玉林市动物疫病预防控制中心,广西玉林 537000;2.南京农业大学,江苏南京 210095;3.广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,广西南宁 530001;4.玉林市动物卫生监督所,广西玉林 537000)
猪繁殖与呼吸综合征(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的重要猪传染病之一,主要表现为不同年龄段猪只的呼吸道综合征、发热、出血,以及母猪流产和产弱仔、死胎或木乃伊胎为特征的繁殖障碍[1]。我国大陆地区1996 年首次报道此病并分离到病毒。2006 年暴发的高致病性PRRS 疫情给我国养猪业造成了巨大经济损失[2-3]。由于PRRSV 会破坏动物机体的免疫系统,从而造成免疫抑制,破坏或影响其他疫苗的免疫应答,继而增加其他疾病的感染风险。所以,临床上PRRSV 常与其他病毒和细菌发生混合感染[4-5]。黎军等[6]报道2015—2019 年广西14 个地市不同规模类型猪场PRRSV、猪瘟病毒(CSFV)、圆环病毒2 型(PCV2)、猪伪狂犬病病毒(PRV)和猪流行性腹泻病毒(PEDV)的多重混合感染现象较为普遍。李明波等[7]对PRRSV 和细菌混合感染的调查发现,猪群感染PRRSV 后,易继发链球菌、副猪嗜血杆菌、多杀性巴氏杆菌等的混合感染。广西是我国生猪主产区之一,其中玉林市的生猪总产量位列广西首位。近年来,随着玉林市养猪场的规模化、集约化发展,猪群饲养密度日益增大,造成部分地区出现PRRS等多种猪病流行,对养猪业的危害日趋严重。因此,为了解广西玉林市猪群中的PRRSV 流行情况和与其他病原的混合感染情况,对2016—2018 年采集的临床健康猪群血清样本以及表现呼吸道症状和繁殖障碍的发病猪组织样本进行PRRSV 病原检测,并对PRRSV 阳性样本进行CSFV、PCV2 和PRV 的混合感染检测,旨在为此类疫病的有效防控提供数据支持。
1 材料与方法
1.1 主要试剂
DL 2 000 DNA Marker、PremixTaqTM(ExTaqTMVersion 2.0 plus dye)、PrimeScriptTMOne step RT-PCR Kit Ver.2,均为大连宝生物工程有限公司产品;TGuide S32 磁珠法病毒DNA/RNA 提取试剂盒,购自天根生化科技有限公司。
1.2 血清样本
2016—2018 年,从玉林市7 个县(市、区)选择母猪存栏300 头以上规模化猪场的临床健康猪群为目标群,根据各县(市、区)目标群数量,按比例确定研究猪场数量后,采集各猪场母猪、保育猪或育肥猪血清样品共计661 份,其中2016 年32个场、306 份血样,2017 年15 个场、119 份血样,2018 年20 个场、236 份血样(表1)。
1.3 组织病料
2016—2018 年,共收集玉林市7 个县(市、区)规模猪场送检的896 份发病猪(包含死猪)病料,包括流产胎儿或死胎,以及有呼吸困难、发烧、皮肤发红、腹泻等临床症状的哺乳仔猪、保育猪、育肥猪和母猪的组织病料,其中2016 年57 个场次、235 份,2017 年82 个场次、284 份,2018 年124个场次、377 份(表2)。

表1 2016—2018 年广西玉林市各县(市、区)血清样本统计

表2 2016—2018 年广西玉林市组织病料样本统计
1.4 病毒DNA/RNA 提取
1.4.1 血清样本 抽取200 μL 血清,按照TGuide S32 磁珠法病毒DNA/RNA 抽提试剂盒说明书提取DNA/RNA,将所获得的DNA/RNA 直接进行PCR/RT-PCR 检测或置于-70 ℃保存。
1.4.2 组织病料 按1:5 质量比,加入生理盐水,在组织研磨仪内研磨,反复冻融3 次,4 ℃条件下,10 000 r/min 离心5 min,取上清抽提DNA/RNA或保存于-70 ℃冰箱备用。按照TGuide S32 磁珠法病毒DNA/RNA 抽提试剂盒说明书提取DNA/RNA,然后将所获得的DNA/RNA 直接进行PCR/RT-PCR 或置于-70℃保存。
1.5 引物设计与合成
根据GenBank 中公开发表的PRRSV、CSFV、PCV2 和PRV 基因序列,利用Meg Align(DNAstar)和Primer Premier 7.0 软件设计引物,送至生工生物工程(上海)服务有限公司合成。引物信息详见表3。
1.6 PRRSV 检测
利用特异性引物,对提取的样品RNA 进行一步法RT-PCR 扩增。RT-PCR 扩增体系25 μL:Prime Script 1 step Enzyme Mix 1 μL,2×1 Step Buffer(Dye Plus)12.5 μL,上下游引物各0.5 μL,RNA 模板5 μL,ddH2O 5.5 μL。RT-PCR 扩增反应条件:50 ℃ 30 min,94 ℃预变性2 min;94 ℃变性30 s,57 ℃,退火30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min。反应结束后,取10 μL PCR 扩增产物进行1.0%琼脂糖凝胶电泳检测。

表3 引物信息
1.7 其他病原检测
将检出的PRRSV 阳性样本进行CSFV、PCV2和PRV 病原检测,并统计PRRSV 阳性样本中,上述3 种病原的混合感染情况。其中:CSFV 的RTPCR 检测方法同1.6;PCV2、PRV 的PCR 检测,采用特异性引物,对提取的样品DNA 进行PCR扩增。PCR 扩增体系25 μL:PremixTaq12.5 μL,DNA 模板5 μL,上下游引物各0.5 μL,ddH2O 7 μL;PCR 扩增反应条件:94 ℃预变性5 min;94 ℃变性40 s,按表2 退火温度,退火40 s,72 ℃延伸70 s,共35 个循环;72 ℃延伸10 min。反应结束后,取10 μL PCR 扩增产物进行1.0%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 血清样本的PRRSV 检测
结果(表4)显示:2016—2018 年广西玉林市规模猪场PRRSV 血清样本阳性率分别为6.86%、19.33%和10.17%,猪场阳性率分别为25.00%、46.67%和40.00%,整体呈上升趋势;3 年内玉林市7 个县(市、区)均有PRRSV 阳性样本被检出,说明PRRSV 流行广泛。
2.2 血清样本的混合感染检测
对68 份PRRSV 阳性血清样品进行了CSFV、PCV2 和PRV 病原检测。结果(表5)显示,2016—2018 年PRRSV 阳性血清样本的混合感染率分别为52.38%(11/21)、65.22%(14/23)、62.50%(15/24),其中与PCV2 的混合感染率最高,其次是与PRV。
2.3 病料样本的PRRSV 检测
对采集的流产胎、死胎以及不同猪群发病组织样本进行了PRRSV 病原检测。结果(表6)显示,2016—2018 年病料组织样本的PRRSV 检出率分别为46.38%、48.24%、48.81%,场阳性检出率分别为42.11%、35.37%、37.10%,平均样本阳性检出率和场阳性检出率分别为48.00%和37.64%。母猪、保育猪以及流产胎、死胎样本的PRRSV 检出率较高,分别为58.82%、52.66%和50.23%;母猪和育肥猪的场PRRSV 检出率较高,分别为43.48%和46.67%(表7)。

表4 2016—2018 年广西玉林市规模猪场血清中PRRSV 检测结果统计

表5 2016—2018 年广西玉林市规模猪场PRRSV 阳性血清中其他病原混合感染统计
2.4 病料样本的混合感染检测
对病料样本中检出的430 份PRRSV 阳性样本进行了CSFV、PCV2 和PRV 病原检测,结果发现,2016—2018 年PRRSV 阳性样本的混合感染率分别为50.00%、52.99%、52.35%,其中与PCV2的混合感染率最高,分别为45.28%、49.25%、49.41%,其次是与PRV 的混合感染,分别为14.15%、14.93%、14.12%(表8)。
对不同PRRSV 阳性病料的混合感染情况进行统计发现,流产胎/死胎和哺乳仔猪的混合感染率较低,PRRSV 单一感染率较高,而随着日龄增长,保育猪和育肥猪的混合感染率依次升高,分别为58.17%和64.71%。
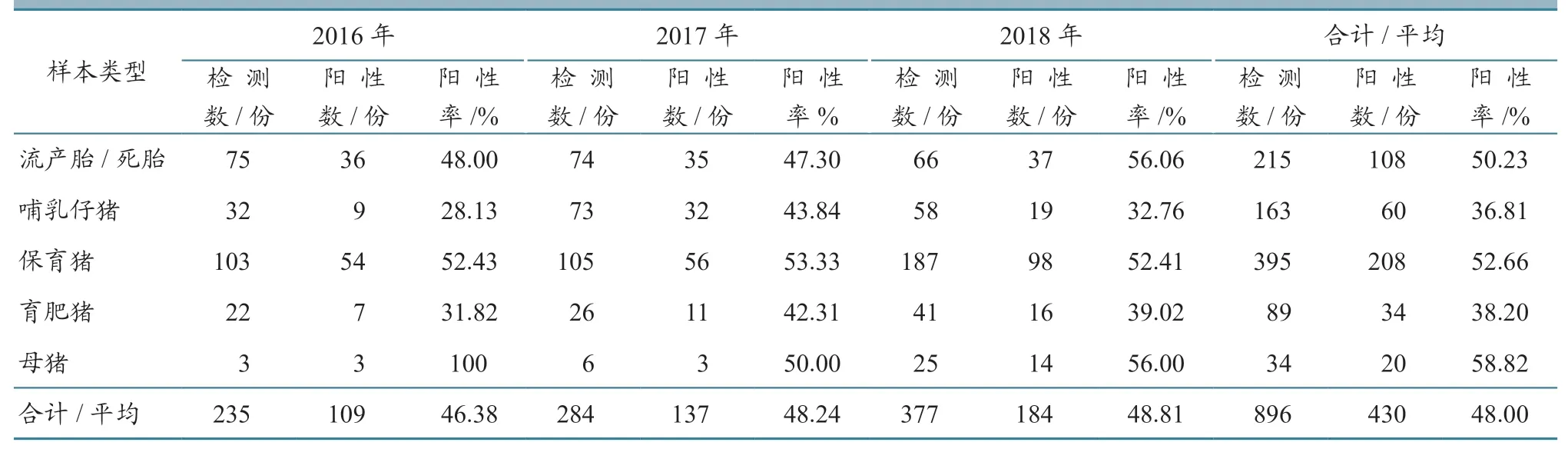
表6 2016—2018 年广西玉林市规模猪场病料样本的PRRSV 病原检测结果

表7 2016—2018 年广西玉林市规模猪场病料样本的PRRSV 阳性场统计结果

表8 发病组织样本中PRRSV 与其他病原的混合感染检测结果
3 讨论
本研究对广西玉林市规模化猪场健康猪群的血清样本和病料组织样本进行了PRRSV 病原检测,发现血清样本平均阳性率为10.29%,且呈上升趋势,而病料组织样本阳性检出率一直维持在48.00%的较高水平。毕峻龙[8]对2013—2018 年云南不同地区规模猪场收集的2 234 份样品进行PRRSV 病原检测,发现2016—2018 年的检出率分别为21.08%、33.06%和41.72%,也呈上升趋势,与本研究结果一致,说明PRRS 流行依然较严重,仍是当前对我国生猪养殖业危害最严重的猪病之一[9-10]。规模猪场PRRSV 感染有加重趋势,有可能与2017 年PRRS 退出国家强制免疫政策后,猪场防控意识减弱有关。为节约成本,部分猪场减少了PRRSV 疫苗的免疫次数和用量,但又缺乏完备的保障措施[11]。
本研究发现,玉林市规模猪场PRRSV 与其他病原的混合感染较为严重,最为常见的是PRRSV与PCV2 的混合感染,其次是与PRV。这与刘晓东[12]、Ouyang[13]和Chen等[14]研究发现的我国部分地区规模猪场中PRRSV 与PCV2 混合感染比例最高,其次是PRV 的研究结果相似。PRRSV 通过呼吸道或生殖道侵入猪体内,在猪肺泡巨噬细胞(PAM)内大量增殖,从而使其失去抗原递呈和吞噬清除功能,并且以PAM 为载体转移到全身,使机体非特异免疫功能急剧下降,因此增加了猪体继发其他病毒或细菌感染的概率,导致疾病的临床症状变得更为复杂[15]。PCV2 也是一种主要通过侵害机体单核细胞及巨噬细胞等免疫细胞,造成机体免疫抑制的病原。有研究[16-17]表明,PCV2 与PRRSV 的感染有协同作用,当猪体感染PRRSV时引发了PAM 的凋亡和崩解,摧毁了肺部的初级防疫,此时PCV2 可以借助低水平的感染,逃避宿主免疫反应机制而不被识别,然后进一步感染PAM细胞并大量繁殖,并且联合导致病猪临床症状加剧,其严重程度与其体内两种病毒载量的水平呈正相关。
本研究发现,流产胎/死胎、哺乳仔猪中PRRSV 与其他病原的混合感染率较低,而保育猪和育肥猪群的混合感染率依次增高。这与李记蕾等[18]对从河南省送检的猪血清进行检测,得到妊娠母猪阳性率为70%、哺乳仔猪阳性率为55.00%、保育猪阳性率为47.00%、育肥猪阳性率为74.00%的结果相似。这说明PRRSV 对各生长阶段猪群均有危害,既可以通过呼吸道在猪群中水平传播,也能通过母猪胎盘屏障进行垂直传播,是造成猪场发病率和病死率上升的主要因素之一[19]。同时,随着日龄的增加,保育阶段猪只的母源抗体下降到达临界值,而自身抗体还未产生,同时感染其他病原的机会也在增多,所以保育猪和育肥猪群的多种病原混合感染率逐渐增高。
由于规模猪场采集组织样品的可操作性受限制,本次研究中血清样本的采样场点和样本量有限,研究结果可能和玉林市规模猪场中PRRSV、PCV和PRV 的实际感染率有一定的误差,但临床表现健康的猪血清样本中所检测到的上述病原的阳性率结果,仍能说明近年来玉林市部分规模化猪场存在PRRSV、PCV2 和PRV 的隐性混合感染情况,应据此制定相应的免疫程序,采取相关措施加强防控。
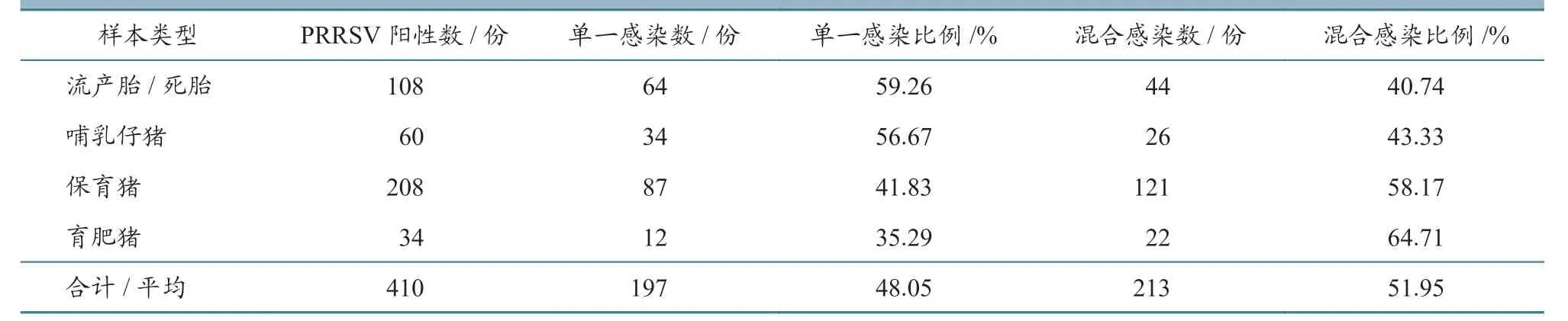
表9 不同病料样本的PRRSV 单一感染和混合感染统计结果
4 结论
研究发现:广西玉林市规模化猪场中PRRSV流行广泛,且有加重趋势;同时存在一定的隐性带毒风险,且与PCV2 和PRV等病原的混合感染较严重。因此,玉林市规模猪场应制定科学的免疫程序,采取综合措施,加强这些疫病的防控。
