尾叶桉响应水肥单、双因素胁迫的差异表达基因分析
2020-08-05杨会肖廖焕琴张卫华杨晓慧
黄 杰,杨会肖,廖焕琴,张卫华,徐 放,潘 文,杨晓慧
(广东省森林培育与保护利用重点实验室/广东省林业科学研究院,广东 广州 510520)
在世界范围内,非生物胁迫是制约植物生长的重要因素。随着世界优质土地资源的减少及气候的变化,植物的生存环境更加恶劣。在野外,非生物胁迫对植物的影响是普遍的,且这些胁迫很少单独出现,植物通常会同时受到几种非生物因素的综合胁迫,而且很多胁迫对植物是致命的[1-4]。在此背景下,了解植物的抗逆性和逆境适应机制非常重要,有利于制定合理高效的植物栽培管理方案。
桉树Eucalyptus是桃金娘科桉树属植物,原产澳洲,因为速生性和强适生性成为世界上公认的三大造林树种之一,是我国华南地区重要的纸浆材造林树种,也是我国南方地区重要的造林树种,具有良好的经济效益和生态价值。为了更好地了解这一重要树种的联合抗逆机制,我们研究了尾叶桉Eucalyptus urophylla在水分和养分单独和组合胁迫下的转录响应。
当前国内外对植物应对非生物胁迫有诸多研究,但主要集中在单因素胁迫上,对综合胁迫研究较少[1]。与单独胁迫相比,植物对综合胁迫的响应具有特异性,有研究表明拟南芥和烟草对干旱和热的联合胁迫的响应是独特的,这种综合胁迫下确立的基因和功能途径可能为植物应对逆境胁迫提供新思路[5-7]。前期综合胁迫研究的材料多集中于一些模式植物,如拟南芥[7]、玉米[8]、高粱[9]等草本植物,对长生长周期的木本植物鲜有报道[10]。木本植物的优良生物学特性及丰富的遗传特征不能被模式植物解释和代表[10];所以,加强非模式木本植物抗性的分子生物学研究不仅对加深植物抗性机理理解、丰富优良遗传基因资源具有重要的意义,也是我国林木育种研究的新方向。综上所述,本研究基于分子生物学研究手段,对尾叶桉开展组合逆境响应防御的分子生物学机制研究具有重要的现实意义和理论价值。
1 材料与方法
1.1 试验材料、胁迫处理和样品采集
基于广东省林业科学研究院木本花卉与竹子研究团队前期尾叶桉水肥精准测定试验结果,选取在各个处理中均表现较好的尾叶桉无性系ZQUA44为试验材料。2015年3月,将长势基本一致、状态良好的3月生尾叶桉幼苗种植于黑色定植袋中,以黄心土为基本栽培基质,通过施加不同量的基肥及追肥控制养分含量;以黑白膜覆盖定植袋口控制外界水分进入,通过定量浇水控制水分含量。养分和水分各自设置2个处理,分别为处理和对照。养分处理包括缺养[基肥:钙镁磷肥(Calcium magnesium phosphate fertilizer, CMPF)250 g]和对照 (基肥:CMPF 250 g+复合肥 150 g),水分处理包括缺水(2 0%~4 0%田间持水量)和对照(60%~80%田间持水量)[11]。试验采用两因素两水平正交试验,每个处理重复3次,培养周期18个月。于2015年3月在自然条件下控制材料水分、养分进行试验。各处理如下所示。水肥双因素胁迫:20%~40% 田间持水量,基肥为 CMPF 250 g;水分单因素胁迫:20%~40%田间持水量,基肥为CMPF 250 g+复合肥 150 g;养分单因素胁迫:60%~80% 田间持水量,基肥为 CMPF 250 g;CK:60%~80% 田间持水量,基肥为 CMPF 250 g+复合肥 150 g。水分单因素胁迫和对照处理在种植2个月后施尿素100 g,8月份施复合肥150 g,第2年春天施复合肥100 g。样本处理周期较长,试验过程中要一直模拟野外不利环境条件,确保样本长期处于胁迫中。
1.2 试验方法
1.2.1 生长指标测定 对4种处理下生长18个月的植物样本进行生长指标测定。采用测量杆测定树高、冠长等指标,采用游标卡尺测定地径。收集4种处理下的植物样本测定生物量,采用托盘天平测量新鲜样本的叶片、主干、侧枝和根的鲜质量;将所有样本组织放入75 ℃烘箱48 h后,测量各处理叶片、主干、侧枝和根的干质量。
1.2.2 RNA 提取、转录组测序及数据分析 采集4种处理下尾叶桉叶片组织样本,采用RNAprep pure Plant Kit试剂盒 (Qiagen China,上海)进行总RNA提取和纯化。利用10 g/L琼脂糖凝胶电泳检测RNA完整性,采用纳米分光光度计检测RNA纯度和含量。每个样品取3 μg高质量RNA进行cDNA文库构建,然后采用Illumina Hiseq测序平台进行双末端测序。整个测序流程包括文库构建、测序、数据预处理,全面委托诺禾致源生物技术有限公司完成。以巨桉Eucalyptus grandis基因组为参考基因组,采用TopHat v2.0.9软件将高质量clean reads比对到参考基因组上,后经Scripture(beta2)和Cufflinks(v2.1.1)组装获得转录本全长。各个基因的表达量采用Cuffdiff(v2.1.1)软件计算获得,将Q<0.05的基因定义为差异表达基因。
1.2.3 差异表达基因验证 为了验证转录组测序得到的表达数据,随机选取4个具有不同表达模式的差异表达基因进行逆转录实时荧光定量PCR(qRT-PCR)验证。采用 FastKing RT Kit [(天根生化科技(北京)有限公司)]合成cDNA。采用NCBI Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer/blast/index.cgi?LINK_LOC)设计特异性引物 (表 1)。以 18s rRNA 为内参,采用 FastKing RT Kit在 7500 Real-time PCR 仪器中进行 qRT-PCR,每个基因重复3次。使用R(版本3.1.3,http://cran.rproject.org/)软件对4种处理下qRT-PCR数据和转录组测序数据进行相关性分析。
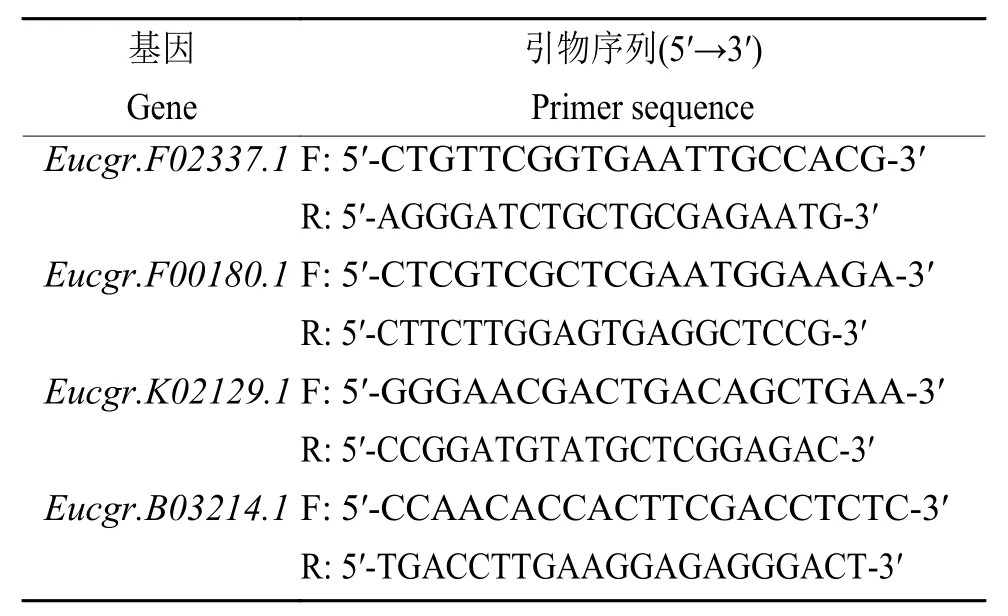
表1 qRT-PCR验证的引物信息Table 1 Primers for qRT-PCR validation
1.2.4 功能注释、GO 和 KEGG 分类 以巨桉(https://phytozome.jgi.doe.gov/pz/portal.html#!bulk?o rg=Org_Egrandis)和TAIR(https://www.arabidopsis.org/)数据库对每个差异表达基因进行功能注释。在3种胁迫处理中,以拟南芥为背景(FDR < 0.05),通过AgriGO(http://bioinfo.cau.edu.cn/agriGO/index.php)对每个处理的上、下调差异表达基因进行GO分类,同时通过KOBAS 3.0(http://kobas.cbi.pku.edu.cn/index.php,P< 0.01)对差异表达基因进行KEGG通路分析。
2 结果与分析
2.1 不同水肥单、双因素胁迫影响树木生长
为了研究水肥单、双因素胁迫对尾叶桉ZQUA44的影响,我们在处理后18个月测量了参试基因型的生长性状。结果表明,与对照相比,不同处理条件下尾叶桉的鲜质量、干质量和冠长等生长指标均受到不同程度的抑制(图1)。其中,水肥双因素胁迫的总生物量(鲜质量547.30 g,干质量197.76 g)低于水分单因素胁迫 (鲜质量 2 355.14 g,干质量 1 562.78 g)(P<0.05)和养分单因素胁迫 (鲜质量 985.72 g,干质量 395.61 g)(P>0.05)(图 1A);在地下部分生物量、树高、地径、冠长等指标中出现了同样的规律 (图 1B、1D、1E、1F),说明双因素综合胁迫对植物生长性状的影响远大于单因素胁迫,且差异显著。养分单因素胁迫的根冠比(0.594)与水肥双因素胁迫(0.582)差异不明显,但显著大于水分单因素胁迫(0.302)和对照(0.296)(图1C)。结果表明,在不同胁迫处理条件下植物地上、地下部分受到的影响不完全相同。

图1 4种不同水肥处理中尾叶桉无性系生长指标的变化Fig.1 Growth index changes ofEucalyptus urophylla clones in four different water and fertilizer treatments
2.2 转录组测序和差异表达基因筛选
由表2可知,水肥双因素胁迫、水分单因素胁迫和养分单因素胁迫转录组测序各获得3.01×108、2.69×108和 2.74×108条 clean reads;Q20、Q30 均在88.20%以上,碱基测序错误率≤0.02%,测序质量较高,确保了测序结果的可靠性。3种胁迫处理下共获得5 547 个差异表达基因,其中 2 082 个上调,3 465个下调,下调数量多于上调,说明在外界环境的非生物胁迫下,植物的生命活动受到一定程度的抑制;水肥双因素胁迫的差异表达基因数量远高于水分单因素胁迫和养分单因素胁迫,说明双因素胁迫条件下植物生命活动受到的抑制作用高于单因素胁迫(图2)。
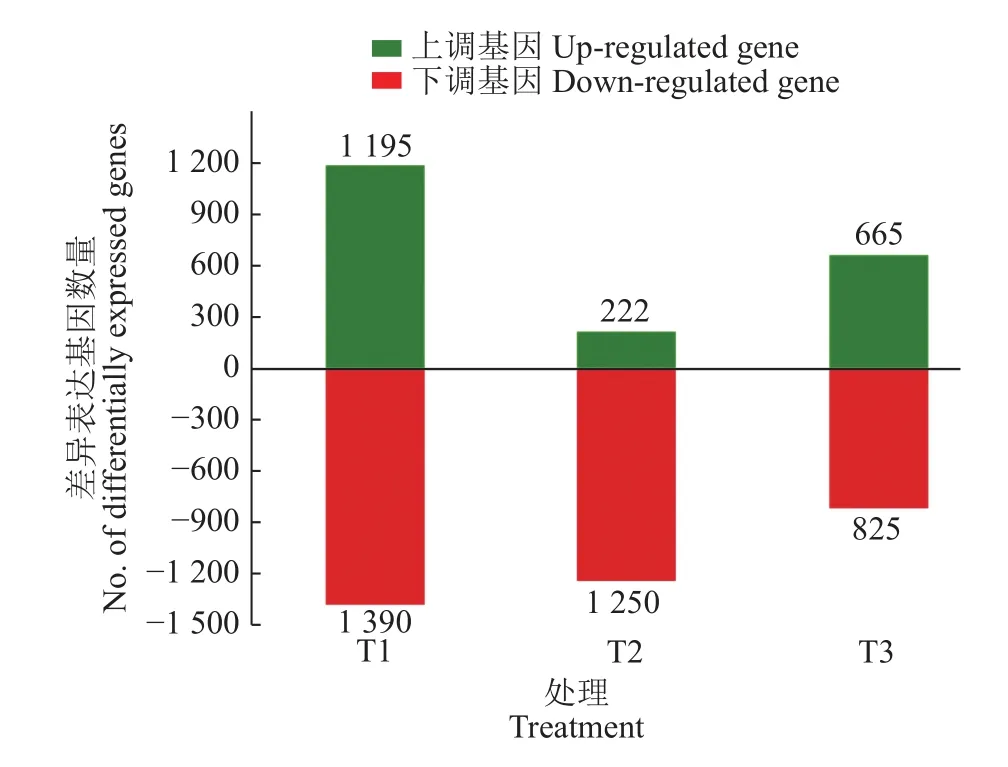
图2 3种胁迫处理中尾叶桉差异表达基因分布情况Fig.2 Distribution of differentially expressed genes of Eucalyptus urophylla in three stress treatments
与对照相比,将不同胁迫下的差异表达基因进行比较(图3)发现,水肥双因素胁迫、水分单因素胁迫和养分单因素胁迫分别有1 195、222、665 个上调基因,1 390、1 250、825 个下调基因。上调的差异表达基因中,水肥双因素胁迫有761个基因具有表达特异性,远高于水分单因素胁迫(208个)和养分单因素胁迫(222个)。有12个差异表达基因在水分单因素胁迫和养分单因素胁迫中共同表达,3个在水分单因素胁迫和水肥双因素胁迫中共同表达,432个在水肥双因素胁迫和养分单因素胁迫中共同表达,3种胁迫处理仅有1个相同的上调基因。下调的差异表达基因中,水肥双因素胁迫、水分单因素胁迫、养分单因素胁迫处理的特异性差异表达基因分别有720、1 165和174个。此外,有54个基因在水分单因素胁迫和养分单因素胁迫中共同表达,73个在水肥双因素胁迫和水分单因素胁迫中共同表达,639个在水肥双因素胁迫和养分单因素胁迫中共同表达,42个在3种胁迫处理中共同表达。3种胁迫处理分别获得155、75和108个基因编码转录因子。

表2 3种胁迫处理中尾叶桉叶片转录组测序质量1)Table 2 Transcriptome sequencing quality ofEucalyptus urophylla leaves in three stress treatments
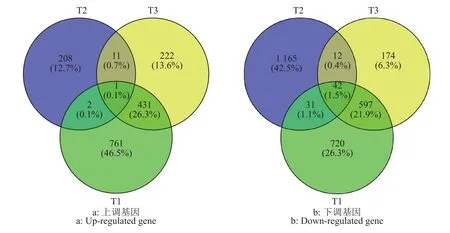
图3 3种胁迫处理中尾叶桉差异表达基因韦恩图Fig.3 Venn diagram of differentially expressed genes ofEucalyptus urophylla in three stress treatments
2.3 差异表达基因的GO和KEGG分析
为了研究不同处理条件下差异表达基因的生物学功能,对差异表达基因进行GO和KEGG分类。GO分类结果(图4)显示,水肥双因素胁迫的差异表达基因显著富集于35个类别中,分别为生物过程中的类黄酮代谢过程、跨膜转运蛋白活性等,分子功能中的转移酶活性、催化活性等;水分单因素胁迫的差异表达基因显著富集于42个GO分类中,包括生物过程中的苯丙烷代谢过程、细胞表面受体信号通路,分子功能中的催化活性、氧化还原酶活性等;养分单因素胁迫的差异表达基因显著富集在50个GO类别中,在生物过程中显著富集于运输活性、类黄酮代谢过程等,在分子功能中显著富集于运输活性、转移酶活性等。

图4 3种胁迫处理中尾叶桉差异表达基因的GO分类Fig.4 GO categories of differentially expressed genes ofEucalyptus urophylla in three stress treatments
KEGG通路显著性富集分析结果(图5)显示,水肥双因素胁迫的差异表达基因主要富集在苯丙烷生物合成、糖酵解/糖异生等13个途径中 (P< 0.000 01,Q< 0.01);水分单因素胁迫的差异表达基因主要富集在苯丙烷生物合成、DNA复制等5个途径中;养分单因素胁迫的差异表达基因主要富集在苯丙烷生物合成、抗坏血酸和藻酸盐代谢等16个途径中。KEGG结果显示苯丙烷生物合成途径相关基因广泛参与植物的抗逆过程。

图5 3种胁迫处理中尾叶桉差异表达基因的KEGG分析Fig.5 KEGG analyses of differentially expressed genes ofEucalyptus urophylla in three stress treatments
2.4 转录组数据的qRT-PCR验证分析
为了验证转录组测序数据的可信度,随机选取4个具有不同表达模式的差异表达基因进行qRTPCR验证。结果(图6)显示:转录组测序获得的数据与 qRT-PCR 结果相关性较高,R2= 0.705,说明转录组测序结果可靠。
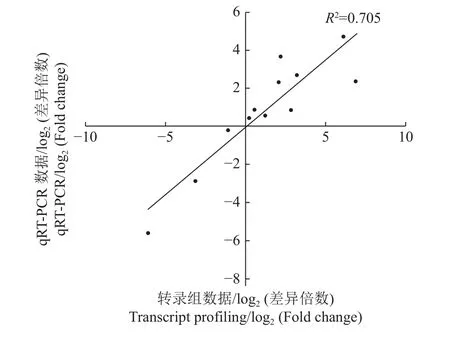
图6 4个基因的转录组测序结果与qRT-PCR验证结果的相关性分析Fig.6 Correlation analyses between transcriptome profiling and qRT-PCR verification results of four genes
3 结论与讨论
3.1 水肥单、双因素胁迫对尾叶桉生长发育的影响
植物生长受外界环境影响,本研究3种胁迫处理下尾叶桉各项生长指标多显著低于对照,说明3种胁迫处理均在一定程度上抑制植物的生长发育。水肥双因素胁迫下尾叶桉总生物量最低,干质量 197.76 g,鲜质量 547.30 g;其次为养分单因素胁迫,干质量 395.61 g,鲜质量 985.72 g;生长受到影响最小的是水分单因素胁迫,干质量1 562.78 g,鲜质量2 355.14 g;说明与单因素胁迫相比,双因素胁迫对植物生长发育的影响更大。同时,本研究结果显示,养分单因素胁迫对植物生长发育的影响显著大于水分单因素的影响,说明在土壤水分充足时,养分在尾叶桉的生长发育过程中起重要作用。在植物生长发育过程中,地上部分和地下部分的养分分配均受外界环境影响。不同营养元素或不同营养水平对根冠比的影响也不同。氮素少时,首先确保根的生长,运到冠部的氮素减少,根冠比变大。磷、钾肥可以调节碳水化合物的转化和运输,促进光合产物向根和贮藏器官转移,增加根冠比[12]。本研究水肥双因素胁迫的根冠比(0.582)和养分单因素胁迫的根冠比(0.594)均大于对照(0.296),说明在受到水肥双因素胁迫和养分单因素胁迫时,尾叶桉可能通过将养分分配给根系促进根部生长、降低地上部分生物量来应对逆境。
本研究结果揭示在3种胁迫处理下尾叶桉的生长发育变化具有特异性,综合胁迫对植物生长的影响比单独胁迫更加复杂,不同胁迫下植物可能具有不同的响应方式。
3.2 转录组分析揭示尾叶桉在响应水肥胁迫时差异基因的表达变化
面临胁迫时,植物改变其生化和分子机制以适应环境的变化。胁迫信号会被细胞表面的受体感知并启动相关的信号转导途径,转录调控基因的表达,积极对胁迫做出响应。尾叶桉在不同胁迫条件下的响应方式与其内在的分子调控机制密不可分。水肥单、双因素3种胁迫处理差异表达基因的GO分析显示尾叶桉在养分单因素胁迫下的功能分类与其他植物[13]类似,差异基因显著富集于类黄酮代谢过程、苯丙烷代谢过程、胁迫响应细胞信号转导、细胞增殖和生长调控等相关途径。水分单因素胁迫诱导大量离子转运和跨膜转运蛋白相关基因的表达改变,这很可能是胁迫破坏了细胞内、细胞间以及根际环境中的离子平衡或引发细胞膜电位的变化,导致离子重新分配[14-15]。在水肥双因素胁迫中,除上述代谢途径外,还包括蜡代谢过程、脱落酸响应途径、糖代谢途径等相关基因也发生差异表达。尾叶桉在水分、养分单因素胁迫下差异表达基因表达模式的相似性,揭示不同胁迫之间可能存在共同的信号转导及基因表达调控机制,双因素胁迫是不尽相同的复杂过程,可能涉及更多的基因和转录途径。
在3种胁迫处理中差异表达基因均富集在类黄酮代谢、苯丙烷代谢途径,说明不同胁迫之间可能存在共同的信号转导及基因表达调控机制。苯丙烷类代谢产物经类黄酮途径产生黄酮类化合物间接参与呼吸代谢,可作为植物体特殊贮能帮助植物体清除自由基等[3]。干旱、高盐等非生物胁迫会使植物产生大量活性氧,从而诱导合成黄酮类化合物以避免细胞氧化损伤。黄酮类化合物还可以与铜等金属离子结合,从而降低金属离子对胞质结构的破坏[16]。
3.3 尾叶桉胁迫应答的转录因子及调控机制
转录调控主要通过转录因子与相应的顺式作用元件相互作用实现[17]。与植物抗逆相关的转录因子主要包括 MYB、bZIP、AP2/EREBP、WRKY 和NAC[17-23]等5类。本文通过对3种胁迫处理的转录组数据进行分析,发现以上述转录因子为主的多种不同家族的转录因子在受胁迫后均差异表达,它们可以通过调控应答基因、植物抗逆信号通路基因和自身基因的表达来启动植物对非生物胁迫的适应机制。这几类转录因子的大量表达说明它们在尾叶桉应对水肥单、双因素胁迫的多种不同应答途径中起着十分重要的作用。
除此之外,我们在水肥双因素胁迫处理下差异表达的转录因子中还发现了一些特有的转录家族,WOX转录因子家族的WOX4、ARF转录因子家族的ARF10以及DBB类锌指蛋白。WOX蛋白家族是植物特有的一类转录因子家族,是植物胚胎建成、干细胞维持和器官发生等发育过程中的重要调控因子。有研究表明,WOX蛋白家族通过相似或特异的调控网络参与植物初级和次级分生组织等各级干细胞的维持和分化[24-25]。WOX4为WOX蛋白家族的进化支,GUS染色和原位杂交试验表明WOX4主要在维管分生组织中表达。植物独有的WOX蛋白家族对植物体的生长发育有非常重要的作用,WOX成员通过特化干细胞属性和维持分生组织动态平衡来参与植物体发育的各个过程,这些功能都与它促进细胞分裂和(或)抑制细胞分化密切相关[24-26]。在水肥双因素胁迫中尾叶桉WOX4基因表达上调,由此推测在水肥双因素胁迫条件下WOX4转录因子被正向调控参与初级分生组织和次级分生组织的分化,通过促进细胞分裂和(或)抑制细胞分化来维持分生组织的平衡,从而调节尾叶桉生长发育各个过程;但其具体的转录调控机制尚不清楚,对其转录调控机制的揭示有利于进一步理解在水肥双因素胁迫中尾叶桉生长发育过程中的分子调控机制。
