优选盆栽小菊高效再生及转化体系的建立
2020-08-04罗宇婷黄艺清黄琪
罗宇婷 黄艺清 黄琪
摘要:为筛选最适盆栽小菊品种,建立再生转化体系,以 11 个盆栽小菊品种无菌苗叶片为外植体,比较不同植物生长调节剂配比和抗生素对叶片愈伤组织诱导、不定芽分化及生根等过程的影响。结果表明,11 个品种中再生率最高的为微风深红,其最适分化培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA,再生率为 95.0%;叶片分化对卡那霉素和潮霉素的抗性选择压分别为 15、10 mg/L;对植株生根的抗性选择压分别为 10、8 mg/L;羧苄青霉素抑菌浓度最适范围为 200~400 mg/L。本研究建立了盆栽小菊叶片外植体的高效再生及转化体系,为今后菊花的转基因工作奠定良好的基础。
关键词:盆栽小菊;叶片;不定芽生根;农艺性状;再生;遗传转化;选择压力
中图分类号:S682.1+10.4+3 文献标志码: A 文章编号:1002-1302(2020)11-0061-06
收稿日期:2019-06-04
基金项目:江苏省农业科技自主创新资金[编号:CX(17)3036];江苏现代农业(花卉)产业技术体系综合示范基地项目(编号:JATS2018002);青海省科技项目(编号:2018HZ819);教育部高校科研基地业务费项目(编号:KJFP201703)
作者简介:罗宇婷(1995—),女,四川乐山人,硕士研究生,主要从事观赏植物育种与栽培技术研究。E-mail:532969000@qq.com。
通信作者:蒋甲福,博士,教授,博士生导师,主要从事菊花遗传育种与分子生物学研究。E-mail:jiangjiafu@njau.edu.cn。 菊花(Chrysanthemum morifolium Ramat.)在我国有着源远流长的栽培历史,至今已培育出各具特色的品种群,发展成为世界四大切花之一,具有很高的观赏和经济价值[1],因而筛选、培育具有优良性状的新品种十分具有实用意义。随着植物基因工程技术的发展,通過基因工程改良性状己经逐渐成为植物定向遗传改良的重要手段。由于菊花的品种繁多、遗传背景复杂,不同基因型菊花的再生能力也各不相同[2]。研究表明,基因型差异是影响菊花再生的主要因素[3]。Horsch 等在之前的农杆菌介导法转化试验中利用叶盘转换法,对多个不同品种的菊花进行再生试验,结果发现,不同品种的菊花有着较大差异的遗传转化率,表明菊花的转化效率依赖于品种[4]。目前,已经利用叶片、叶柄、茎段、花器官等外植体实现了不同品种菊花再生和转化体系的建立[5-6],而应用于遗传转化最普遍的受体材料是叶片[7]。利用盆栽小菊进行再生及转化体系建立至今未见报道。本研究以 11 个盆栽小菊新品种叶片为外植体,从基因型、6-苄氨基嘌呤(6-BA)和萘乙酸(NAA)激素配比以及抗生素对菊花再生的影响进行系统深入的研究,旨在建立高效再生及转化体系,为盆栽小菊的分子遗传育种奠定基础。
1 材料与方法
1.1 试验材料
供试材料为盆栽小菊品种微风深红、花洒绿色心情、色彩火山、微风橙绿、微风玫瑰、微风索尔、青柠水晶、梦幻粉水晶、红水晶、微风红霞和粉色,取自南京农业大学中国菊花种质资源保存中心。
1.2 性状选取与数量采集
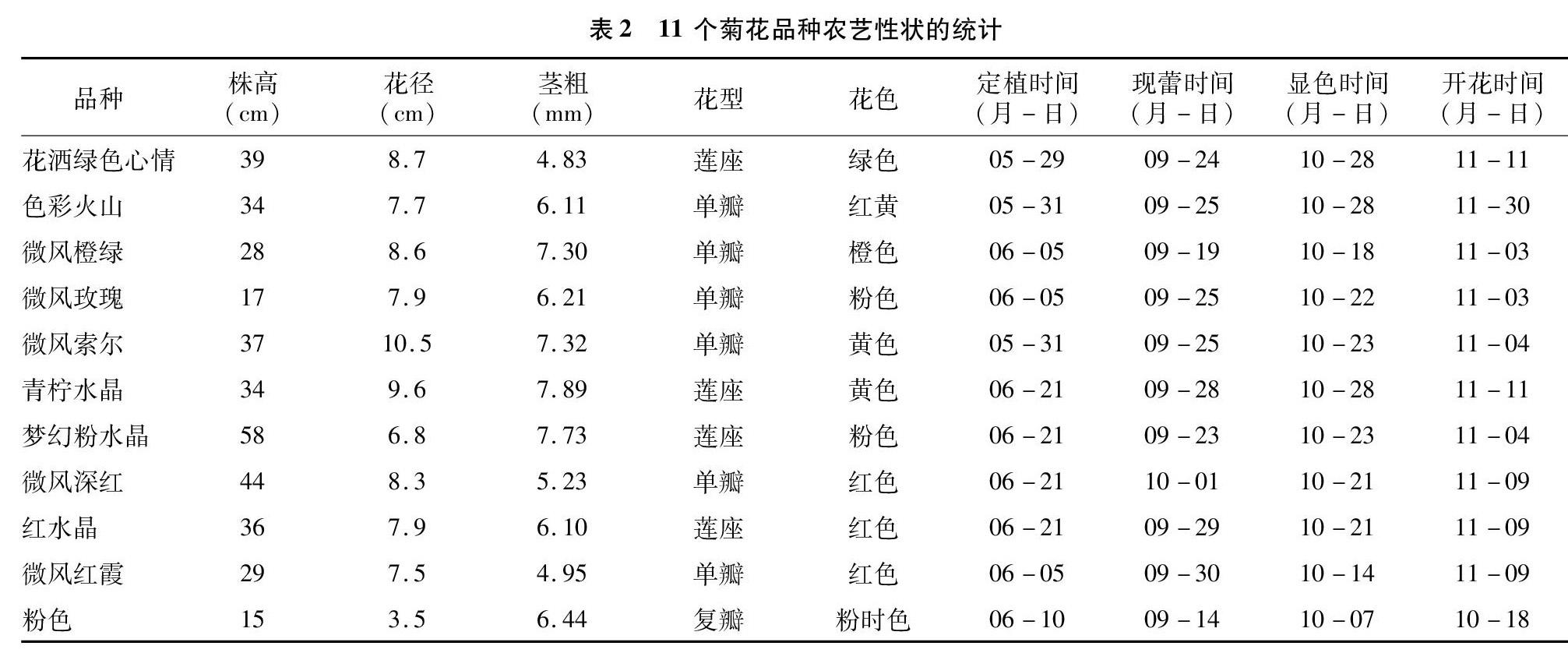
从定植到开花期,对 11 个品种的株高、茎粗、花径、花型、花色、定植时间、现蕾时间、开花时间这 9 个性状[8]采用直尺、游标卡尺、目测的方法进行测定,每个品种 10 次重复。
1.3 培养基与培养条件
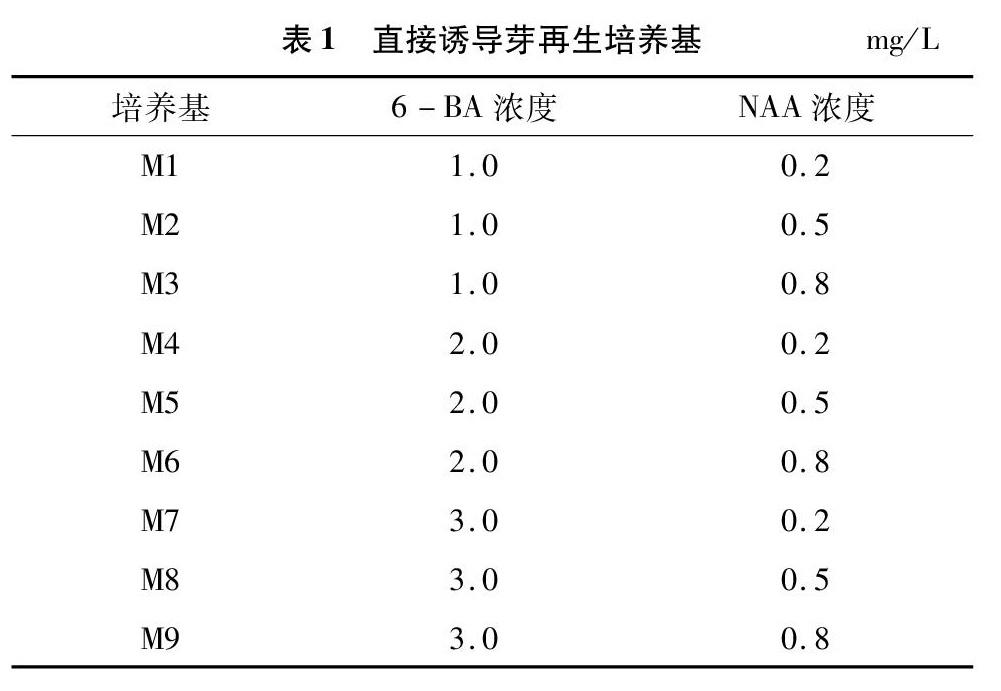
以 MS培养基[9]作为基本培养基,在此基础上添加 30 g/L蔗糖和 6.5 g/L琼脂,植物生长调节剂选用不同浓度比的 6-BA 和 NAA,用 1 mol/L NaOH 调节pH值至5.8,116 ℃高温高压灭菌 30 min。培养室温度为25 ℃,光照度 20~25 lx,每天光照12 h。
1.4 不同基因型叶片外植体再生差异
挑选 3 个具有代表性的、含不同浓度比 6-BA 和 NAA 的分化培养基M2、M5、M7 (表 1)对 11 个品种进行初步筛选[10]。从中挑选出再生率高的6个品种,使用9个不同浓度配比6-BA和NAA的分化培养基 M1~M9 (表1)对其细筛选。各品种每个培养基接种 30 个叶盘,3 次重复。30 d 后统计再生率,不定芽再生率=再生不定芽外植体数/接种外植体总数×100%。
1.5 卡那霉素和潮霉素筛选浓度的确定
1.5.1 叶片外植体分化 以筛选出的品种为材料,将叶片接种于含不同浓度梯度的卡那霉素(Km)和潮霉素(Hyg)的最适分化培养基上,Km 和 Hyg设置 0、5、10、15、20、25 mg/L 6 个浓度处理,每个处理接种 30 个外植体,3 次重复。30 d 后统计分化情况。
1.5.2 不定芽生根 以筛选出的品种为材料,将不定芽接种于含不同浓度梯度的 Km 和 Hyg 的生根培养基上,Km 和 Hyg设置为 0、5、8、10、12、15 mg/L 6 个浓度处理,每个处理接种10 个外植体,3 次重复。15 d 后统计生根情况。
1.6 羧苄青霉素抑菌浓度的确定
将生长状况一致的叶片外植体用无菌手术刀切成约 5 cm × 5 cm 大小的叶盘,在最适分化培养基上培养 3 d,用农杆菌侵染 7 min 后将多余菌液吹干,置于最适分化培养基中黑暗共培养 3 d,将叶盘转入含有不同浓度的羧苄青霉素(Cb)培养基中,Cb设置为 0、200、300、400、500 mg/L 共5个处理,同时以未侵染农杆菌的叶盘作为空白对照,每个处理接种 20 个外植体,每个处理3 次重复。15 d 后统计抑菌情况。
2 结果与分析
2.1 11个盆栽小菊农艺性状观察
对2018 年定植的11个盆栽小菊品种基本性状进行数据统计,结果(表2)表明,11 个品种的株高在15~58 cm之间,茎粗在4.83~7.89 cm之间;微风索尔的花径最大,达 10.5 cm,花径最小的品种是粉色,仅3.5 cm;花色中多为粉色、红色、黄色;品种粉色从定植到开花的时间最短,为 130 d。
2.2 不同基因型叶片外植体再生差异
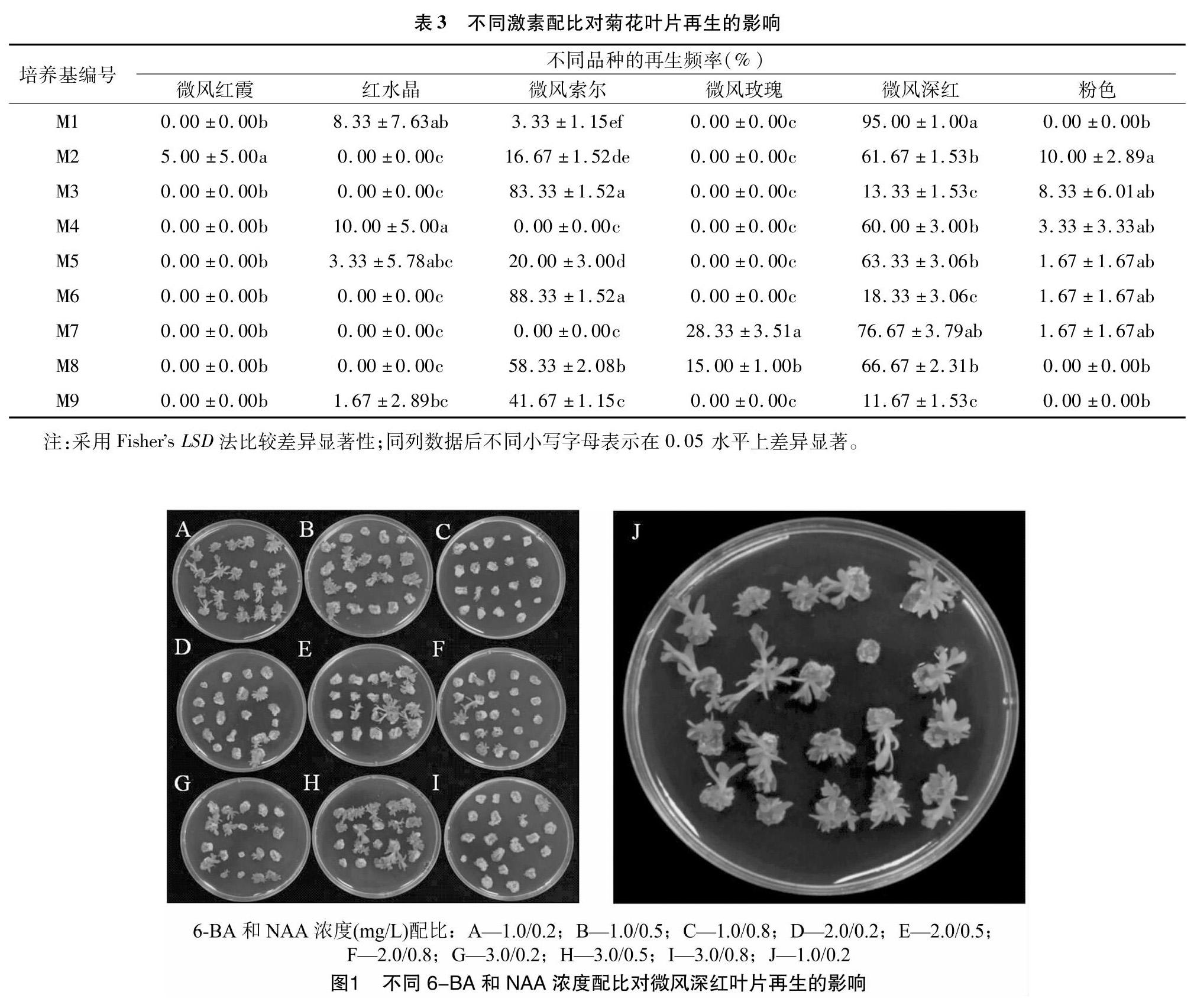
在 3 种常用分化培养基上,11 个品种盆栽小菊的叶片外植体分化差异较大,其中微风深红、微风索尔、微风红霞、微风玫瑰、粉色、红水晶都能产生不定芽,但是其他品种梦幻粉水晶、花洒绿色心情、色彩火山、微风橙绿、青柠水晶都出现明显的褐化现象且不能分化出不定芽。因此,本试验选择微风深红、微风索尔、微风红霞、微风玫瑰、粉色、红水晶 6 个品种进行下一步细筛试验。
Renou等的试验表明,6-BA 和 NAA 是对菊花再生最佳的植物生长调节剂[11]。将 6 种盆栽菊花叶片外植体接种在 9 种含不同配比 NAA 和 6-BA 激素的分化培养基上进行再生率的观察。从表 3 可以看出,只有品种微风深红可以在所有不同配比的分化培养基上都分化出不定芽,同一品种在不同的激素浓度处理下分化情况有着较大的差异,当 6-BA、NAA 浓度分别为 1.0、0.2 mg/L 时,再生率最高,可达 95%(表3、图1)。试验结果还可以看出,在同一处理下不同盆栽菊的分化情况也有所不同,其他 5 个品种只能在特定 NAA 和 6-BA 比例的 MS 培养基上产生不定芽。此结论与李金童等对4种露地菊建立再生体系的试验结果[12]一致。因此,在后续试验中以微风深红作为遗传转化对象,确定其叶片分化培养基为 MS+1.0 mg/L 6-BA+0.2 mg/L NAA,其他 5 个品种不作进一步研究。
2.3 卡那霉素和潮霉素筛选浓度的确定
2.3.1 对叶片外植体再生的选择压力确定 不同基因型、不同外植體对不同选择剂甚至同一选择剂的敏感程度不同,因此须要进行选择剂浓度的确定。本试验发现,抗生素 Hyg 和 Km 对菊花幼叶再生有抑制作用,随着抗生素浓度的增加,微风深红叶片外植体再生能力逐渐下降(表 4)。当 Hyg、Km浓度分别为 10、 15 mg/L时, 叶片脱分化率分别为
30%、6.7%,不定芽的分化完全被抑制(图2、图3)。由上述结果可知,10 mg/L Hyg、15mg/L Km为微风深红叶片外植体再生的临界耐受浓度,可作为其遗传转化过程中叶片再生的选择压力。
2.3.2 不定芽生根的选择压力确定 由表5可知,抗生素 Km 和 Hyg 对微风深红茎段外植体生根具有抑制作用,且抗生素浓度越大,抑制作用越明显。当 Km 和 Hyg浓度分别上升为 10、8 mg/L时,茎段外植体的生根能力完全被抑制(图 4、图5)。因此,10 mg/L Km、8 mg/L Hyg为微风深红茎段生根的临
2.4 羧苄青霉素抑菌浓度的确定
由表6可知,Cb 对农杆菌的抑制效果相对明显。当不添加 Cb 时,经过农杆菌侵染的叶片外植体农杆菌大量繁殖导致植株死亡,叶片不能进行分化,而未经侵染的叶片外植体再生率可达 92.9%(图6);而随着 Cb 浓度的増大,叶片周围产生的菌落逐渐减少,部分外植体伤口边缘有褐化现象;当 Cb 浓度达到 400 mg/L 时,农杆菌生长被完全抑制,无可见菌斑,叶片正常分化,再生频率可达 89.7%;当Cb 浓度为 500 mg/L 时,虽然抑制了农杆菌的生长,但叶盘也受到了毒害,甚至褐化死亡,再生率下降。因此,最适抑菌浓度为 400 mg/L。
3 讨论
植物组织培养一直是获得再生植株和植物基因工程育种的关键步骤之一,对于遗传转化体系来说,拥有高效的再生率是其必要条件[13]。但菊花的组织培养具有复杂性和多样性, 不同品种间再生能
力有很大的差异,激素种类以及配比的不同都对再生有影响[14]。在菊花的离体培养中使用最广泛的激素为 6-BA 和 NAA[15],毛洪玉等诱导地被菊中国红叶片,在 MS+2.0 mg/L 6-BA+0.2 mg/L NAA的培养基上获得了最高的不定芽分化率[16];梁芳等诱导菊花品种狮子头叶片,发现最适的分化培养基为 MS+0.1 mg/L NAA+1.0 mg/L 6-BA[17]。吴志苹等的试验表明,菊花金不凋愈伤组织不定芽分化的最适培养基为 MS+1.5 mg/L 6-BA+0.5 mg/L NAA,不定芽分化率为 900%[18]。本研究以 MS 培养基为基础,在不同的 6-BA和 NAA 组合下,对 11 个不同基因型盆栽小菊叶片外植体进行再生能
力评估。其中,菊花品种微风深红的分化能力最强,在 MS+1.0 mg/L 6-BA+0.2 mg/L NAA的分化培养基中再生频率高达 95%。结果表明,不同基因型菊花最适的 6-BA 和 NAA 配比是不同的,基因型是影响外植体高效再生的决定性因素,这与前人的观点[19]一致。
在使用不同浓度激素配比进行最适再生培养基筛选时,很多叶片会出现褐化现象,组培褐化的发生与否通常由植物种类及自身基因型决定[20]。本试验中除微风深红其他品种均出现褐化且再生率较低,这可能与植物自身的基因型有关。彭思维等在研究火龙果茎段愈伤组织诱导时发现,高浓度的生长调节剂噻苯隆(TDZ)会导致植物组织加快分裂,使得愈伤组织来不及吸收营养最终褐化[21]。在进行愈伤诱导时使用不同浓度配比的6-BA 和NAA,随着6-BA 浓度的升高,褐化品种的叶片褐化率升高。菊花叶片的褐化是与植物自身的基因型有关,还是与植物生长调节剂的类型及浓度使用不当有关,具体原因须要进一步研究。
菊花的遗传转化中最常使用的选择标记抗生素主要是卡那霉素和潮霉素[22],卡那霉素的使用浓度范围一般为 5~50 mg/L,潮霉素为 5~20 mg/L[15]。本试验发现,微风深红对 Hyg 比对 Km 更为敏感,当 Hyg 浓度为10 mg/L 时已经可以完全抑制其分化,但是 Km 浓度要达到 15 mg/L 时才能起到完全抑制分化的作用。宁云霞用叶盘作为外植体对菊花白安娜分化的 Hyg 浓度进行筛选,发现8 mg/L Hyg 是菊花叶盘最适的抗性选择压力[23],在本试验中微分深红叶盘分化的临界浓度为 10 mg/L Hyg,这表明不同基因型菊花对 Hyg 的敏感度不同。本试验中只看到少数转化后的外植体产生抗性芽,原因之一可能是预培养的时间不合理,贾红梅等的研究表明,预培养时间过长会造成菊花叶片切割处褐化,影响转化的成功率[24];原因之二可能是潮霉素对植物组织有很大的毒害作用,即使是低浓度的潮霉素也会产生很大的毒害作用[25-26]。本试验在经过农杆菌侵染后添加 Cb 抑菌,从试验结果可以看出,Cb 浓度升高使得不定芽分化受到抑制,這与da Silva发现的 Cb 对菊花外植体分化不定芽具有一定毒性的结论[27]一致。因此,抗生素在筛选转化细胞的同时也对细胞有毒害作用,如何减少抗生素的毒害作用、提高转化效率是今后菊花基因工程育种努力的方向。
4 结论
本研究从11个盆栽小菊品种中筛选出较其他品种有很大再生优势的品种微风深红,通过叶片外植体建立再生体系和遗传转化体系,其最适分化培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA,再生率为 95.0%;叶片分化对 Km 和 Hyg 的抗性选择压分别为15、10 mg/L;生根的抗性选择压分别为 10、8 mg/L;Cb的最适浓度范围为 200~400 mg/L。本研究能为今后菊花的转基因工作奠定良好的基础。
参考文献:
[1]Peng H,Zhang F,Jiang J F,et al. Identification of quantitative trait loci for branching traits of spray cut chrysanthemum[J]. Euphytica,2015,202(3):385-392.
[2]王碧玉. 菊花再生及遗传转化体系的研究[D]. 沈阳:沈阳农业大学,2017.
[3]周蕴薇,刘 彧,马 欣,等. 根癌农杆菌介导地被菊‘紫妍遗传转化体系的建立[J]. 西北农业学报,2016,25(12):1861-1869.
[4]Horsch R B,Fry J E,Hoffmann N L,et al. A simple and general method for transferring genes into plants[J]. Science,1985,227(4691):1229-1231.
[5]程密密,杨 霞,杨玉灿,等. 翠菊品种库蕾娜叶片和叶柄及茎段的再生研究[J]. 黑龙江农业科学,2014(10):20-22.
[6]魏曼曼,王江民,Imtiaz M,等. 菊花花色嵌合花瓣的离体培养及植株再生[J]. 北京林业大学学报,2014,36(4):107-112.
[7]丁晓霞. 菊花组培再生体系研究进展[J]. 辽宁林业科技,2018(4):64-65,68.
[8]冯晴云. 切花菊表型性状遗传多样性分析及初选核心种质构建[D]. 南京:南京农业大学,2015.
[9]Murashige T,Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum,1962,15(3):473-497.
[10]吴慧莹. 蓝色花色转基因受体菊花品种筛选及其再生体系建立[D]. 南京:南京农业大学,2015.
[11]Renou J P,Brochard P,Jalouzot R. Recovery of transgenic chrysanthemum (Dendranthema grandiflora Tzvelev) after hygromycin resistance selection[J]. Plant Science,1993,89(2):185-197.
[12]李金童,吴雅妮,丁 兵,等. 四种露地菊再生体系的建立[J]. 北方园艺,2016(19):119-124.
[13]张 微,王良群,刘 勇,等. 玉米不同部位愈伤组织诱导及植株再生的比较研究[J]. 核农学报,2017,31(11):2135-2144.
[14]赵喜亭,蒋丽微,王 苗,等. 怀黄菊间接体胚受体再生体系的建立及CmTGA1的遗传转化[J]. 植物学报,2016,51(4):525-532.
[15]许高娟. 部分菊花近缘种属植物黑斑病苗期抗性及hrfA基因转化菊花的研究[D]. 南京:南京农业大学,2009.
[16]毛洪玉,周 杨,刘 迪,等. 地被菊‘中国红再生及遗传转化体系的建立[J]. 沈阳农业大学学报,2015,46(6):672-677.
[17]梁 芳,王默霏,王洁琼,等. 菊花高效再生体系的建立及抗生素对叶片分化的影响[J]. 江苏农业科学,2015,43(6):40-43.
[18]吴志苹,高亦珂,范 敏,等. 菊花‘金不凋再生及遗传转化体系的构建[J]. 分子植物育种,2020,18(1):150-158.
[19]da Silva J A T. Chrysanthemum:advances in tissue culture,cryopreservation,postharvest technology,genetics and transgenic biotechnology[J]. Biotechnology Advances,2003,21(8):715-766.
[20]冯代弟,王 燕,陈剑平. 植物组培褐化发生机制的研究进展[J]. 浙江农业学报,2015,27(6):1108-1116.
[21]彭思維,王永清,范建新,等. 火龙果茎段愈伤组织诱导及再生体系的建立[J]. 核农学报,2015,29(5):885-891.
[22]Song J Y,Sivanesan I,Jeong B R. Use of petal explants for successful transformation of Dendranthema×grandiflorum Kitamura ‘Orlando mediated by Agrobacterium tumefaciens[J]. African Journal of Biotechnology,2012,11(37):9141-9148.
[23]宁云霞. 菊花花色芽变分离鉴定及‘白安娜遗传转化体系的建立[D]. 南京:南京农业大学,2016:31-39.
[24]贾红梅,王碧玉,刘 迪,等. 农杆菌介导CBL基因对菊花品种‘C008的转化[J]. 西北林学院学报,2017,32(1):184-189.
[25]Nyaboga E,Tripathi J N,Manoharan R,et al. Agrobacterium-mediated genetic transformation of yam (Dioscorea rotundata):an important tool for functional study of genes and crop improvement[J]. Frontiers in Plant Science,2015,5:463.
[26]Liu H,Zhao H X,Wu L H,et al. A genetic transformation method for cadmium hyperaccumulator Sedum plumbizincicola and non-hyperaccumulating ecotype of Sedum alfredii[J]. Frontiers in Plant Science,2017,8:1047.
[27]da Silva J A T. Thin cell layer technology for induced response and control of rhizogenesis in chrysanthemum[J]. Plant Growth Regulation,2003,39(1):67-76.衣政伟,胡中泽,杨大柳,等. 播量和播期对苏中地区小麦生长发育及产量的影响[J]. 江苏农业科学,2020,48(11):67-72.
