生物材料肝素固定化结合方式专利技术综述
2020-08-04郑琼娟薛发珍
郑琼娟 薛发珍

摘要:本文阐述了专利申请中生物材料肝素固定化结合方式,主要包括物理混合、离子键合和化学键合,并对不同的方法进行了比较。对生物材料领域科学研究、产业发展、专利申请以及审查工作等方面具有一定的指导作用。
关键词:生物材料;肝素;固定化;物理混合;离子键合;化学键合
中图分类号:R973 文献标识码:A 文章编号:1003-5168(2020)09-0080-03
1 引言
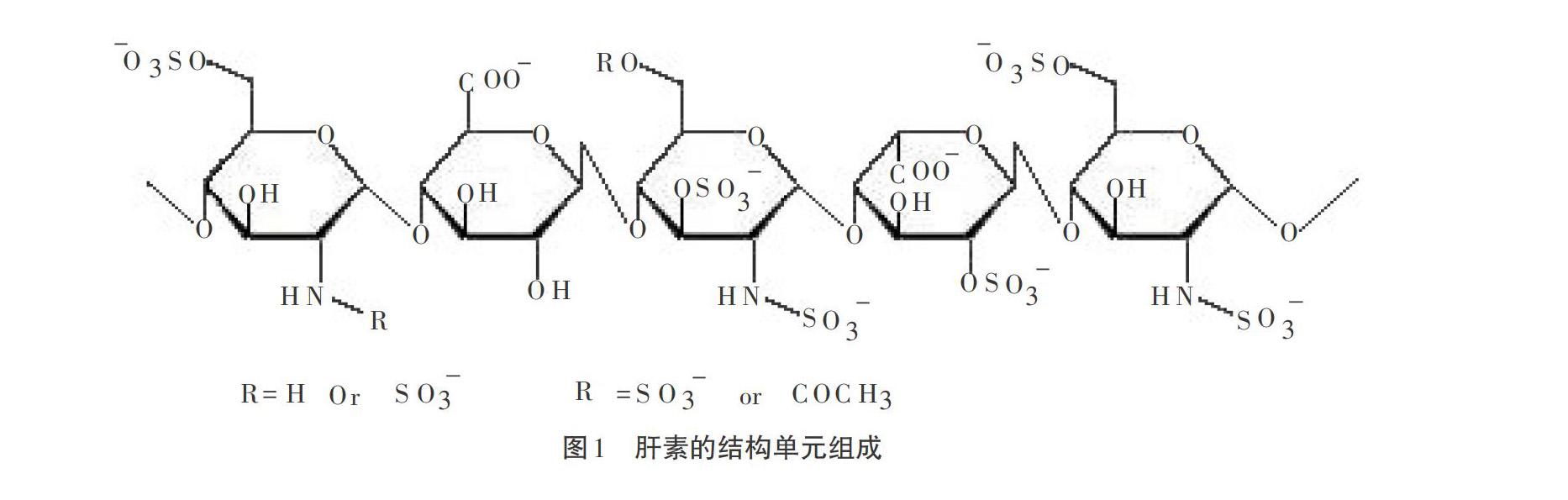
肝素的生物学作用主要是通过与抗凝血酶Ⅲ相互作用,肝素分子含有硫酸化残基,其允许多糖以高亲和力与抗凝血酶结合,从而加速凝血因子的失活。存在于动物体内的肝素具有良好的抗凝血作用,但其在体内停留的时间不长,通过固定化可以延长肝素在体内的作用时间,其中肝素固定化就是肝素大分子在生物材料表面上的固定化。通过肝素化来提高生物材料抗凝血性,是公认的改进生物材料抗凝血性能最好的方法之一。本文统计了专利申请中肝素固定化生物材料主要的结合方式:物理混合、离子键合和化学键合。
2 物理混合
物理混合主要利用物理包埋作用、分子链的缠绕和渗透、多孔材料的吸附作用等原理将肝素固定到生物材料表面。肝素在上述固定化的过程中未发生任何化学作用,因此保留了原始构象,能够较好地发挥抗凝血性能。
常用来与肝素共混的主要是具有较高生物相容性的天然高分子:专利JPH01124465A[1]采用胶原或明胶与肝素进行共混成膜,用于人造血管等生物材料的抗凝血用;专利US2003161938A1[2]将低分子量肝素或硫酸乙酰肝素等,与多聚赖氨酸或肽混合进行涂层,其中所述肽优选具有精氨酸-赖氨酸-天冬氨酸-丝氨酸序列的四肽或者具有精氨酸-赖氨酸-天冬氨酸-赖氨酸序列的四肽,这些肽一方面可以抑制血小板聚集并可提高溶栓治疗的功效和效力,另一方面具有很快粘附到表面上的能力,可以显著减少接触时间,以便在医疗装置如心脏麻痹单元,氧合器或支架上获得不可逆涂层;专利CN101879330A[3]将丝素蛋白与肝素制备成混合液,注入复合体中层的内表面,经冷冻干燥处理后,在复合体内层形成丝素多孔材料等。
物理混合方法简便易行,但由于物理固定具有稳定性差和可控性差,故实用性较低,在三种主要固定方式中占比最低。
3 離子键合
离子键合是利用正、负电荷之间的相互作用将带有负电荷的肝素固定在生物材料的表面上。由于肝素分子上含有大量的负电性基团:羟基、羧基、磺酸基,具体如图1所述,可以引入带正电性的季铵基团偶联剂或阳离子表面活性剂与肝素发生静电吸附,如图2所示,从而实现肝素的固定,如GERALD A、GRODE等[4]采用偶联剂TDMAC通过两步法,将偶联剂与生物材料进行反应,从而在生物材料表面上引入阳离子基团,再利用季铵根离子与肝素分子的正负电荷吸附作用,将肝素吸附固定在生物材料上;专利JP2000202031A[5],将TDMAC与肝素优先形成TDMAC化肝素溶液,再利用AC段与生物材料的亲和力进行结合;专利JPS4813341B2B1[6]设计了一种通过用由肝素和阳离子表面活性剂组成的有机溶剂可溶的共沉淀材料或包含溶解在有机溶剂中的这种共沉淀材料和塑料材料的液体组合物涂覆制品而在制品上提供抗凝血表面的方法,然后干燥如此处理的制品,可应用于任何与血液接触的物品,如人工心脏,人工心脏瓣膜等。
离子键合还可以合成带有阳离子基团如氨基等的高聚物,再与肝素作用,通过离子键合形成肝素涂层。如专利JPS498583A[7]在十二烷基硫醇和溴仿的存在下使丙烯腈和丙烯酸聚合,然后接枝甲基丙烯酸二甲基氨基乙酯,季铵化后吸附肝素形成肝素涂层。
为了进一步提高离子键合的结合力,可通过多层离子键结合以固定肝素,如CN1836743A[8]先用芯材材料聚乳酸、或聚乙醇酸及其共聚物、或聚己内酯制成多孔的支架,然后用带有正电荷的壳聚糖或胶原,与带有负电荷的硫酸软骨素或硫酸肝素组装材料交替按顺序一层一层自组装在多孔支架芯材外层,重复自组装步骤直到设计的组装层数,而后快速冷冻和真空冷冻,即得到多孔、分层、三维空间多级结构的组织支架材料。
总体而言,离子键合较物理混合稳定,能够维持肝素的原始构象,最大限度地保留抗凝血效果。但通过离子键合多层结合并不能很好的暴露抗凝血酶结合序列,导致抗凝血活性不能得到较好发挥,加之肝素易被血液中其它阴离子置换或因离子键的断裂而快速释放,使得生物材料表面较快失去抗凝血活性。
4 共价键合
共价键合利用生物材料表面上固有的,或者改性后具有的功能基团,如-NH2、-COOH、-NCO、-OH、等基团与肝素分子上的-OH、-COOH、-NH或共价结合,如专利US2005244453A[9]通过处理包括粘附聚合物和肝素的涂层组合物形成的涂料化合物,其中粘附聚合物和生物相容性药剂通过光敏部分偶联,如使用聚(丁基)甲基丙烯酸酯通过光敏部分与肝素发生光发生化学反应实现偶联;或通过交联剂如戊二醛、EDC的交联反应,实现对肝素的共价固定,如EP0352330A1[10]通过交联剂碳二亚胺或戊二醛实现肝素在丝素蛋白上的固定,并可根据需要进行成型,如流延成膜用于制备血液容器等。
相比于离子键合,共价键合具有更高的稳定性,由此获得的肝素化生物材料在临床上可长期使用。然而,更为稳固的固定结构,一定程度上反而限制了肝素分子的原始构象,导致被固定化肝素分子的生物活性被削弱。相应的,其抗凝血性能也受到一定的影响,上述问题是共价键合最大的缺陷。
为了解决共价键合后带来的肝素活性下降的问题,可通过以下两种手段进行改善:
第一,在生物材料表面与肝素分子之间连接一“空间臂”以增加肝素分子的自由性,如专利JPH09108331A[11]将肝素分子通过与半缩醛部位线性结合而延伸的尿素结合和烷基的悬垂支路接枝聚合并固定在生物材料上,构成树枝部分的烷基有3~6个碳,通过上述改性方法可以实现防止肝素由于离子键合洗脱流失的同时,肝素与高分子材料之间的间隔可以确保肝素的柔软运动性,进而能够长时间保持持续优异的抗血栓性;专利US2005266038A1[12]通过胺封端的PEG偶联到醛封端的肝素上,随后除去第二胺上的t-BOC保护基团,然后可以使用第二氨基将肝素间隔部分接枝到聚合物或底物表面上,由此可使肝素分子具有柔性,从而使肝素分子的结合位点能够被结合蛋白接近。采用连接“空间臂”法一方面可以提高肝素分子的自由性,显著提高共价键合肝素的抗凝血活性;另一方面,相对离子键合,具有较强的结构稳定性,可满足实际应用要求。因此,上述方法成为肝素固定化研究中未来最值得重点研究和完善的技术。
第二,控制肝素分子與生物材料表面的键合量,如终点固定法,专利CN102600515A[13]将高分子材料浸泡在高锰酸钾的硫酸溶液中,进行酸化处理;将材料置于聚乙烯亚胺溶液中,以得到氨基化修饰的表面;将肝素钠溶于去离子水中,加入亚硝酸,低温重氮化处理肝素钠,得到多糖片段A;氧化处理海藻酸钠,使得海藻酸片段末端暴露醛基,得到多醛基海藻酸钠,即多糖片段B;配置多糖片段A和B的反应液,将氨基化修饰表面的材料置于反应液中,通过终点固定法得到复合涂层。所得涂层中海藻酸钠和肝素集团固定在材料的表面,增大与血液接触的面积,有效发挥性质;终点固定法实施方便,结合牢固,空间构象好,能有效增加生物相容性和抗凝活性。
就稳定性而言,通过共价键合法远较离子键合法和物理混合法的高,但就固定化肝素的抗凝血性来说,一般却正相反。因此,如何提高共价键合固定化肝素的抗凝血性,同时又不影响生物材料的本体性能,一直是肝素化生物材料领域研究的重点内容。为了平衡上述问题,出现了同时使用离子键和共价键结合的方式,如US4118485[14],首先用伯胺试剂处理,使得肝素基本上所有阴离子基团被烷基铵离子封闭,然后用二醛处理生物材料表面,这种稳定化处理肝素具有完全的生理活性,并且在与血液或血浆接触时不从表面释放。
5 结语
基于固定化肝素的稳定性和生物材料的抗凝血性的抗衡,共价键合法和离子键合法成为固定化肝素的两种主要方式。今后的研究重点应放在肝素固定化技术的改进上,研制出抗凝血性良好,同时其他生物学性能优良的新型抗凝血生物材料。
参考文献:
[1] KANEGAFUCHI CHEM KK.COMPOSITION FOR ARTIFICIAL BASEMENT MEMBRANE AND IMPLANTATION DEVICE WITH ARTIFICIAL BASEMENT MEMBRANE:JPH01124465A[P].1989.
[2] Bo Johnson,等.Compositon and method for coating medical devices:US2003161938A1[P].2003.
[3] 赵荟菁,等.一种小口径丝素蛋白管状材料及其制备方法:CN101879330A[P].2010.
[4] GERALD A . GRODE等.Biocompatible Materials for Use in the Vascular System [J].J. BIOMED. MATER. RES. SYMPOSIUM,1972(3):77–84.
[5] AMANO KENICHI,等.ANTICOAGULANT INTRODUCER SHEATH:JP2000202031A[P].2000.
[6] Eiichi Masuhara,等.METHOD FOR PROVIDING ANTICOAGULANT SURFACES ONTO ARTICLES:US3717502A[P].1973.
[7] Heparin plastic anticoagulant coating - based on heparin-cationic surfactant complexand polymethacrylates, polyepichlorohydrin or polyurethane:JPS498583A[P].1974.
[8] 闫玉华,等.多孔、分层、三维空间多级结构的组织支架材料及其制备方法:CN1836743A[P].2006.
[9] Sean M Stucke,等.Composition and method for preparing biocompatible surfaces:US2005244453A[P].2005.
[10] HIRABAYASHI,等.FIBROIN MOLDINGS, PROCESS FOR THEIR PREPARATION, HEPARIN-IMMOBILIZING CARRIER,AND PROCESS FOR ITS PREPARATION:EP0352330A1[P].1990.
[11] NIPPON SHERWOOD KK,等.High polymer material having persistent anti-platelet activity - contains heparin molecule polyvinylidene chloride chloropolyethylene, chloropolypropylene and copolymer:JPH09108331A[P].1997.
[12] ThierryGlauser,等.Antifouling heparin coatings:US2005266038A1[P].2005.
[13] 李彤,等.一种多糖分子片段复合涂层的制备方法:CN102600515A[P].2012.
[14] ERIKSSON JAN CHRISTER,等.Non-thrombogenic medical article and a method for its preparation:US4118485[P].1978.
