干扰PARP-1基因对人胃癌HGC-27细胞增殖、凋亡及放射敏感性的影响
2020-08-04费晶,巩平
费 晶,巩 平
石河子大学医学院第一附属医院肿瘤内科 新疆石河子 832000
胃癌是最常见的恶性肿瘤之一,多种因素导致胃癌的发生和发展,其发病机制非常复杂[1]。据报道[2],我国胃癌的疗效在一定程度上有所改善,但由于缺乏特定症状,早期胃癌诊断困难。胃切除术联合放疗广泛用于胃癌的治疗,然而晚期胃癌患者的预后并不理想。基因治疗在肿瘤治疗中越来越受到重视,许多癌基因和抑癌基因的异常表达可能影响肿瘤细胞凋亡、放射敏感性和患者预后[3]。因此,已经提出了肿瘤基因治疗和放射治疗联合的治疗手段。多聚腺苷二磷酸核糖聚合酶-1[poly(ADP-ribose)polymerase-1,PARP-1]是一种修复DNA链断裂的基因,参与维持基因组的完整性[4]。研究[5]表明,肿瘤细胞经X射线照射后PARP-1的表达迅速升高,可修复DNA损伤进而降低肿瘤细胞的放射敏感性。已有报道[6-8]发现沉默PARP-1基因可增强卵巢癌细胞、乳腺癌细胞及宫颈癌细胞等的放射敏感性。有研究[9]发现,PARP-1在胃癌组织中亦呈高表达。本研究观察了干扰PARP-1的表达对胃癌细胞增殖、凋亡及放射敏感性的影响,以期为胃癌的基因治疗提供可能的作用靶点。
1 材料与方法
1.1材料人正常胃黏膜上皮细胞GES-1及人胃癌细胞MKN-45、MGC-803、SGC-7901、AGS、HGC-27均购自美国ATCC细胞库。PARP-1抗体、GAPDH抗体、Caspase-3抗体、Caspase-8抗体及辣根过氧化物酶标记的二抗均购自美国CST公司,CCK-8检测试剂盒购自日本Dojindo公司,Annexin-Ⅴ/PI双染细胞凋亡检测试剂盒购自日本TaKaRa公司,特异性PARP-1 siRNA和非特异性siRNA(si-NC)均由上海吉玛制药技术有限公司合成,RPMI 1640培养基、胎牛血清购自美国Gibco公司,Trizol试剂盒、反转录试剂盒、荧光定量PCR检测试剂盒购自美国Promega公司,Lipofectamine 2000脂质体转染试剂购自美国Invitrogen公司,细胞裂解液、BCA蛋白浓度检测试剂盒、ECL化学发光试剂均购自北京中杉金桥生物技术有限公司。
1.2细胞培养GES-1、MKN-45、MGC-803、SGC-7901、AGS、HGC-27细胞均在含体积分数10%胎牛血清的RPMI 1640培养基中,37 ℃、体积分数5%CO2条件下培养。根据各细胞生长状态及时更换培养基,待细胞生长至汇合度达80%以上时,使用胰蛋白酶消化细胞,并进行传代培养。取处于对数生长期的细胞进行后续实验。
1.3不同细胞PARP-1mRNA表达的检测采用Trizol法分别提取GES-1、MKN-45、MGC-803、SGC-7901、AGS、HGC-27细胞的总RNA,参照反转录试剂盒说明书合成cDNA。PARP-1引物序列:上游5’-AAGGCGAATGCCAGCGTTAC-3’,下游5’-GGCACTCTTGGAGACCATGTCA-3’;GAPDH引物序列:上游5’-GCACCGTCAAGGCTGAGAAC-3’,下游5’-AUAAUUUCAUGAAGUGCUCTT-3’。以上引物均由上海生工生物工程有限公司合成。根据荧光定量PCR检测试剂盒说明进行扩增,以GAPDH为内参。20 μL反应体系:cDNA模板0.8 μL,上、下游引物(0.2 μmol/L)各0.8 μL,2×SYBR Green qPCR Mix 10 μL,ddH2O 7.6 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,40个循环。采用2-ΔΔCt法计算PARP-1 mRNA的相对表达量。实验重复3次。
1.4HGC-27细胞转染及分组取HGC-27细胞接种于6孔板,继续培养24 h,待细胞贴壁生长,汇合度达50%时分为3组,si-PARP-1组和阴性对照组采用脂质体法分别转染特异性PARP-1 siRNA和si-NC,未转染的HGC-27细胞为空白对照。转染后各组细胞置于37 ℃恒温培养箱继续培养。以下实验每组细胞设置3个平行孔,重复3次。
1.53组HGC-27细胞PARP-1mRNA和蛋白表达的检测转染48 h后提取3组HGC-27细胞的总RNA,同1.3方法检测PARP-1 mRNA的表达。分别收集转染48 h后各组HGC-27细胞,加入细胞裂解液提取蛋白,采用BCA试剂盒检测蛋白浓度,在蛋白样品中加入适量加样缓冲液,沸水浴中加热15 min致蛋白变性。在上样孔中加入等量变性蛋白样品,行SDS-PAGE电泳,分离蛋白后电转至硝酸纤维素膜上,置于含50 g/L脱脂奶粉中封闭2 h。加入PARP-1一抗(1∶800稀释),4 ℃下过夜。再加入按1∶3 000稀释的二抗,室温下1 h,采用ECL化学发光,显影,以GAPDH为内参,计算目的蛋白的相对表达量。
1.63组HGC-27细胞增殖能力的检测转染24、48、72、96 h时,分别取3组细胞,每孔细胞中加入CCK-8试剂10 μL,置37 ℃培养箱继续孵育4 h,使用酶标仪检测波长490 nm处吸光度(A)值。
1.73组HGC-27细胞凋亡检测分别收集转染48 h后3组HGC-27细胞,胰蛋白酶消化后,加入100 μL结合缓冲液重悬细胞,调整细胞密度为1×105个/mL,采用Annexin-Ⅴ/PI双染法,室温下避光进行,再加入400 μL结合缓冲液,在1 h内上流式细胞仪检测凋亡率。
1.83组HGC-27细胞Caspase-3、Caspase-8蛋白表达的检测采用Western blot法检测3组HGC-27细胞Caspase-3、Caspase-8蛋白的表达,方法同1.5,其中Caspase-3和Caspase-8一抗均按1∶1 000稀释。
1.93组HGC-27细胞放射敏感性检测转染48 h后,3组HGC-27细胞分别接种于6孔板,待细胞贴壁后,分别给予6 MV X射线(单次剂量为0、2、4、6、8 Gy)照射6 h后于37 ℃培养箱常规培养2周,用多聚甲醛固定30 min,吉姆萨染色15 min,洗去染液后晾干,在显微镜下观察、计数,以>50个细胞的克隆为有效克隆,克隆形成率=克隆形成数/接种细胞数×100%。
1.10统计学处理采用SPSS 21.0处理数据。应用单因素方差分析比较不同细胞间PARP-1 mRNA表达的差异,以及3组HGC-27细胞PARP-1 mRNA和蛋白表达水平、增殖能力、凋亡率、克隆形成率和Caspase-3、Caspase-8蛋白表达的差异,两两比较应用SNK-q检验,检验水准α=0.05。
2 结果
2.16种细胞中PARP-1mRNA表达水平的比较GES-1、MKN-45、MGC-803、SGC-7901、AGS、HGC-27细胞中PARP-1 mRNA的表达水平分别为(0.86±0.10)、(1.42±0.16)、(1.39±0.15)、(2.42±0.30)、(1.87±0.22)、(3.28±0.35),PARP-1在人胃癌细胞中的表达均高于GES-1(P<0.05),且在HGC-27细胞中表达量最高,因此选择HGC-27细胞进行后续实验。
2.23组HGC-27细胞中PARP-1表达水平的比较转染48 h后,si-PARP-1组HGC-27细胞中PARP-1 mRNA和蛋白表达低于空白对照组和si-NC组(P<0.05),而si-NC组和空白对照组比较,差异无统计学意义(P>0.05),提示转染PARP-1 siRNA能够干扰胃癌HGC-27细胞PARP-1的表达。见图1和表1。

1~3:分别为空白对照组、si-NC组和si-PARP-1组

表1 3组HGC-27细胞中PARP-1 mRNA和蛋白表达水平的比较(n=3)
2.33组HGC-27细胞增殖能力比较转染48、72和96 h,与空白对照组和si-NC组相比,si-PARP-1组HGC-27细胞A值降低,提示细胞增殖能力减弱,见表2。

表2 3组HGC-27细胞增殖能力比较(n=3)
2.43组HGC-27细胞凋亡率及Caspase-3和Caspase-8蛋白表达水平的比较与空白对照组和si-NC组相比,si-PARP-1组HGC-27细胞凋亡率升高,Caspase-3和Caspase-8蛋白表达水平升高(P<0.05)。见图2和表3。
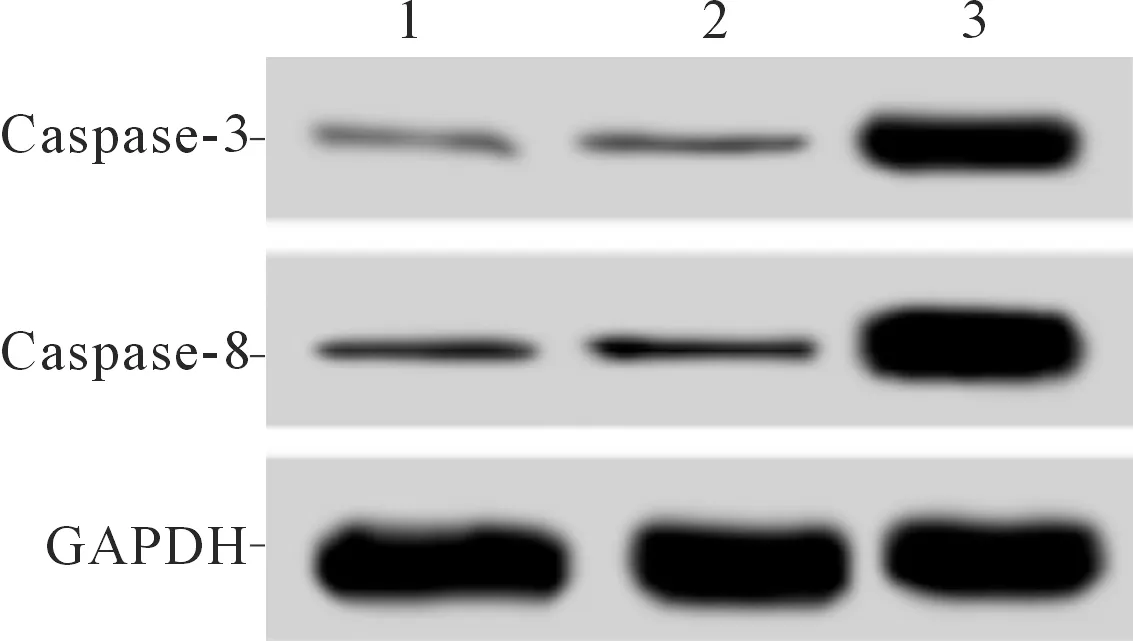
1~3:分别为空白对照组、si-NC组和si-PARP-1组
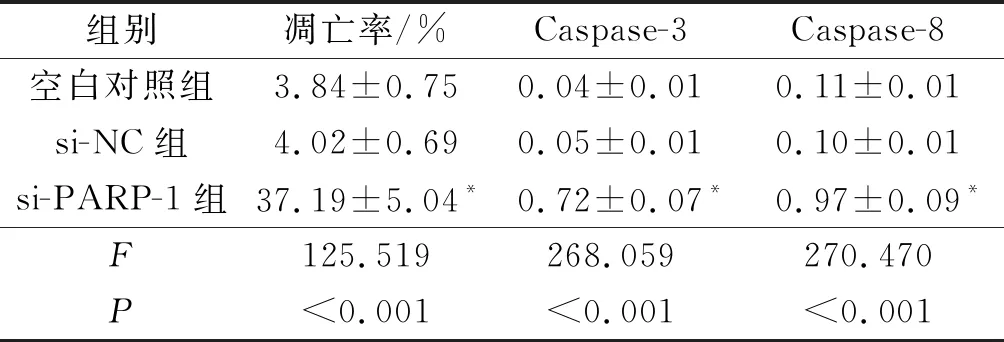
表3 3组HGC-27细胞凋亡率及Caspase-3和Caspase-8蛋白表达水平比较(n=3)
2.53组HGC-27细胞放射敏感性的比较与空白对照组和si-NC组相比,不同照射剂量下si-PARP-1组细胞克隆形成率均降低(P<0.05),见表4。
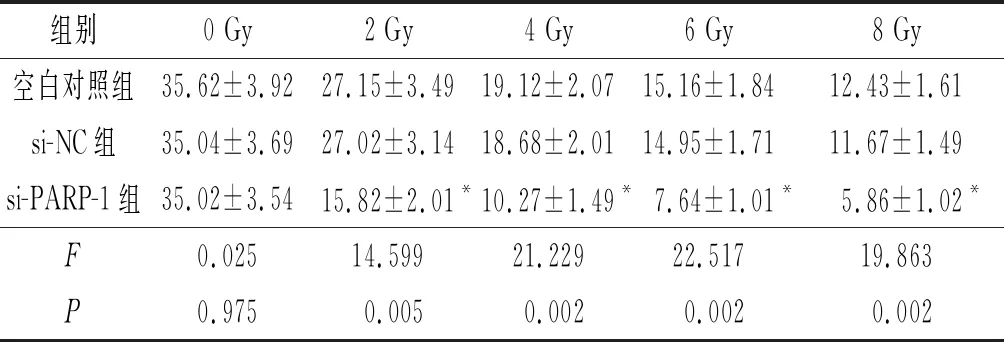
表4 不同照射剂量下3组细胞克隆形成率比较(n=3) %
3 讨论
胃癌是全球癌症相关死亡的第二大常见原因;胃癌的发生率在世界不同地区之间存在明显差异,在东亚尤其常见[10]。虽然手术是胃癌的主要治疗方法,但放射治疗在胃癌的辅助和姑息治疗中也起着重要作用,而肿瘤细胞的放射敏感性决定了放疗效果。放射治疗的分子机制主要是通过电离辐射损伤DNA双链,而多种修复途径通过修复DNA损伤降低放射治疗效果[11]。研究[12]证实,PARP-1基因具有DNA损伤修复的功能,可修复电离辐射导致的DNA双链断裂,因此靶向抑制PARP-1的表达对放射增敏具有重要意义。有研究[13]显示,PARP-1的高表达与胃癌的侵袭和预后不良密切相关。但有关PARP-1基因参与胃癌细胞放射敏感性的研究鲜见报道。
本实验首先通过qRT-PCR检测了人正常胃黏膜上皮细胞GES-1及不同胃癌细胞中PARP-1 mRNA的表达情况,结果显示,PARP-1 mRNA在胃癌细胞尤其是HGC-27细胞中的表达显著高于GES-1细胞。将特异性PARP-1 siRNA转染HGC-27细胞,结果表明,转染特异性PARP-1 siRNA可有效干扰PARP-1的表达,且转染后HGC-27细胞增殖受抑,细胞凋亡率升高,Caspase-3和Caspase-8蛋白表达水平升高;接受不同剂量X射线照射后,干扰PARP-1表达的HGC-27细胞克隆形成率降低,表明干扰PARP-1基因可提高HGC-27细胞的放射敏感性,这与Feng等[14]在乳腺癌,Kötter等[15]在胰腺癌PC3细胞、宫颈癌HeLa细胞和肺腺癌H1299细胞等中的研究相符。研究[16-17]显示Caspase-3是细胞凋亡过程中的最终执行者,其激活可促进细胞凋亡;而Caspase-8是细胞凋亡通路中的启动基因,可激活下游Caspase-3。因此推测PARP-1影响胃癌细胞放射敏感性的机制可能与Caspase-8/Caspase-3途径有关。
综上,干扰PARP-1基因可抑制胃癌细胞增殖,诱导细胞凋亡,增加细胞的放射敏感性;PARP-1基因有望成为胃癌基因治疗的新靶点。干扰PARP-1基因是否通过Caspase-8/Caspase-3途径影响胃癌细胞的放射敏感性有待验证。此外,本实验在干扰PARP-1基因后只通过Western blot法检测Caspase-3和Caspase-8蛋白的表达水平,未涉及Caspase-8/Caspase-3途径上下游基因的变化,存在不足,后续实验将对此进行补充并验证。
