来氟米特对类风湿关节炎患者外周血树突状细胞Toll受体4表达及免疫功能的影响
2020-08-04熊金河
尚 华,熊金河,何 芳,江 丹
遂宁市中心医院风湿免疫科 四川遂宁629000
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,主要表现为关节组织慢性炎症,病变关节伴有滑膜增生、血管翳形成以及关节软骨损伤[1]。RA患者周身多关节肿胀、疼痛,若治疗不及时将导致关节畸形、功能丧失,甚至会累及心血管和肺等组织器官[2]。树突状细胞(dendritic cells,DCs)是目前所知的机体内功能最强的抗原提呈细胞,成熟的DCs可以高表达多种共刺激分子(如CD40、CD80、CD86等),高水平分泌多种炎症细胞因子(如IL-12、肿瘤坏死因子α等)[3]。Toll样受体(Toll-like receptors,TLR)是一种可以识别病原体并激活免疫细胞直接产生防御的天然免疫受体。TLR4是第一个被发现的TLR,它通过识别不同配体促进多种炎症细胞因子及趋化因子的合成与释放,最终诱发和增强炎症反应[4]。研究[5-6]表明,RA患者外周血CD14+单核细胞中TLR4表达上调,且其表达与血清IL-18水平呈正相关;RA患者外周血CD8+T细胞上TLR4表达上调,TLR4参与CD8+T细胞的活化和炎症表型的表达,从而在RA发病和进展过程中发挥重要作用。Hatterer等[7]的研究也证实TLR4可以诱导细胞因子的产生,调节细胞因子的释放。
来氟米特(leflunomide,LEF)是一种异噁唑类免疫抑制剂,能抑制二氢乳清酸脱氢酶的活性,通过抑制嘧啶的全程生物合成,从而抑制淋巴细胞的增殖,通常用于RA等多种自身免疫性疾病的治疗[8]。近年来已有研究[9-11]表明LEF能够抑制DCs的成熟过程,减少其炎症因子的分泌,降低机体免疫活性,发挥治疗RA的作用。本研究观察了不同浓度LEF对RA患者DCs TLR4表达及免疫功能的影响,探讨LEF治疗RA的作用机制,为RA的治疗提供更多参考。
1 材料与方法
1.1主要试剂胎牛血清、RPMI 1640培养基购自美国Gibco-BRL公司;LEF购自北京百奥莱博科技有限公司;胰蛋白酶、BCA蛋白浓度测定试剂盒、SDS-PAGE 试剂盒购自江苏碧云天生物技术公司;Trizol试剂、PVDF膜、ECL发光液、丝裂霉素C、RIPA裂解液购自北京Solarbio公司;MTT、DMSO购于美国Sigma公司;反转录试剂盒、实时荧光定量PCR试剂盒购自宝生物工程(大连)有限公司;重组人粒细胞-巨噬细胞集落刺激因子(GM-CSF)和IL-4均购自Peprotech公司;FITC、PE标记的CD80、CD86流式抗体购于eBioscience公司;兔抗人TLR4多克隆抗体、兔抗人GAPDH多克隆抗体、HRP标记的山羊抗兔IgG、人IL-12和IL-6 ELISA检测试剂盒购自Abcam公司。
1.2DCs的来源
1.2.1 研究对象 选取2017年5月至2018年3月就诊于遂宁市中心医院的50例RA患者,其中男27例,女23例。患者入选标准:年龄30~70岁,性别不限;已签署知情同意书,自愿参与本课题研究;符合2009年欧洲抗风湿联盟(EULAR)和美国风湿病协会(ACR)联合推出的RA诊断标准。有下列任意一项者均不入选:严重心脑血管、肝肾疾病;恶性肿瘤、败血症、严重感染;其他自身免疫性疾病;对LEF或其中成分过敏。选取该院50名健康医护人员为健康志愿者,其中男26例,女24例,年龄30 ~70岁,均无哮喘、糖尿病,无肝功能异常、血液系统功能障碍疾病,无冠心病病史、手术史、输血史,近1个月内无感染史,近3个月内未使用相关免疫调节剂。以上研究对象入选和排除标准均参考文献[12]。
1.2.2 DCs的分离与培养 抽取研究对象静脉血100 mL,加入肝素抗凝,加等量Hanks液混匀稀释后,缓慢加入含淋巴细胞分离液的离心管中,2 000 r/min离心20 min,轻取界面白色雾状细胞层,Hanks液清洗,获得单个核细胞。将GM-CSF和IL-4加入含有体积分数10%胎牛血清的RPMI 1640培养基中,终浓度均为10 μg/L,制成联合培养基。将单个核细胞接种至6孔平底培养板,使用联合培养基于37 ℃、体积分数5%CO2、饱和湿度条件下培养48 h,吸弃上清,用RPMI 1640培养基轻洗3次,获得贴壁细胞,加联合培养基继续培养,隔天吸去75%培养液,添加联合培养基,再培养7 d。
1.3实验分组参考文献[13]。收集RA患者的DCs混合,分别用0(RA组)、15、30、60 mg/L的LEF处理12 h。将健康志愿者的DCs混合后,作为正常对照。
1.4DCs中TLR4mRNA的检测将DCs用Trizol法提取总RNA,检测RNA浓度和纯度,使用反转录试剂盒合成cDNA,按照实时荧光定量PCR试剂盒配制反应体系,以GAPDH为内参,进行PCR。TLR4正向引物序列为5’-TGGATACGTTTCCT TATAAG-3’,反向为5’-GAAATGGAGGCACCCCT TC-3’;GAPDH正向引物序列为5’-TGCACCAC CAACTGCTTAGC-3’,反向为5’-GGCATGGACTGT GGTCATGAG-3’。反应体系:2×SYBR Premix Ex Taq 10 μL,Rox Reference Dye 0.4 μL,cDNA 2 μL,10 μmol/L的上、下游引物各0.4 μL,补蒸馏水至20 μL。所有操作在冰上进行。反应条件:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。采用2-ΔΔCt法计算目的mRNA的相对表达量。重复测定3次。
1.5DCs中TLR4蛋白的检测将DCs用RIPA裂解液裂解后,4 ℃12 000×g离心20 min,收集上清,BCA法测定蛋白浓度。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,50 g/L脱脂奶粉封闭液室温封闭1 h。分别加入兔抗人TLR4(1∶500)和GAPDH(1∶1 000)多克隆抗体,4 ℃孵育过夜,TBST洗膜10 min×3次;加入HRP标记的山羊抗兔IgG(1∶2 000)室温孵育2 h,TBST洗涤;ECL发光显影。用ChemiDoc XRS+系统成像,用Quantity One软件测定条带灰度值,目的条带和GAPDH条带灰度值的比值为目的蛋白相对表达量。重复测定3次。
1.6DCs细胞表型的检测收集DCs,胰蛋白酶消化后重悬,调整细胞密度为1×105个/mL,与FITC或PE标记的CD80、CD86流式抗体混合,4 ℃孵育30 min,PBS洗涤2次后,每管加入300 μL的PBS溶液重悬,上流式细胞仪检测,记录阳性细胞百分比。重复测定3次。
1.7DCs细胞中IL-6、IL-12含量的检测收集DCs,胰蛋白酶消化后重悬,调整细胞密度为1×105个/mL,超声粉碎后离心取上清,分别使用IL-6、IL-12 ELISA检测试剂盒检测IL-6、IL-12含量。重复测定3次。
1.8DCs对淋巴细胞增殖活性的影响采用混合淋巴细胞实验[14]方法。收集RA患者的DCs,制备成1×106个/mL的细胞悬液,加入丝裂霉素C使终浓度为25 mg/L,37 ℃水浴孵育30 min,离心取沉淀,用PBS洗涤,用含体积分数10%胎牛血清的RPMI 1640培养基重悬,调整细胞密度为1×109个/mL,作为刺激细胞。取健康志愿者外周血10 mL,经过淋巴细胞分离液梯度离心后获取单个核细胞,置于培养皿中,于37 ℃、体积分数5%CO2、饱和湿度条件下培养24 h,吸取悬浮细胞,用含体积分数10%胎牛血清的RPMI 1640培养基重悬,调整细胞密度为1×109个/mL,作为反应细胞。分别取两种细胞各100 μL至培养板混合,然后置于37 ℃、体积分数5%CO2培养箱中培养72 h。加入20 μL的MTT(5 g/L)溶液孵育4 h,去除多余培养液,加入150 μL的DMSO振荡反应10 min,使用酶标仪检测490 nm波长处的吸光度(A)值,表示反应细胞的增殖活性。重复测定3次。
1.9统计学处理采用SPSS 22.0进行统计学分析。5组DCs中TLR4 mRNA和蛋白的相对表达量、细胞表型、IL-6和IL-12含量、反应细胞增殖活性的比较采用单因素方差分析,两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.15组DCs中TLR4表达的比较见图1、表1。与正常对照组相比,RA组DCs中TLR4 mRNA和蛋白相对表达量均升高(P<0.05);与RA组比较,RA+LEF 15、30和60 mg/L组细胞中TLR4 mRNA和蛋白相对表达量均降低(P<0.05),且LEF作用浓度越大,TLR4表达降低越显著(P<0.05)。

1:正常对照组;2:RA组;3、4、5:RA+LEF 15、30和60 mg/L组
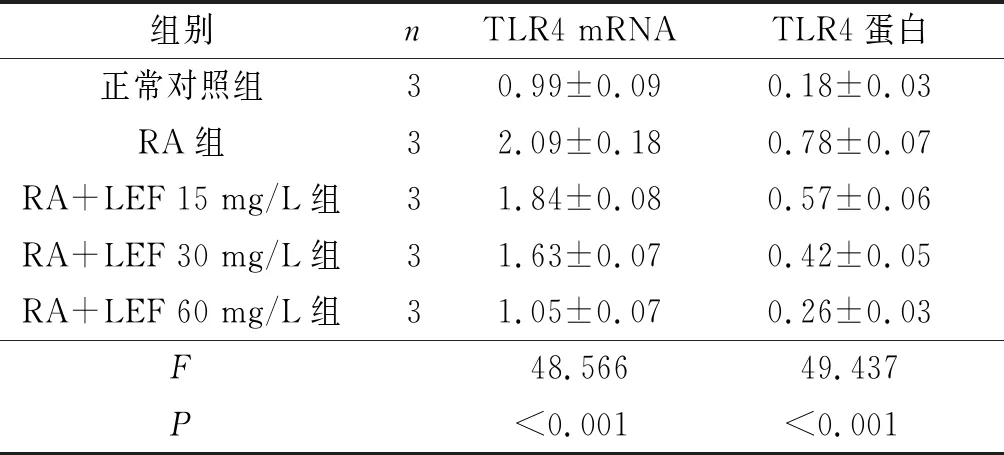
表1 5组DCs中TLR4表达的比较
2.25组DCs细胞表型的比较见表2。与正常对照组相比,RA组CD80+、CD86+细胞百分比均升高(P<0.05);与RA组相比,RA+LEF 15、30和60 mg/L组CD80+、CD86+细胞百分比均降低(P<0.05),且LEF作用浓度越大,CD80+、CD86+细胞百分比下降越显著(P<0.05)。
2.35组DCs中 IL-12和IL-6含量的比较见表2。与正常对照组相比,RA组DCs中IL-12和IL-6含量均升高(P<0.05);与RA组相比,RA+LEF 15、30和60 mg/L组DCs中IL-12和IL-6含量均降低(P<0.05),且LEF作用浓度越大,DCs中IL-12、IL-6含量下降越显著(P<0.05)。
2.45组DCs对淋巴细胞体外增殖活性的影响见表2。与正常对照组相比,RA组反应细胞的增殖活性升高(P<0.05);与RA组相比,RA+LEF 15、30和60 mg/L组反应细胞的增殖活性均降低(P<0.05),且LEF作用浓度越大,反应细胞增殖活性降低越显著(P<0.05)。
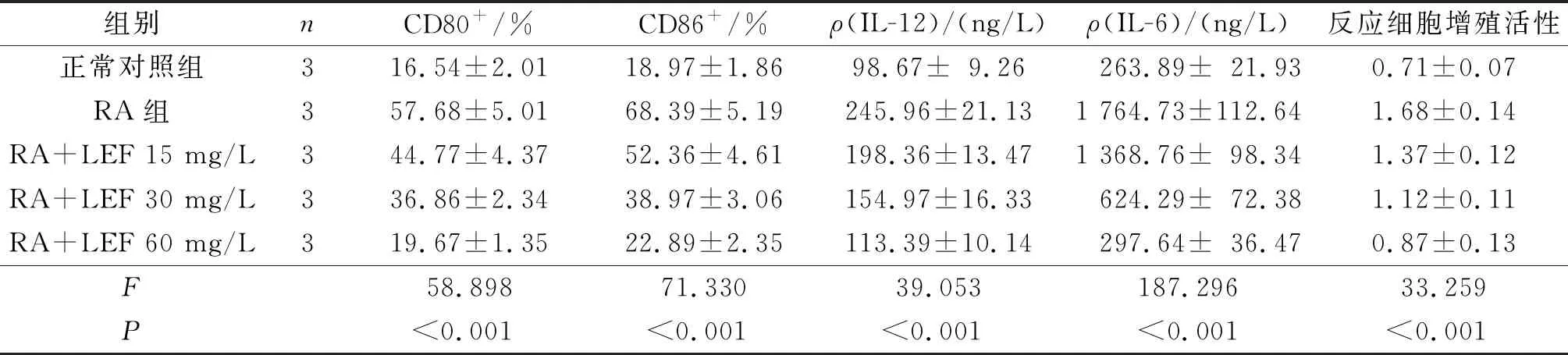
表2 5组DCs细胞表型、IL-12和IL-6含量及反应细胞增殖活性的比较
3 讨论
RA是一种以关节滑膜炎症为特征的慢性全身性自身免疫性疾病[15],治疗的关键在于控制关节及其他组织的炎症,保持关节功能、防止畸形,修复受损关节以减轻疼痛和恢复功能[16]。LEF是第一个专门针对RA的改善病程药物,具有独特的作用机制,可以有效地控制疾病的进展,阻止骨质破坏,改善患者的生活质量[17]。研究[18]表明LEF可降低系统性红斑狼疮患者外周血中CD83的表达,抑制共刺激分子CD86和HLA-DR的表达,抑制DCs的成熟。LEF能显著减少RA患者外周血中Th1/Tc1型细胞因子[19]。LEF可通过抑制Th1型细胞和单核/巨噬细胞CCR5的表达,减轻RA患者Th1型细胞介导的炎症反应[20]。
未成熟的DCs摄取抗原后,迁移到淋巴结,逐渐发育成为成熟DCs,成熟DCs能诱导幼稚T细胞分化成熟,从而启动免疫应答,在RA发生过程中发挥重要作用[21-23]。研究发现,非甾体抗雌激素可以抑制滑膜巨噬细胞分化为DCs,抑制其对T细胞的刺激作用[24];环孢素能显著抑制前体DCs的成熟,抑制其表面共刺激分子的表达,抑制同种T细胞的增殖能力[25]。LEF作为一种免疫抑制剂,已有研究发现其可以阻碍DCs的成熟过程。Wu等[26]发现LEF能够抑制DCs产生细胞因子和趋化因子,通过下调CD80和CD86的表达抑制DCs成熟。Kirsch等[27]发现在分化或成熟阶段用LEF活性代谢物(A771726、LEF-M)处理DCs会导致其成熟失败,CD40和CD80的表达降低;LEF-M显著影响DCs启动T细胞增殖、生成促炎细胞因子IL-12和TNF-α的能力。
本研究发现,与正常对照DCs比较,RA患者DCs中TLR4高表达,CD80、CD86高表达,IL-12和IL-6含量亦升高。经过不同浓度LEF处理后,RA患者DCs中TLR4的表达、CD80和CD86的表达及IL-12和IL-6含量均显著降低;用LEF处理过的RA患者的DCs进行混合淋巴细胞实验,反应细胞的增殖能力均明显受到抑制;且LEF作用浓度越大,上述指标的变化越显著。
综上所述,LEF可以抑制RA患者DCs的免疫功能,其机制可能与调控TLR4的表达有关。
