HINT2抑制脂多糖诱导的HaCat细胞炎症反应*
2020-08-04秦锦博孔舒欣
李 翠, 秦锦博, 孔舒欣, 于 洋, 梁 栋, 张 斌, 尤 伟, 吕 峰
河南大学人民医院,河南省人民医院乳腺外科,郑州 450003
HINT2全称三联组氨酸核苷酸结合蛋白2,属于Hint家族,定位于线粒体,主要功能与细胞能量代谢相关[1]。已有研究表明线粒体中的DNA在触发先天免疫反应以及炎症反应中起着重要作用[2]。脂多糖(lipopolysaccharides,LPS)是革兰阴性菌细胞壁的主要成分,在感染患者体内能测到一定浓度的LPS,它被广泛应用于乳腺炎模型的建立[3]。慢性乳腺炎症可通过趋化、募集炎症细胞及炎症因子到达局部,改变体内炎症因子的分布,促进乳腺癌的发病及转移。对于乳腺炎症机制的理解和探究能为我们提供更好的乳腺癌治疗策略[4]。本研究利用LPS建立炎症细胞模型,研究上调HINT2表达对LPS诱导的人上皮细胞HaCat炎症反应的影响,为进一步阐明HINT2参与乳腺上皮细胞炎症的可能机制提供研究基础。
1 材料与方法
1.1 细胞和主要试剂
人胚肾细胞293T以及上皮永生化细胞HaCat购自ATCC细胞库,逆转录试剂盒、Real-time PCR试剂盒购自Fermentas公司,Trizol试剂购自Invitrogen公司,慢病毒载体pLVX-IRES-ZsGreen1购自Clontech公司,DMEM培养液、胰酶及新生胎牛血清购自Hyclone公司,Lipofectamine 2000转染试剂购自Invitrogen公司,LPS及转染用无血清Opti-MEMI购自Sigma公司,TNF-α、IL-6、IL-10的ELISA检测试剂盒购自Abcam公司,AKT、p-AKT、p65、p-p65抗体购自Cell Signaling公司,单克隆HINT2抗体购自于Santa Cruz公司,GAPDH抗体及HRP标记羊抗兔、羊抗鼠二抗及羊抗鼠荧光二抗购于武汉博士德公司。
1.2 细胞培养
HaCat以含20%胎牛血清的不完全高糖DMEM培养液,置于37℃,5% CO2培养箱中培养,2~3 d传代1次。
1.3 慢病毒载体的构建、包装及感染HaCat细胞
采用pLVX-IRES-ZsGreen1慢病毒载体[4],引物内插入EcoR1/Spe1双酶切位点。HINT2上游引物:5′-CGGAATTCATGGCGGCAGCCGTGGTGCTGG-3′,下游引物:5′-GGACTAGTTCAACCTGGAGGCCACTGGAGC-3′(下划线区域为酶切位点)。PCR扩增基因片段,设置反应条件:95℃预变性3 min;95℃变性10 s,60℃退火15 s,72℃ 30 s,共40个循环;60℃延伸5 min。PCR扩增产物经双酶切后露出ECOR1/SPE1粘性末端,同步双酶切并纯化后连接pLV-IRES-ZsGreen1,通过菌液PCR鉴定、双酶切鉴定、测序鉴定,成功得到过表达HINT2的pLVX-IRES-ZsGreen1慢病毒载体。培养293T细胞至80%~90%融合,用转染试剂将构建好的过表达HINT2的pLVX-IRES-ZsGreen1慢病毒载体转染至293T细胞中,培养后离心收集上清液,纯化浓缩后感染HaCat细胞。
1.4 Real-time PCR
使用Trizol提取各实验分组细胞中的RNA(步骤按照产品说明书),以逆转录试剂盒逆转录RNA合成cDNA,应用ABI7300 Real-time PCR检测仪检测HINT2、TNF-α、IL-6、IL-10的mRNA表达水平。以GAPDH为内参,通过相对定量法(ΔΔCt法)计算相关基因的表达水平。
Real-time PCR引物序列如下,GAPDH上游引物:5′-CATGTACGTTGCTATCCAGGC-3′,GAPDH下游引物:5′-CTCCTTAATGTCACGCACGAT-3′;HINT2上游引物[5]:5′-GGGAGATGGATACCGACTTG-3′,HINT2下游引物:5′-AACAGTTTTATTAGCATCACAGGGT-3′;TNF-α上游引物:5′-CGAGTGACAAGCCTGTAGCC-3′,TNF-α下游引物:5′-TGAAGAGGACCTGGGAGTAGAT-3′;IL-6上游引物:5′-AGCCACTCACCTCTTCAGAACG-3′,IL-6下游引物:5′-TGCCTCTTTGCTGCTTTCACA-3′;IL-10上游引物:5′-GGTTGTCGTCTCATTCTGAAAGA-3′,IL-10下游引物:5′-GGTAGAGGACCCAAGTTCGTTAAGA-3′。
1.5 HaCat细胞上清液中TNF-α、IL-6、IL-10含量检测
收集各组细胞培养上清,以ELISA试剂盒检测其中TNF-α、IL-6、IL-10等细胞因子的水平,具体操作按试剂盒说明书进行。
1.6 Western blot检测蛋白表达
参照Santa Cruz公司所提供的蛋白提取方法,应用蛋白裂解缓冲液(150 mmol/L氯化钠,1%NP-40,1%去氧胆酸钠,0.1%十二烷基磺酸钠,1 mmol/L正钒酸钠,1 mmol/L苯甲磺酰氟)裂解细胞得到总蛋白。以牛血清蛋白作为标准品,根据蛋白定量试剂盒(Bio.Rad公司)绘制蛋白定量标准曲线,分光光度计测570 nm波长处吸光度(A)值,计算提取液的蛋白浓度。取总蛋白50 μg经10%聚丙烯酰胺凝胶电泳分离后电转移到PVDF膜上,5%牛奶封闭后加入一抗(1∶500稀释),GAPDH作为内参照,加入辣根过氧化物酶结合的二抗(稀释度1∶5000),以ECL化学发光试剂盒检测杂交信号。
1.7 统计学方法
2 结果
2.1 利用慢病毒系统在HaCat细胞稳定高表达HINT2
在HaCat细胞中利用慢病毒高表达HINT2,并以Western blot检验蛋白表达(图1A)。ELISA检测高表达HINT2前后HaCat细胞分泌TNF-α、IL-6、IL-10的变化,得到如图1B所示结果。高表达HINT2的HaCat细胞(HaCatHINT2)分泌的TNF-α、IL-6、IL-10与转染空质粒的对照HaCat细胞(HaCatcontrol)比较,差异均无统计学意义(均P>0.05)。
2.2 LPS诱导HaCat细胞释放炎症因子的浓度及时间模型的建立
首先分别给予HaCat细胞500 ng/mL、1 μg/mL、2 μg/mL及4 μg/mL LPS刺激24 h,收获上清,ELISA检测IL-6分泌情况,结果发现1 μg/mL LPS即可刺激IL-6分泌达到峰值[(307.6± 3.7)pg/mL]。接下来以1 μg/mL的LPS作用HaCat细胞0、2、6、12及24 h,发现在作用6 h时IL-6的分泌即可达到峰值[(320.3±5.1)pg/mL],因此选定LPS 1 μg/mL刺激6 h为最佳作用浓度和时间(图2)。
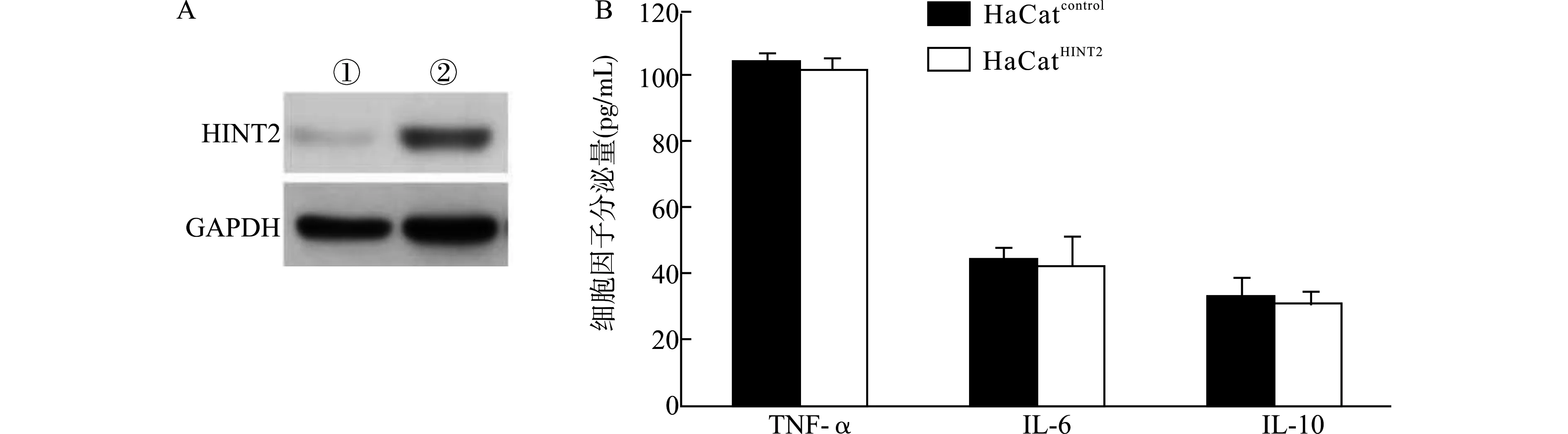
A:Western blot检测HINT2表达,①:HaCatcontrol,②:HaCatHINT2;B:ELISA检测细胞培养上清中细胞因子水平图1 高表达HINT2不影响HaCat细胞的TNF-α、IL-6、IL-10分泌水平Fig.1 Over-expression of HINT2 does not affect the secretion levels of TNF-α,IL-6 and IL-10 in HaCat cells
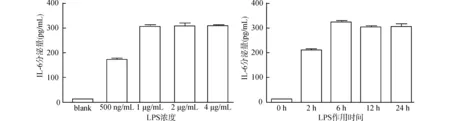
图2 LPS刺激HaCat细胞的炎症模型建立Fig.2 Establishment of inflammation model of HaCat cells stimulated by LPS
2.3 高表达HINT2影响HaCat细胞中由LPS诱导的TNF-α、IL-6、IL-10的分泌
首先检测LPS刺激后HaCat细胞表达和分泌促炎因子TNF-α和IL-6的情况,Real-time PCR结果显示,在1 μg/mL LPS作用6 h后,HaCatHINT2细胞较HaCatcontrol细胞TNF-α和IL-6的mRNA表达均明显降低(均P<0.05)。ELISA检测结果也同样显示,HaCatHINT2组细胞培养上清中的TNF-α、IL-6含量均较HaCatcontrol组显著降低,差异均具有统计学意义[(310.0±52.1)pg/mLvs.(650.2±53.1)pg/mL,(145.6±31.2)pg/mLvs.(305.3±20.3)pg/mL,均P<0.05)]。见图3。
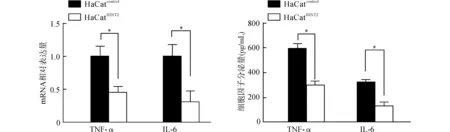
*P<0.05图3 LPS刺激后HaCatHINT2较HaCatcontrol生成及分泌更少的TNF-α和IL-6Fig.3 After LPS stimulation,HaCatHINT2 transcripts and secretes less TNF-α and IL-6 than HaCatcontrol
我们同时还检测了抗炎因子IL-10的表达变化,Real-time PCR结果显示,在LPS作用下,HaCatHINT2细胞较HaCatcontrol组IL-10 mRNA表达升高(P<0.05),ELISA检测同样提示HaCatHINT2组分泌的IL-10较HaCatcontrol组显著增加[(113.2±4.2)pg/mLvs.(52.6±2.5)pg/mL,P<0.05)]。见图4。

*P<0.05图4 LPS刺激后HaCatHINT2较HaCatcontrol生成及分泌更多的IL-10Fig.4 After LPS stimulation,HaCatHINT2 transcripts and secretes more IL-10 than HaCatcontrol
2.4 高表达HINT2抑制HaCat细胞中由LPS诱导的NF-κB信号通路激活
通过Western blot检测高表达HINT2后的HaCat细胞在LPS诱导下主要炎症信号通路的变化。我们发现,高表达HINT2后,HaCat细胞中NF-κB通路的p-p65表达降低,而PI3K通路的p-AKT变化不明显(图5)。
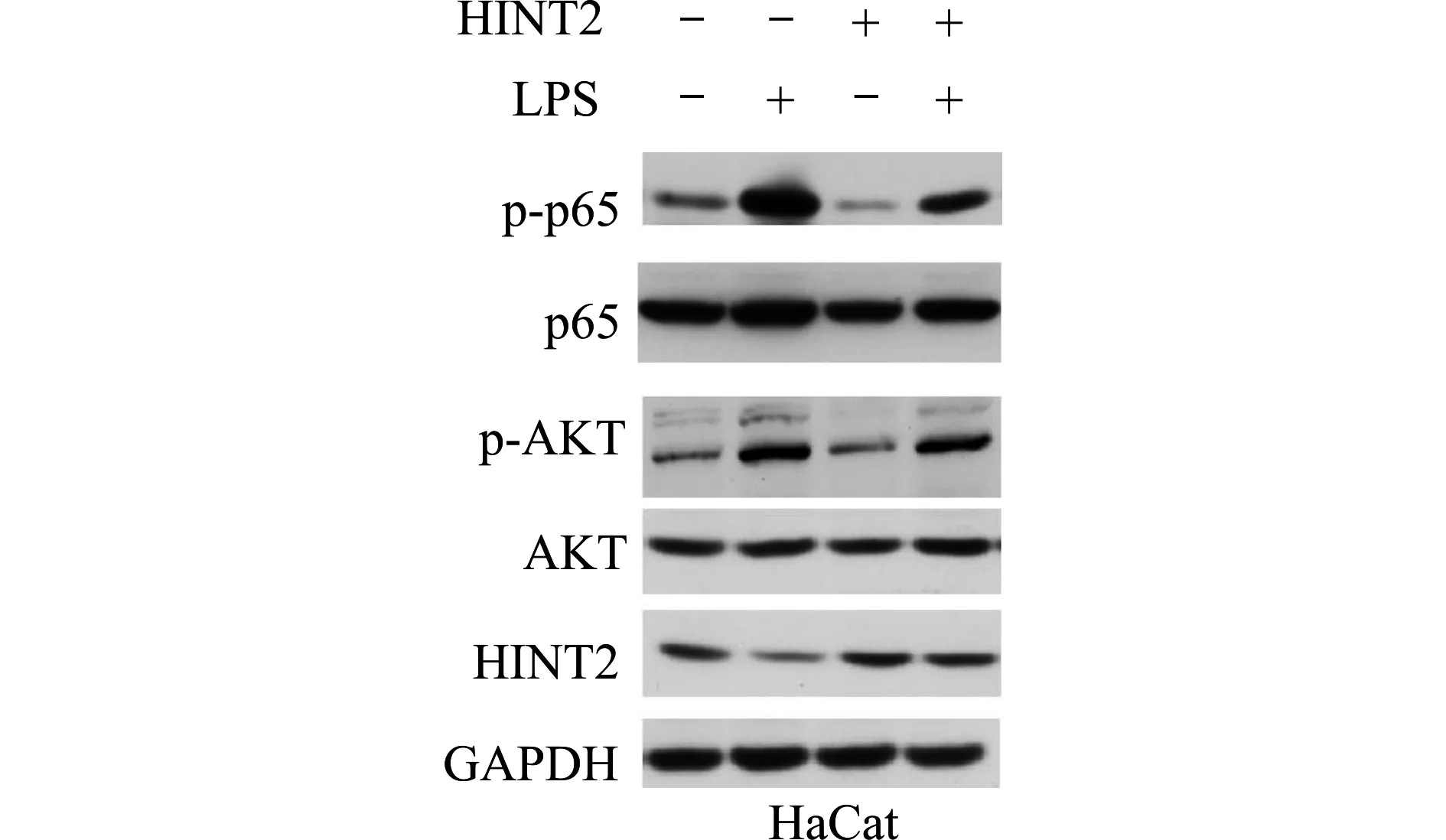
图5 Western blot检测HaCat细胞中NF-κB及PI3K通路的关键信号分子表达Fig.5 Expression of key signaling molecules in NF-κB and PI3K pathway detected by Western blotting
3 讨论
机体的天然免疫系统可保护宿主免受细菌和病毒感染。当细菌和病毒侵入机体时,天然免疫的受体如Toll样受体通过病原体相关分子模式被激活,并可激活下游的重要信号通路,如NF-κB信号通路,诱导细胞释放大量的促炎细胞因子如IL-6、TNF-α和趋化因子等,进而激活炎症途径。目前已有证据支持慢性炎症可导致肿瘤的进展和转移。研究表明Toll样受体介导的乳腺癌炎症调节与乳腺癌转移密切相关[5]。临床上不论是抑制炎症的药物(例如非甾体抗炎药物的应用),还是找到能够抑制过度炎症反应的基因,对于控制炎症和对癌症的发生发展及侵袭转移机制的理解都至关重要[6-7]。
HINT2已被发现在多种恶性肿瘤中表达降低,然而HINT2最早被发现的功能为水解酶功能,加之其定位在能量代谢细胞器线粒体上,而线粒体在炎症调节中发挥着重要作用[7],因此我们探索HINT2能否调控急性炎症时的细胞因子分泌,进而调节炎症反应。
我们首先通过细胞内高表达HINT2,检测到炎症因子TNF-α、IL-6及IL-10的分泌释放水平未见明显变化。已经报道NF-κB信号通路及PI3K通路与炎症反应密切相关[8-9],既往也报道过在肿瘤细胞中发现HINT2明显抑制PI3K通路的下游靶蛋白AKT磷酸化的现象[10],然而我们的结果显示高表达HINT2对炎症信号通路没有明显影响,提示在炎症反应未激活时,HINT2在细胞未能发挥调控炎症因子分泌的作用。
但我们发现,在LPS的刺激下,高表达HINT2的HaCat细胞促炎因子TNF-α、IL-6合成、分泌降低,而抗炎因子IL-10表达升高,NF-κB信号通路的p65磷酸化被明显抑制,但PI3K通路下游靶蛋白AKT的磷酸化未受到明显影响。这一结果提示当细胞内炎症反应激活时,HINT2可能主要通过抑制NF-κB信号通路以及p65磷酸化发挥作用,在炎症反应中起负向调控作用,抑制促炎因子的分泌,促进抗炎因子的分泌。同时HINT2可能同炎症刺激因子例如LPS存在互相拮抗的效应。
已有研究表明PI3K和NF-κB信号通路均参与炎症反应的调控,但也有研究报道PI3K通路可能直接通过调控NF-κB通路中的核心蛋白(如p65)调节炎症反应[11-13]。结合上述的研究结论,我们推测HINT2可能可以通过对“下游”p65的调控,对2条通路的促炎作用进行精准的调控。炎症的动态调控对于肿瘤的发生发展有着重要作用,抗炎因子在肿瘤的免疫逃逸中起到重要作用[14],而HINT2在炎症反应未激活时并未促进抗炎因子的分泌,因此HINT2有望成为炎症控制的新靶点,而HINT2在
乳腺炎症中如何通过调节NF-κB信号通路p65蛋白的磷酸化激活进而负向调控炎症因子分泌以及炎症反应的具体机制,将成为我们下一步的研究重点。
